垃圾焚烧飞灰水洗液纯化及无机盐分离
范庆玲 ,郭小甫 ,2,袁俊生 ,2,3
(1.河北工业大学化工学院,天津300130;2.海水资源高效利用化工技术教育部工程研究中心;3.泉州师范学院)
垃圾焚烧处理会产生大量飞灰,其中含有大量可溶性盐[1-2],主要以 Na、K、Ca 的氯盐为主[3],在固化处理前要进行水洗脱氯[4]。飞灰在水洗时氯盐被浸出,产生大量高盐废水[5-6],同时飞灰中的可溶性重金属也会被浸出,会对环境造成严重危害。飞灰水洗液的处理主要是除去重金属后再回收其中的无机盐。
目前含重金属废水的处理方法主要有化学沉淀法[7]、吸附法[8-9]、膜法[10-11]、离子交换法[12]、电化学法[13]等,但是针对飞灰水洗液中重金属去除的方法主要以CO2酸化、碳酸盐及硫化物的沉淀、螯合物的絮凝沉淀等为主。 凌永生等[14]、白晶晶等[15]将废CO2通入飞灰水洗废水中对溶液进行酸化,可有效降低上清液 pH 及 Pb、Zn 等重金属浓度;Mangialardi[16]经降低飞灰水洗废液pH至6.5~7.5可去除其中的重要污染物,使废水pH及重金属离子浓度基本达到排放标准;Djedidi等[17]使用各种沉淀剂对垃圾渗滤液中的重金属进行去除,经过比较NaOH与Na2S联合使用,处理后的废液达到排放标准。飞灰水洗液中无机盐的处理主要是蒸发[18]或者是直接排放,直接排放前要对水进行稀释,浪费大量的水资源。韩大健等[19]将飞灰水洗液真空旋蒸结晶,洗涤后得到较为纯净的KCl,但忽略了对分离后母液的进一步处理;张晓樵[20]对飞灰水洗液进行无害化处理后,进而继续将水洗液蒸发-结晶得到结晶盐泥。上述方法都未细致地研究水洗液中氯盐的分离,若能将水洗液中的氯盐分离回收,对实现飞灰水洗液的资源化利用将具有重大的意义。
笔者采用化学沉淀法对飞灰水洗废水进行纯化,考察了无机、有机沉淀剂单独使用以及二者联用对废水中重金属进行深度去除,并对去除重金属后的水洗液采用多次蒸发分离的方式分离并提纯其中的 NaCl、KCl、CaCl2,为飞灰水洗废水的资源化利用提供一定的参考。
1 实验部分
1.1 实验原料与试剂
实验原料:飞灰水洗废水,来自福建某城市生活垃圾焚烧发电厂。水样主要成分及含量:ρ(Pb2+)=375.86 mg/L;ρ(Cd2+)=3.34 mg/L;ρ(Zn2+)=6.9 mg/L;ρ(Cu2+)=1.18 mg/L;ρ(Mn2+)=0.72 mg/L;w(K+)=5.22%;w(Ca2+)=3.44%;w(Na+)=4.87%;w(Cl-)=18.37%。废水中Pb2+含量极高,此外含有大量的无机盐,主要为无机氯盐。
试剂:Na2S·9H2O(AR);Na2CO3(AR);TMT-102(工业级);MT-103(工业级);RS-2568(工业级)。
1.2 实验方法
1.2.1 飞灰水洗废水中重金属的去除
取一定量飞灰水洗废水,分别添加无机沉淀剂Na2CO3、Na2S 以及有机沉淀剂 TMT-102、MT-103、RS-2658,考察沉淀剂种类及加入量对重金属离子Pb2+、Cd2+、Cu2+、Zn2+、Mn2+的去除效果。 最后,将效果最好的无机、有机沉淀剂联用,考察其对重金属的去除效果。
1.2.2 纯化后水洗液中无机盐的蒸发分离
取一定量纯化后的飞灰水洗液,置于电炉上加热,通过分析不同沸点温度下母液中m(Na)/m(K)、m(K)/m(Ca)、m(Na)/m(Ca)的变化,来分析 NaCl、KCl、CaCl23种盐的结晶规律,从而确定3种盐的适宜分离温度,并通过控制不同蒸发温度分离母液与结晶,结晶出氯化钾、氯化钠和氯化钙等产品。
1.3 分析方法
Ca2+含量采用EDTA滴定法测定;K+含量采用四苯硼钠重量法测定;Cl-含量采用AgNO3沉淀法测定;Pb2+、Cd2+、Cu2+、Zn2+、Mn2+含量采用 TAS-990 原子吸收分光光度计测定。
2 结果与讨论
2.1 飞灰水洗废水重金属的去除
2.1.1 无机沉淀剂对重金属的去除效果
选用Na2CO3、Na2S作为去除重金属离子的沉淀剂,考察沉淀剂加入量对重金属去除效果的影响,结果见图 1。 由图 1 看出,Pb2+、Cd2+、Zn2+、Cu2+、Mn2+5种重金属离子去除率都随沉淀剂加入量的增加而增大。除Zn、Mn两种离子外,Na2S对其余3种重金属的去除效果明显优于Na2CO3,特别是Cu2+,在Na2S添加量很小时就基本去除完全。对重金属总去除效果进行比较,在 n(Na2S)/n(重金属)为 1.5 时,Na2S对重金属的去除基本达到稳定,此时重金属总去除率为 89.02%,Pb2+、Cd2+、Zn2+、Cu2+、Mn2+5 种重金属去除率分别为 94.59%、46.48%、12.83%、96.61%、11.53%;而Na2CO3对重金属去除率基本随着其添加量的增加而增大,这是由于溶液中的Ca2+消耗溶液中的CO,使得Na2CO3的去除效果相对较差。
2.1.2 有机沉淀剂对重金属的去除效果

图 2 有机沉淀剂对重金属的去除效果
有机沉淀剂主要含有二硫基甲酸盐,分子中含有二硫代甲酸基(—CSS—),具有强配位能力,能与多种重金属离子进行鳌合反应,生成不溶性鳌合沉淀物,从而去除溶液中的重金属。选用TMT-102、MT-103、RS-2568 3种有机沉淀剂,考察其加入量对重金属去除效果的影响,结果见图2。由图2看出,5种重金属的去除率都随沉淀剂添加量的增加而明显增大,且不同类型的沉淀剂对不同重金属的去除效果不同。对于Pb2+,TMT-102和MT-103对其去除效果基本相同,且去除效果很好,在药品添加量为400 mg/L时其去除率达到99%以上。TMT-102对Mn2+有最好的去除效果,MT-103对Zn2+与Cd2+的去除率要明显高于另外两种沉淀剂,而对于Cu2+,虽然稳定以后的去除率略有差距,但是3种沉淀剂对其去除效果都在90%以上,去除效果良好。对重金属的总去除率进行比较,RS-2568的去除效果最差,在重金属去除率基本稳定后MT-103的去除效果比TMT-102要高。在MT-103加药量为400 mg/L时,重金属总去除率可达 99.49%,Pb2+、Cd2+、Zn2+、Cu2+、Mn2+5种重金属去除率分别为99.88%、99.72%、95.07%、92.42%、92.08%,此时溶液中 Cd2+、Cu2+、Mn2+离子浓度已经很低,去除效果明显。
2.1.3 无机-有机沉淀剂联用对重金属的去除效果
基于2.1.1节和2.1.2节实验结果,按照n(Na2S)/n(重金属)=1.5添加Na2S处理废水之后,再次添加MT-103进行处理,考察MT-103添加量对重金属的去除效果,结果见图3。由图3看出,除Pb2+、Zn2+外其他3种重金属离子随沉淀剂添加量的增加其去除率稳定,Pb2+、Zn2+随沉淀剂添加量的增加其去除率升高明显,在沉淀剂添加量为40 mg/L时其去除率稳定。对重金属总去除率进行分析,在MT-103添加量为40 mg/L时其对重金属的去除率稳定,此时溶液中重金属总去除率为94.94%,溶液中Pb2+、Cd2+、Zn2+、Cu2+、Mn2+5种重金属去除率分别为97.00%、80.85%、94.33%、32.00%、93.14%。
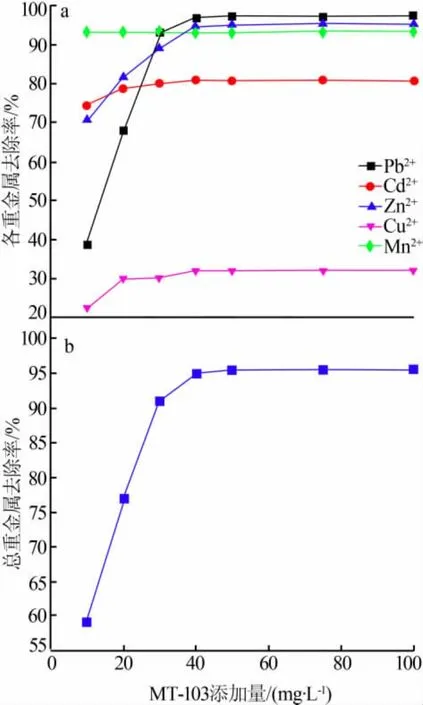
图3 MT-103对重金属的去除效果
将无机、有机沉淀剂联用,废水中 Pb2+、Cd2+、Zn2+、Cu2+、Mn2+5种重金属去除率分别达到 99.84%、99.72%、94.93%、97.50%、91.81%,重金属总去除率可高达99.60%,比无机沉淀剂单独使用时提高了10.58%,比有机沉淀剂单独使用时提高了0.11%。无机-有机沉淀剂联用,弥补了单独沉淀剂使用时对重金属去除的不彻底,并且大大减少了有机沉淀剂的使用量,使飞灰水洗废液进一步得到纯化。
2.2 纯化后飞灰水洗液中无机盐的回收
2.2.1 蒸发分离终止温度的确定
在蒸发结晶析出盐的整个阶段,分析溶液中m(Na)/m(K)、m(K)/m(Ca)、m(Na)/m(Ca),结果见图 4。在蒸发结晶初始阶段,m(Na)/m(K)、m(Na)/m(Ca)一直下降,而 m(K)/m(Ca)基本保持不变,说明结晶初始阶段NaCl开始结晶析出;在温度为116℃以后,m(Na)/m(K)与 m(K)/m(Ca)发生变化,而 m(Na)/m(Ca)依旧继续减小,说明在 116℃以后除了NaCl以外KCl也开始析出;继续升温至124℃,m(Na)/m(K)与 m(K)/m(Ca)已经很小基本不再变化,说明此时溶液中NaCl与KCl基本结晶完全,母液中主要剩余CaCl2。由此可以判断,NaCl与KCl的分离温度在116℃附近,KCl与CaCl2的分离温度在124℃附近,以此为依据进一步对蒸发终止温度进行具体分析。
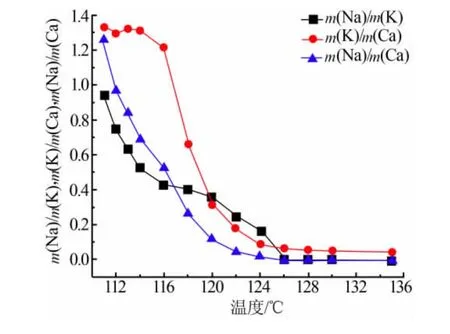
图4 不同蒸发温度下溶液中m(Na)/m(K)、m(K)/m(Ca)、m(Na)/m(Ca)
2.2.2 NaCl与KCl的分离
将纯化后的飞灰水洗液加热结晶,在不同温度下停止加热,高温烘箱保温沉降5 min后趁热倒出上层清液,在盐浆中按照1∶1的比例加入纯化后的飞灰水洗液进行洗涤提纯,一次蒸发终止温度对NaCl纯度的影响见图5a。由图5a看出,随着蒸发温度上升,蒸水量增大,出盐量增多,NaCl纯度逐渐降低,而KCl含量逐渐上升。蒸发终止温度低于114℃时,氯化钠纯度都在95%以上;而蒸发温度高于114℃以后,NaCl中钾含量升高明显。为保证结晶所得NaCl的纯度,选择一次蒸发终止温度为114℃。由图5a看出,CaCl2含量一直很少,其存在的原因是固液分离后母液的夹带。
将分离后的盐浆进行洗涤提纯,提高洗涤温度可适当提高NaCl纯度,洗盐温度对氯化钠纯度的影响见图5b。由图5b看出,随着洗涤温度升高,盐中KCl含量下降明显,在洗涤温度升高至80℃以后,盐中KCl浓度基本不再变化,因此设置洗盐温度为80℃。
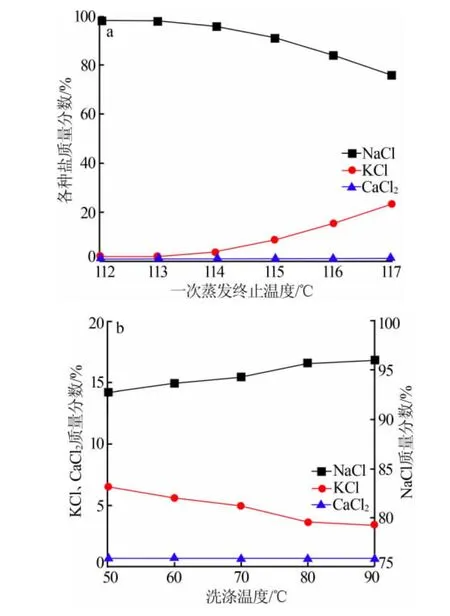
图5 一次蒸发终止温度及洗涤温度对NaCl纯度的影响
2.2.3 KCl与 CaCl2的分离
将一次分离之后的母液继续蒸发,在不同温度下结束加热,降温结晶至30℃,母液中盐的含量随蒸发终止温度的变化见图6。由图6看出,随着蒸发温度升高,母液中CaCl2含量不断上升,而NaCl及KCl由于不断析出其浓度不断降低,在蒸发温度达到126℃时母液中几乎无NaCl,且KCl含量基本稳定,因此选择126℃为二次蒸发终止温度。将多次蒸发分离得到的粗钾进行含量分析,粗钾中KCl质量分数为 55%~64%、NaCl质量分数为 30%~39%,因此需要加水对粗钾进行洗涤提纯。当加水液固质量比为1.5时,氯化钾纯度可达96%以上(折合K2O质量分数为60%以上,符合GB 6549—2011《氯化钾》中农业用优等品的要求)。
2.2.4 CaCl2蒸发结晶
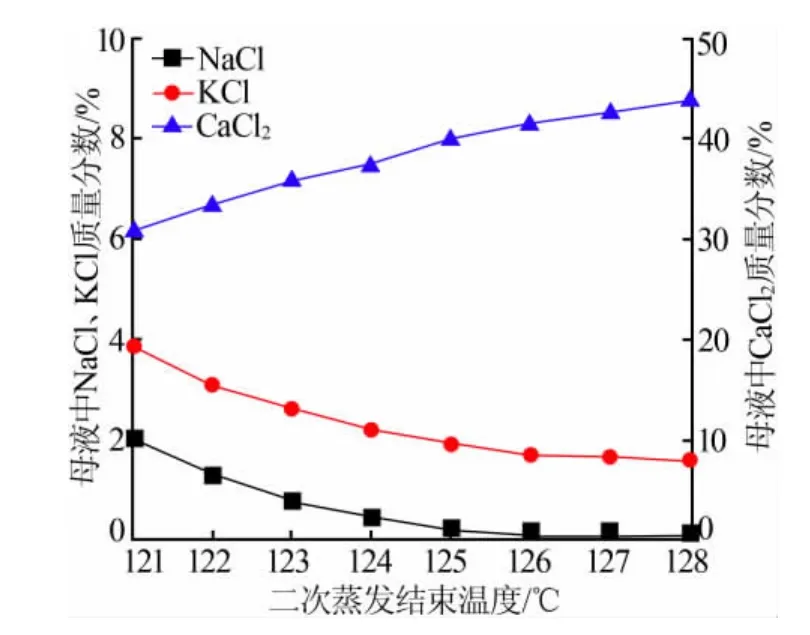
图 6 二次蒸发终止温度对母液中盐含量的影响
将分离粗钾母液进行高温蒸发,在温度为134℃时母液中CaCl2质量分数可达52%以上,然后降温结晶,得到CaCl2·6H2O产品。
将NaCl洗液与粗钾洗液返回飞灰纯化后水洗液进行循环蒸发,物料衡算可得NaCl、KCl、CaCl2的回收率分别为93.41%、94.56%、96.34%。
3 结论
比较无机沉淀剂Na2CO3和Na2S去除垃圾焚烧飞灰废水中重金属的效果,结果表明Na2S的去除效果较好,当Na2S与重金属物质的量比为1.5时,总重金属的去除率可达89.02%。比较有机沉淀剂TMT-102、MT-103、RS-2568去除飞灰废水中重金属的效果,结果表明MT-103的效果较好,在MT-103添加量为400 mg/L时,总重金属的去除率可达99.49%。将无机-有机沉淀剂联用,先按照Na2S与重金属物质的量比为1.5加入Na2S,再向溶液中加入40mg/L的MT-103,重金属总去除率可高达99.60%,此时溶液中 Pb2+、Cd2+、Zn2+、Cu2+、Mn2+5 种离子去除率分别为 99.84%、99.72%、94.93%、97.50%、91.81%,去除效果明显。
将纯化后的飞灰水洗液中的无机氯盐进行蒸发分离,控制第一段蒸发终止沸点为114℃,分离后的盐浆在不低于80℃条件下洗涤提纯,得到NaCl纯度在95%以上。将母液继续蒸发至126℃,然后降温结晶,粗钾按照液固质量比为1.5进行水洗,得到纯度为96%以上的KCl。最后的母液蒸发至134℃,然后降温结晶,可得到含6个结晶水的CaCl2。将NaCl洗后母液与粗钾洗后母液返回飞灰纯化后水洗液中进行循环蒸发,物料衡算可得NaCl、KCl、CaCl2回收率分别为93.41%、94.56%、96.34%。

