纳米和微米一水草酸钙对Vero细胞毒性的浓度效应
饶晨颖 郭 达 孙新园 欧阳健明
(暨南大学生物矿化与结石病防治研究所,广州 510632)
0 引 言
草酸钙晶体是泌尿结石的主要成分之一[1-3]。研究表明,草酸钙晶体能够被肾小管上皮细胞粘附,沉积在肾小管腔和肾间质中,引起肾组织的损伤和功能异常[4-6]。晶体与细胞的粘附作用可能是肾结石发生的早期进程[7-8]。
晶体对细胞性能的影响备受关注[9-11]。众多报道表明,尺寸作为晶体的一项重要物理参数,在晶体与细胞间的相互作用时起到重要的作用。例如,Li等[12]对尺寸分别为 498、68、43和 19 nm的无定形SiO2颗粒对HepG2细胞毒性进行了研究。结果表明,尺寸越小的SiO2粒子其毒性作用越大,这种毒性作用引起了细胞数量减少、细胞收缩、染色质缩合和空泡形成等。Hanna等[13]发现,与6 μm的CuO颗粒相比,42 nm的纳米CuO颗粒具有更高的细胞毒性,后者通过破坏线粒体和损伤DNA,诱导了人肺腺癌上皮细胞(A549)的凋亡。Tamura等[14]研究了不同尺寸的微米级Ti与中性粒细胞 (Neutrophil)间相互作用的影响,相比于大尺寸的Ti颗粒(10、45、150 μm),2 μm 的小尺寸 Ti对细胞的损伤最为严重,造成的生化指标(如超氧化物阴离子、LDH、TNF-α以及IL-1β)的表达量明显增加。而大尺寸的Ti颗粒对细胞损伤较小。Chithrani等[15]通过改变溶液的过饱和度制得不同尺寸的金纳米颗粒(14、50、74 nm),并研究了尺寸的改变对Hela细胞内吞动力学的影响,50 nm尺寸的金纳米颗粒的内吞量最大,并推测尺寸为50 nm的金纳米颗粒为细胞的最优内吞的尺寸。
研究表明,与正常对照组相比较,肾结石患者尿液中存在的尿晶体在尺寸、浓度、晶相和形貌等方面均存在明显差异[16-17]。尿微晶尺寸和浓度的不同会导致其在尿液中的聚集程度、对肾上皮细胞的损伤程度等产生差异,从而影响肾结石的形成。
基于此,在前面的工作中我们合成了5种不同尺寸(50 nm、200 nm、1 μm、3 μm、10 μm)的一水草酸钙(COM)晶体,并比较研究了这些COM晶体对Vero细胞的损伤差异[18-19]。结果表明,COM的尺寸和聚集程度均是影响晶体细胞毒性的重要原因;细胞对晶体的内吞方式与晶体尺寸密切相关[18],Vero细胞内吞50和100 nm的COM主要以网格蛋白介导的途径,而内吞1 μm的COM主要以巨胞饮的形式内吞,对于更大尺寸的微米晶体,Vero细胞很难内吞。本文从浓度效应的角度比较研究纳米和微米COM晶体对肾上皮细胞部分亚细胞器的毒性差异,包括对细胞膜的损伤、线粒体膜电位下降、溶酶体完整性、细胞周期滞留和细胞凋亡等,期望从细胞和分子的水平上进一步阐述细胞损伤、晶体粘附与肾结石形成的机理,为临床上抑制肾结石形成提供新的启示。
1 实验部分
1.1 材料和仪器
材料:非洲绿猴肾上皮细胞株(Vero)(暨南大学生物制药基地);培养液DMEM、胎牛血清(Hyclone,海克隆生物化学制品(北京)有限公司),青霉素、链霉素(北京普博生物技术有限公司);6、12和96孔细胞培养板(耐思生物科技(无锡)有限公司,中国);细胞增生分析试剂盒 (Cell Counting Kit 8,CCK-8)(日本同仁化学研究所),乳酸脱氢酶试剂盒(LDH,上海碧云天生物技术有限公司),生物素化的透明质酸(HA)结合蛋白 (bHABP,德国MERCK公司);吖啶橙(acridine orange,AO),5,5′,6,6′-tetrachloro-1,1′,3,3′-tetraethylbenzimi-dazolylcarbocyanine iodide(JC-1)试剂盒 (上海碧云天生物技术有限公司),Annexin VFITC/PI细胞凋亡检测试剂盒;草酸、无水乙醇及其它化学试剂均为分析纯。
仪器:傅里叶变换红外吸收光谱仪(EQUINOX 55,BRUKER, 德国);X 射线粉末衍射仪(D/MAX 2400,日本);酶标仪(safireZ,Tecan,瑞士),流式细胞仪 (FACS Aria,美国BD公司);荧光显微镜(Leica DMRA2,德国);激光共聚焦显微镜(LSM510 META DUO SCAN,ZEISS,德国);X-L 型环境扫描电子显微镜(SEM,Phillps)。
1.2 不同尺寸COM晶体的合成及表征
参照文献[19],通过改变反应物的浓度、反应温度、溶剂和搅拌速度等参数,制得了尺寸分别约为100 nm和6 μm的COM晶体,XRD和FT-IR表明其为目标产物。XRD的测试条件为:Cu Kα辐射(λ=0.154 nm),40 kV,20 mA,扫描范围 2θ=5°~55°。
含COM晶体的无血清培养液配制:先把称好的晶体铺平,紫外灯照射40 min除菌;然后现用现配,将纳/微米COM晶体分别分散在一定体积的无血清培养液中,配制成浓度为50、100、200和400 μg·mL-1的悬浮液,超声 5 min,备用。
1.3 细胞培养
Vero细胞用含10%(质量分数,下同)胎牛血清和1%(w/w)青霉素、链霉素的DMEM培养液在37℃、5%(体积分数,下同)CO2和饱和湿度下的培养箱中培养。细胞每2 d传代一次,采用胰蛋白酶消化法对细胞进行传代。当细胞达80%~90%汇合后用磷酸缓冲盐溶液(PBS)洗涤2次,加入0.25%(w/w)胰酶-EDTA消化液1 mL,置37℃培养箱约3~5 min,在倒置显微镜下观察消化程度,消化适度后,加入含10%胎牛血清的DMEM培养液3 mL终止消化,充分吹打分散细胞,形成单细胞悬液。
1.4 细胞活力检测
细胞按浓度为 1.0×105mL-1,每孔 100 μL 接种于96孔培养板中孵育24 h。实验模型分为2组,每组重复3孔:(1)正常对照组:加入无血清培养液,不加任何试剂;(2)纳/微米COM晶体处理组:加入浓度为 50、100、200 和 400 μg·mL-1的含纳/微米COM晶体的无血清培养液,孵育6 h。达到作用时间后,每孔加入10 μL的CCK-8试剂,于37℃下孵育2 h,用酶标仪在450 nm处测量吸光度(A),平行测定3个复孔,求A值的平均值。细胞活力(cell viability,CV)的计算式为:CV=Aexp/Acont×100%,其中Aexp为实验组吸光度,Acont为对照组吸光度。
1.5 乳酸脱氢酶(LDH)释放量检测
细胞按浓度为 1.0×105mL-1,每孔 100 μL 接种于96孔培养板中孵育24 h。实验分组同1.4。达到作用时间后,严格按照LDH试剂盒说明书进行操作,在490 nm处测定吸光度求得LDH释放量。
1.6 透明质酸(HA)表达检测及HA荧光强度的定量分析
细胞按浓度为1.0×105mL-1,每孔1 mL接种于12孔培养板中孵育24 h。实验分组同1.4。到达作用时间后,吸除上清液,用PBS洗涤细胞2次,接着用固定液(由 5%(w/w)冰醋酸、10%(V/V)福尔马林和70%酒精(V/V)组成)固定细胞20 min,然后用PBS洗涤细胞 3次, 每次5 min, 再加入100 μL 5 μg·mL-1的bHABP溶液(配制在质量分数3%的牛血清白蛋白溶液中,现用现配),4℃条件下孵育过夜;之后用PBS洗涤细胞3次,每次5 min;再加入100 μL FITC-avidin(异硫氰酸荧光素-亲和素)孵育1 h后,用 PBS 洗涤 3 次,每次 5 min,加入 DAPI(4,6-二脒基-2-苯基吲哚)染色液复染4 min,用PBS洗涤3次,每次5 min;最后用抗淬灭剂封片,置于共聚焦显微镜下观察,细胞表面表达透明质酸的地方为绿色,细胞核经DAPI染色为蓝色。
HA定量分析:HA的荧光强度根据仪器附带的Axiovision软件(ZEISS,德国)确定,每个样品对100个细胞的HA进行定量检测,取平均值。
1.7 溶酶体完整性检测
细胞按浓度为1.0×105mL-1,每孔1 mL接种于12孔培养板。加入含10%胎牛血清的DMEM培养液,37℃下孵育24 h后,实验分组同1.4。吸除培养液,用PBS清洗2遍。 用DMEM 配制的5 μg·mL-1的AO染色15 min。然后用浓度为200 μg·mL-1的纳/微米COM处理6 h。细胞用PBS清洗3遍,荧光显微镜下观察AO在细胞内的分布情况。对于细胞的荧光定量检测,细胞按浓度为1.0×105mL-1,每孔100 μL接种于96孔培养板,AO染液及晶体处理同上。处理时间达到后,酶标仪下检测红色和绿色荧光强度。激发波长为485 nm,反射波长为530 nm(细胞质中AO为绿色)和620 nm(溶酶体中AO为红色)。 溶酶体完整性(lysosomal integrity,LI)的计算式为:LIcont=Ired/Igreen,LIexp=Ired/(Igreen·LIcont), 其中 LIcont表示对照组溶酶体完整性,LIexp表示处理组溶酶体完整性;Ired为红光强度,Igreen为绿光强度。
1.8 线粒体膜电位(Δψm)检测
细胞按浓度为1.0×105mL-1,每孔2 mL接种于6孔板中,加入含10%胎牛血清的DMEM培养液,在37℃、5%CO2、饱和湿度的培养箱中孵育24 h,使细胞汇合成单层。实验分组同1.4。到达作用时间后,胰酶消化收集细胞,离心(1 000 r·min-1)5 min,去除上清液,用PBS洗2次,Δψm的检测按JC-1试剂盒进行。加入200 μL JC-1染液混匀,37℃避光孵育15 min后,通过流式细胞仪进行检测。
1.9 细胞凋亡和坏死率检测
细胞按浓度为1.0×105mL-1,每孔2 mL接种于6孔板中,加入含10%胎牛血清的DMEM培养液,在37℃、5%CO2、饱和湿度的培养箱中孵育24 h,使细胞汇合成单层。实验分组同1.4。到达作用时间后,胰酶消化收集细胞,用Annexin V-FITC/PI双染料染色20 min,染色后的细胞通过流式细胞仪进行分析。
1.10 细胞周期检测
细胞按浓度为1.0×105mL-1,每孔2 mL接种于6孔板中,加入含10%胎牛血清的DMEM培养液,在37℃、5%CO2、饱和湿度的培养箱中孵育24 h,使细胞汇合成单层,改用无血清DMEM培养液孵育12 h,使细胞同步化。实验分组同1.4。到达作用时间后,胰酶消化收集细胞,离心(1 000 r·min-1),去上清液,加1 mL 4℃的PBS缓冲液重悬细胞,再次离心去除上清液,用300 μL的PBS重悬细胞,边振荡,边缓慢将细胞悬液加入到700 μL预冷的无水乙醇中,乙醇终浓度为70%(V/V),4℃避光固定过夜;然后离心 (2 000 r·min-1)10 min, 弃上清液;500 μL PBS 混匀重悬,离心(2 000 r·min-1)10 min,弃上清液,加 200 μL 配制好的碘化丙啶(propidium,PI)染液,37℃避光孵育15 min,过滤,上机。
1.11 细胞表面微晶的SEM观察
细胞按浓度为1.0×105mL-1,每孔2 mL接种于6孔板中,加入含10%胎牛血清的DMEM培养液,在37℃、5%CO2、饱和湿度的培养箱中孵育24 h,使细胞汇合成单层。实验分组同1.4。达到粘附时间后,吸除上清液,用PBS洗涤3次,以2.5%(V/V)的戊二醛于4℃固定24 h后,再用1%(w/w)OsO4固定,接着再用PBS洗涤3次,梯度乙醇(30%、50%、70%、90%和100%,均为体积分数)脱水,最后用乙酸异戊酯固定后,马上CO2临界干燥,喷金包被。样品喷金后在SEM下观察晶体粘附情况。
2 结果与讨论
2.1 细胞活力变化
表1为纳米和微米COM晶体的SEM图像和XRD图。可以看出,它们的尺寸分别约为100 nm和6 μm,为纯相的 COM 晶体(PDF No.17-541)[20]。
图1A为不同浓度的纳米和微米COM晶体与正常Vero细胞作用6 h后的细胞活力变化。它们都对正常Vero存在毒性,使得细胞活力下降。与微米COM相比较,纳米COM导致的细胞活力更低,说明纳米COM对Vero细胞的毒性大于微米COM。随着晶体浓度增加,细胞的活力进一步下降。表明纳米和微米COM对Vero细胞的毒性存在浓度效应。
2.2 乳酸脱氢酶(LDH)释放量变化
细胞凋亡或坏死而造成的细胞膜结构的损害或完全裂解会导致细胞浆内的酶如LDH释放外泄到培养液中[21-22]。因此,LDH释放量可作为细胞膜完整性的标志,通过检测细胞培养上清中LDH释放量从而判断细胞受损的程度。
正常Vero与纳米和微米COM晶体孵化6 h后的LDH释放量如图1B所示。不加晶体的正常细胞的LDH释放量最小,为(6.35±0.22)%。与不同浓度的纳米COM或微米COM作用后,LDH释放量显著增加,表明细胞膜明显受损;且纳米COM的损伤作用明显大于微米COM。
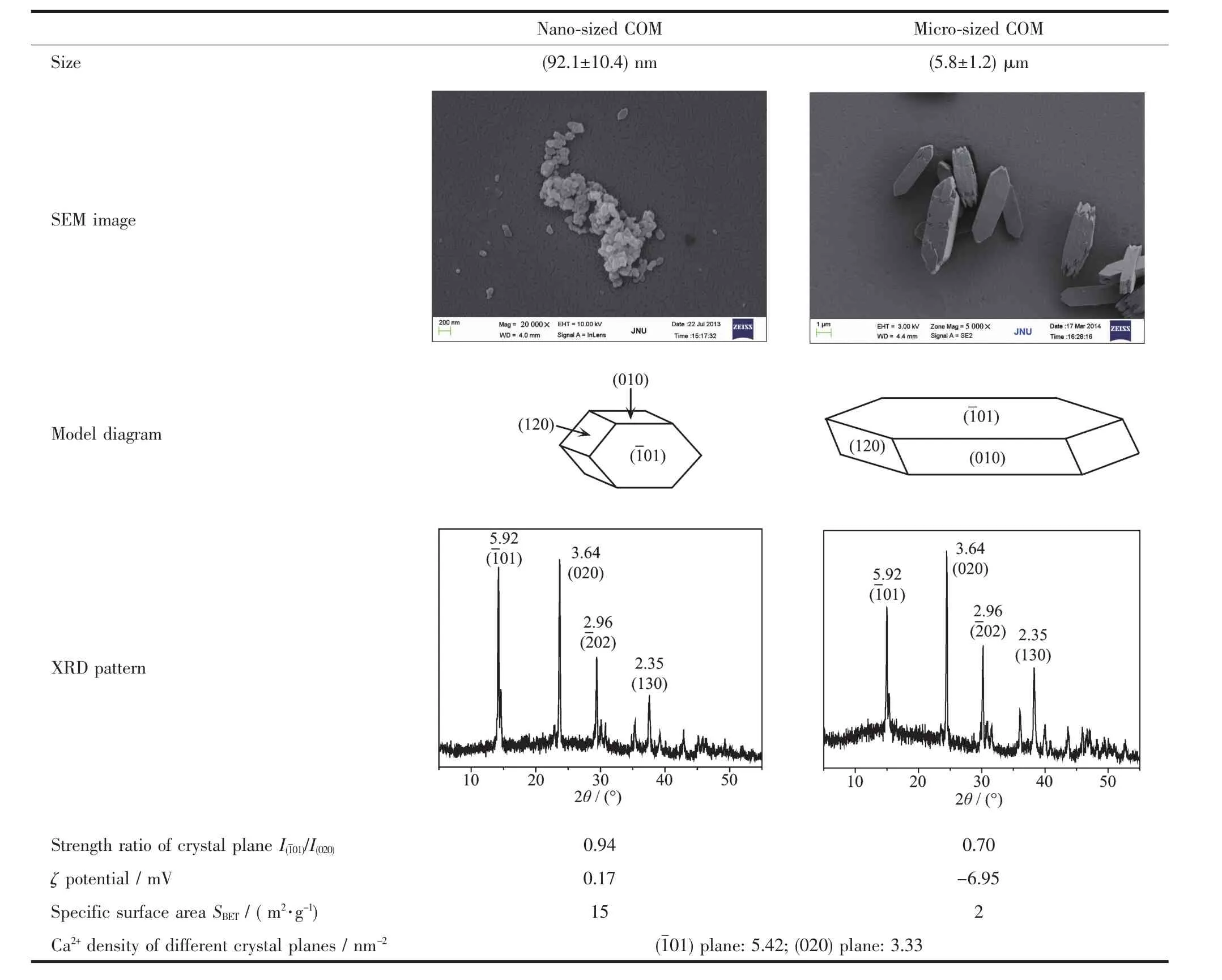
表1 纳米和微米COM晶体的基本性质和主要参数比较Table 1 Comparison of basic properties and main parameters of nano/micro-sized COM crystals
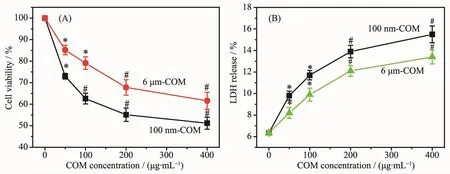
图1 纳/微米COM粘附后Vero细胞活力(A)和LDH释放量(B)的变化Fig.1 Cell viability(A)and LDH release(B)changes of Vero cells after adhesion with nano/micron-sized COM
随着晶体浓度从 100 μg·mL-1增加到 400 μg·mL-1,LDH释放量进一步增加,说明高浓度的COM晶体对细胞膜的损伤作用更大。
2.3 透明质酸(HA)的表达
由图2可知,Vero细胞与COM晶体孵化6 h后,无论微米COM还是纳米COM,都能检测到较强的绿色荧光,说明COM能促使Vero表达HA。随着晶体浓度的增加,绿色荧光增强,说明HA的表达量逐渐增加,尤其是当浓度为400 μg·mL-1时,绿色荧光最强。
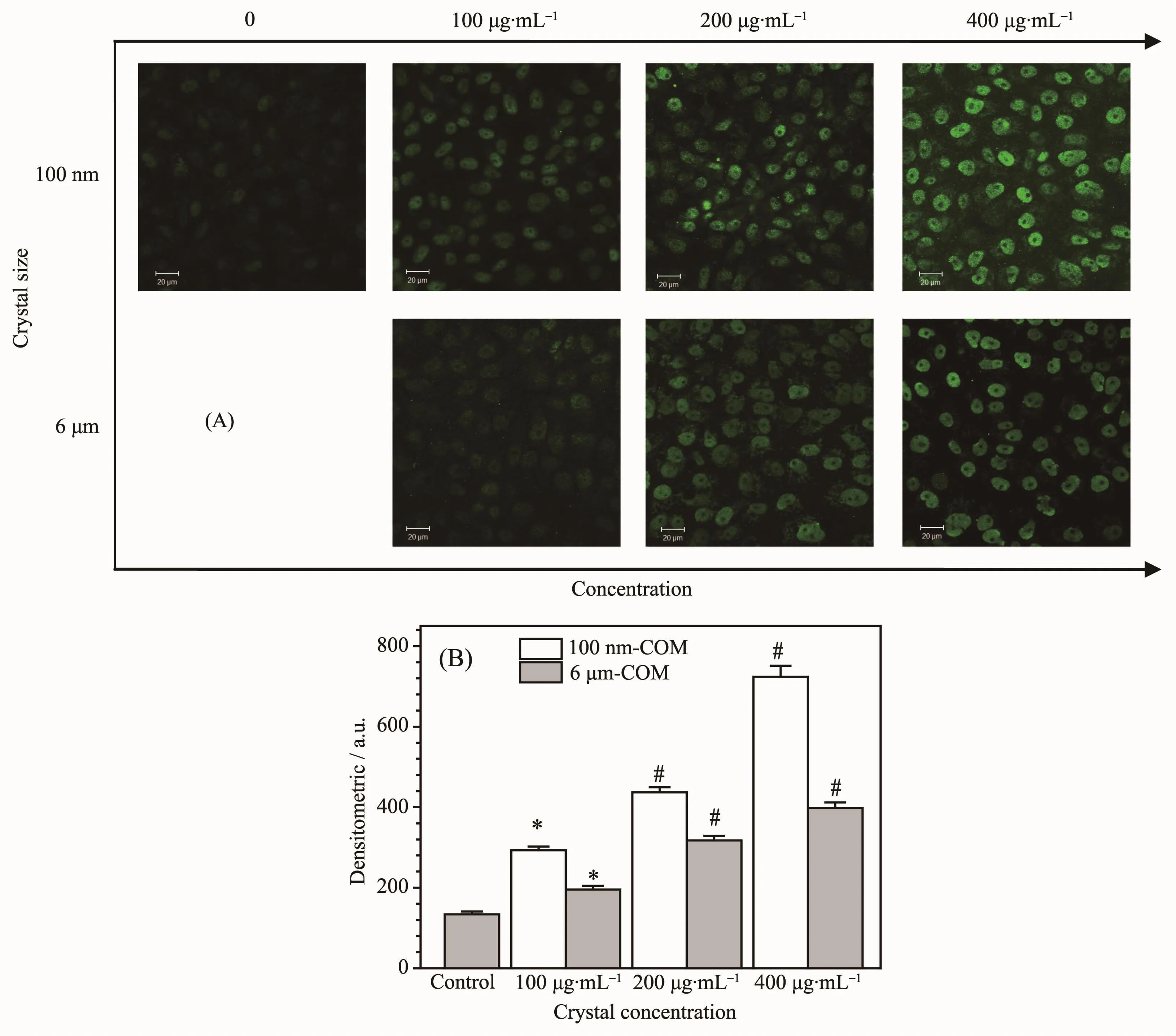
图2 纳/微米COM粘附前后Vero细胞HA的表达:(A)荧光观察图;(B)定量柱形图Fig.2 HA expression of Vero cells before and after adhesion with nano/micron-sized COM crystals:(A)fluorescence observation;(B)quantitative histogram
在相同的晶体浓度时,粘附纳米COM晶体的Vero细胞的绿色荧光比粘附微米COM晶体的强。说明纳米COM对细胞的损伤更大。
2.4 溶酶体的完整性变化
吖啶橙(AO)可以透过细胞膜结构进入溶酶体内,并与其内部的酸性水解酶结合而发红色荧光;而AO在细胞质内则发绿色荧光。正常细胞或者细胞早期凋亡时,溶酶体结构基本保持完整,而坏死细胞破坏了溶酶体的完整结构,橘红色荧光较少。因此可以通过测定红色荧光和绿色荧光的荧光强度比值判定溶酶体的完整性[23]。
纳/微米COM晶体对Vero细胞溶酶体的损伤通过荧光显微镜分析以及酶标仪定量检测(图3)。对照组细胞溶酶体(即橘红色荧光)清晰可见,分布在细胞内各个部位,且与细胞质表现出的绿色荧光叠加呈现出强烈的橘黄色荧光。但是COM晶体扰乱了AO在细胞内的分布,使红色荧光明显减小,这表明细胞的溶酶体受到了破坏;尤其是高浓度的纳米COM处理组,代表完整溶酶体的红色荧光十分微弱,说明纳米COM处理组细胞的溶酶体结构受到了破坏,定量分析溶酶体的完整性,400 μg·mL-1纳米COM处理组仅为(64.26±1.04)%(图3B)。
相比纳米COM,虽然微米COM也造成了细胞体积缩小,细胞质浓缩,但微米COM对细胞溶酶体的影响相对较小。
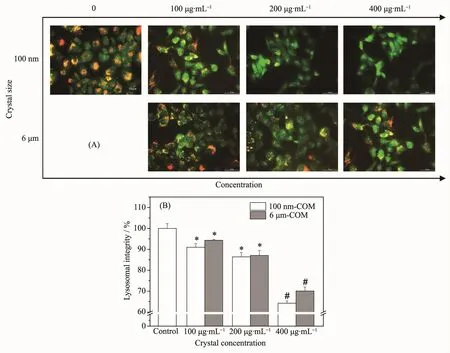
图3 纳/微米COM粘附后Vero细胞溶酶体完整性的变化:(A)荧光观察图;(B)定量柱形图Fig.3 Lysosomal integrity changes of Vero cells after adhesion with nano/micron-sized COM crystals:(A)fluorescence observation;(B)quantitative histogram
2.5 细胞线粒体膜电位变化
线粒体在细胞凋亡过程中起着枢纽作用,线粒体膜电位的下降,是细胞凋亡级联反应过程中最早发生的事件[24]。研究表明,过量H2O2的毒性效应是通过诱发脂质过氧化反应,使线粒体膜流动性下降,改变细胞膜和线粒体膜的通透性,致使Ca2+大量流入细胞和线粒体,从而导致钙超载,激活多种信号转导途径而触发凋亡[25]。
图4为采用JC-1染色法检测的不同浓度的纳米和微米COM晶体对Vero细胞线粒体膜电位的影响。结果表明这些晶体引起的Ired/Igreen比值下降表现出尺寸依赖性和浓度依赖性。随着晶体浓度由100 μg·mL-1增加到 400 μg·mL-1,2 种晶体均导致Δψm不断下降(图 4B),且纳米 COM 引起的 Δψm降幅比微米晶体更为明显。

图4 纳/微米COM粘附后Vero细胞线粒体膜电位(Δψm)的变化:(A)散点图;(B)Ired/Igreen比值Fig.4 Mitochondrial membrane potential(Δψm)changes of Vero cells after adhesion with nano/micron-sized COM crystals:(A)scatter plots;(B)Ired/Igreen
2.6 细胞凋亡和坏死率的变化
采用Annexin V/PI双染通过流式细胞分析仪定量分析了COM晶体对细胞凋亡和坏死的影响。Annexin V染色用于揭示磷脂酰丝氨酸的暴露(细胞凋亡),而PI用于揭示细胞膜的完整性(坏死)[26-27]。如图5所示,在相同浓度下,暴露在纳米COM组的细胞死亡率(Q1+Q2+Q4)大于微米COM,且均随着晶体浓度的增大而逐渐增大。
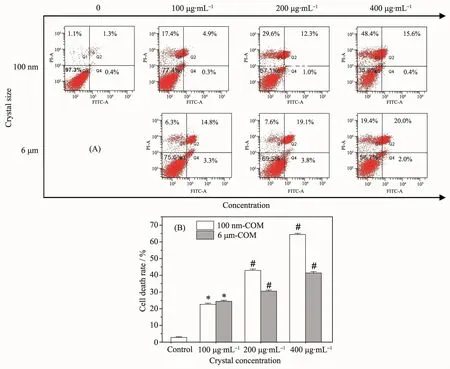
图5 纳/微米COM粘附后Vero细胞死亡率的变化:(A)散点图;(B)定量结果图Fig.5 Cell death rate changes of Vero cells after adhesion with nano/micron-sized COM crystals:(A)scatter plot;(B)quantitative result plot
2.7 COM晶体对细胞周期的影响
碘化丙啶(PI)是一种双链DNA的荧光染料。PI和双链DNA结合后产生的荧光强度与DNA含量成正比。细胞内的DNA被PI染色后,可以用流式细胞仪测定,然后根据DNA的分布情况分析细胞周期和细胞凋亡[28]。为了研究纳米和微米COM对细胞周期的影响,我们通过PI染色后利用流式细胞仪进行了分析(图6A)[29]。可以看出,纳米COM晶体导致的S期细胞数量比微米的多。如在浓度400 μg·mL-1时,纳米和微米COM导致的S期的细胞数量分别为20.13%和19.40%。与此同时,G1期的细胞数量也随着晶体尺寸的减小发生了不同程度的下降,即纳米晶体引起了更多的细胞滞留在S期,并引起G1期细胞数量减少。

图6 纳/微米COM粘附后Vero细胞周期的变化:(A)细胞周期分布图;(B)G1期、S期、G2/M细胞比率Fig.6 Cell cycle changes of Vero cells after adhesion with nano/micron-sized COM crystals:(A)representative images of cell cycle;(B)G1,S,and G2/M cell ratios
2.8 SEM观察
为了更直观地观察纳/微米COM晶体与Vero作用后细胞和晶体的微观变化,通过SEM对纳米、微米COM晶体粘附6 h后的细胞进行了表征 (图7)。可以看到,纳米COM处理组的细胞收缩变圆,晶体聚集在细胞的表面。而微米COM处理组细胞表面粘附的晶体个数较少,粘附晶体的区域发生凹陷,细胞膜破裂。
当细胞被损伤之后,细胞的表面微结构和极性会发生显著改变,如带负电荷的磷酯酰丝氨酸(PS)由细胞膜的内侧转移到外侧,并在顶端膜表面表达各种能够吸引钙离子和草酸钙晶体的带负电荷的物质如透明质酸(HA)、胶原蛋白和骨桥蛋白(OPN)等[30-32],这些负电荷的物质分布在细胞膜表面后,成为吸附Ca2+离子和带正电荷的COM微晶的位点,从而促进草酸钙晶体的成核、生长和黏附。

图7 SEM观察Vero细胞与纳/微米COM的粘附:(A,B)100 nm-COM;(C,D)6 μm-COMFig.7 SEM observation of the adhesion of nano/micron-sized COM crystals to Vero cells:(A,B)100 nm-COM;(C,D)6 μm-COM
2.9 纳微米草酸钙晶体引起肾上皮细胞损伤差异的原因
草酸钙晶体与肾细胞的作用与肾结石形成密切相关。晶体对细胞的损伤会促进晶体的粘附,而晶体的粘附又进一步加重对细胞的损伤[33-34]。本文结果显示,纳米、微米COM晶体都会对Vero细胞产生损伤,且呈现浓度依赖性。细胞损伤后,促进了HA的表达(图2),使晶体粘附量增多[35]。在相同晶体浓度下,纳米COM晶体表现出比微米COM晶体更高的细胞毒性,且更容易粘附和聚集在细胞的表面。造成这种毒性差异的原因可能是:(1)晶体尺寸的差异。纳米晶体一方面由于尺寸较小,容易被细胞内化,进入细胞内部,导致线粒体功能障碍,最终导致细胞死亡[36-37];另一方面,内吞的晶体会被转运到溶酶体内,并被降解成草酸根离子和钙离子,造成溶酶体内离子强度的变化,渗透压失衡,破坏溶酶体的完整性,导致细胞的坏死[38-39]。而微米晶体因为晶体尺寸较大,更易于粘附在细胞表面,使细胞膜损伤,甚至破裂,LDH释放量增加(图1B),进而导致细胞内环境遭到破坏,引起细胞死亡[40]。因此,虽然纳米、微米草酸钙晶体都会对细胞产生毒性,但它们引起的细胞损伤程度不同。(2)晶体比表面积的差异。纳米COM晶体具有较大的比表面积(表1),其表面会有更多暴露的原子或离子,例如Ca2+和Ox2-,因此晶体表面存在丰富的活性位点,与细胞间的相互作用要比微米COM更强,细胞毒性更大,粘附量更多(图7)。(3)晶体表面电位的差异。表1中电位数据显示,纳米COM比微米COM更加不稳定,因此,纳米COM更容易聚集在细胞表面(图7)。
3 结 论
尺寸为100 nm和6 μm的COM晶体均能降低细胞活力、增加LDH释放量和HA表达量、破坏溶酶体完整性、降低线粒体膜电位、提高细胞死亡率、导致细胞周期滞留在S期,且都呈浓度依赖性。在晶体浓度相同时,纳米COM的细胞毒性比微米COM强。对纳米、微米COM晶体细胞毒性的比较,有助于进一步阐明草酸钙结石的形成机理,并为其预防提供启示。

