溴结构域蛋白4表达与肝癌患者预后的关系及其对HCCLM3细胞增殖和凋亡的影响
杨少华,谢楠,钱程,李春满,付必莽
(1渭南市中心医院,陕西渭南714000;2昆明医科大学第二附属医院)
肝癌恶性程度极高,多数患者确诊时已到晚期,即使手术根治性切除,5年生存率仍不足20%[1]。溴结构域蛋白4(BRD4)是近年来新发现的溴结构域蛋白分子,参与肿瘤发生的多个过程,如细胞周期、增殖、凋亡等。其功能与乙酰化有关,参与阅读分子组蛋白及与组装染色质复合物和转录激活因子特定的启动子位点。它是一种核蛋白质与乙酰化组蛋白3(H3)和组蛋白4结合(H4)的特定结构域,并在维护染色质结构和控制转录过程中起重要作用。其可通过RNA的磷酸化延伸CDK9.5-9 BRD4聚合酶Ⅱ稳定核NF-κB及控制NF-κB下游靶基因的功能。研究表明,BRD4与黑素瘤、肺癌、多发性骨髓瘤、伯基特淋巴瘤等均有密切关系。以上研究结果均提示BRD4可能具有促癌基因的功能,但其与肝癌的关系尚不明确。2013年7月~2018年2月,我们通过体外抑制肝癌细胞中BRD4表达,观察肝癌细胞增殖、凋亡能力的变化。现报告如下。
1 材料与方法
1.1 材料 收集2013年7月~2018年7月昆明医科大学第二附属医院和昆明医科大学第一附属医院收治的208例肝癌患者,男122例、女86例,平均年龄52.25岁。Child-Pugh分级以A级为主,巴塞罗那临床分期0/A期147例、B/C期61例。取手术切除的癌组织和对应的癌旁组织。本研究经医学伦理委员会批准,患者均签署知情同意书。高表达BRD4的肝癌细胞株HCCLM3购自中科院昆明细胞库及上海细胞库。PBS、TBS购于武汉谷歌生物工程有限公司,DMEM、RPMI1640培养基购于昆明贝尔吉生物公司,BRD4兔抗单克隆抗体购自美国Abcam公司,蛋白定量试剂盒、二抗、ECL发光液及GAPDH单克隆抗体购于武汉博士德生物公司,Annexin Ⅴ-FITC/PI细胞凋亡试剂盒、CCK-8试剂盒购于苏州宇恒生物科技有限公司,多功能酶标仪为PerkinElmer型号,流式细胞仪为美国BD公司FACSCantoⅡ流式细胞仪。
1.2 肝癌组织中BRD4表达及对患者预后的影响观察
1.2.1 肿瘤组织及癌旁组织中BRD4表达检测 采用免疫组化法。将肿瘤组织及癌旁组织加入4%多聚甲醛固定,石蜡包埋,切片,脱蜡和水化,修复抗原,滴加封闭液。加入BRD4一抗,4 ℃过夜。PBS冲洗,滴加二抗。DAB显色,苏木素复染,中性树胶封固。阳性细胞核着色为棕黄色。采用双盲法观察切片,以细胞核染黄色或褐色为阳性表达。根据阳性细胞百分比和染色强度进行评分。阳性细胞百分比1%~25%、26%~50%、51%~75%、>75%分别计0、1、2、3分,染色强度无、弱、中、强分别计0、1、2、3分。两项评分相加,≤3分为低表达,>3分为高表达。
1.2.2 肝癌患者预后评价方法 术后随访4~8年、平均5年。随访方式为定期门诊体检,肿瘤复发的标准是影像学、实验室检查及临床综合诊断。术后生存期是指手术后到患者死亡的时间。
1.3 沉默BRD4表达对肝癌细胞增殖、凋亡的影响观察
1.3.1 细胞分组与处理 将HCCLM3随机分为空白组、空载组、shRNA-1抑制组。置24孔板中培养,取对数生长期细胞进行转染。慢病毒载体设计、合成与验证均在前期实验完成。目的基因shRNA-1序列:5′-GGCTGGGAATGTGGTCTACAA-3′。shRNA-1组转染对应的BRD4慢病毒抑制基因序列,空载组加慢病毒空载体及转染试剂Polybrene,空白组只加转染试剂Polybrene。转染48 h后进行荧光检测(绿色荧光蛋白),观察转染效率,72 h时采用Western blotting法检测各组BRD4表达水平,观察慢病毒载体沉默效率。
1.3.2 细胞增殖能力观察 利用CCK-8法。选取前述转染72 h的各组细胞,按1 000/孔接种于96孔板,每组设3个复孔。每孔加入10 μL CCK-8试剂,培养箱中继续培养1~2 h。于酶标仪上测量480 nm处各孔光密度OD值,以OD值表示细胞增殖情况。
1.3.3 细胞凋亡情况观察 采用流式细胞术。选用前述转染72 h的各组细胞,胰酶消化吹散并收集各组细胞,用预冷的PBS洗涤。加入结合缓冲液重悬细胞,调节细胞密度为1×105/mL,并加入Annexin Ⅴ混匀,室温避光孵育5 min。加入PI染液重悬细胞,室温避光孵育10~30 min。上流式细胞仪检测,采用FloMax2.82软件分析实验结果。
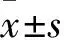
2 结果
2.1 肝癌组织中BRD4表达变化及对预后的影响
2.1.1 肝癌组织和癌旁组织中BRD4表达比较 肝癌组织中BRD4高表达156例(75.0%),低表达52例(25.0%);癌旁组织中BRD4高表达30例(14.4%),低表达178例(85.6%)。肝癌组织中BRD4高表达率高于癌旁组织(P<0.01)。
2.1.2 肝癌患者BRD4表达与预后的关系 208例患者中,术后复发104例,其中BRD4高表达患者复发74例,复发率71.1%;低表达患者复发30例,复发率28.9%。高表达患者复发率较低表达患者升高(P<0.01)。所有患者中位生存期为37.3个月,其中BRD4高表达患者术后生存期为22.6个月,低表达患者为42.7个月,高表达患者术后生存期较低表达患者缩短(P<0.01)。见图1。

图1 不同BRD4表达水平的肝癌患者术后Kaplan-Meier生存分析
2.2 沉默BRD4表达对肝癌细胞增殖和凋亡的影响
2.2.1 各组细胞BRD4表达水平比较 shRNA-1抑制组、空载组、空白组BRD4表达量分别为1.48±0.28、6.18±1.13、6.32±1.25,shRNA-1抑制组低于其他两组(P均<0.05)。
2.2.2 各组细胞增殖能力比较 shRNA-1抑制组、空载组、空白组细胞增殖OD值分别为0.43±0.11、0.66±0.17、0.67±0.08,shRNA-1抑制组低于其他两组(P均<0.05)
2.2.3 各组细胞凋亡率比较 shRNA-1抑制组、空载组、空白组细胞凋亡率分别为29.80%±4.08%、3.50%±0.07%、1.30%±0.02%,组间两两比较P均<0.01。
3 讨论
BRD4是溴结构域蛋白分子BET家族最新成员,相对分子质量约为152 kD,定位于细胞核[1~3]。BRD4在正常组织中不表达或极低表达,但可在多种恶性肿瘤组织及细胞中呈现高表达,可增加肿瘤细胞的恶性程度,增加其侵袭与转移能力,与肿瘤的发生发展、恶性表型以及肿瘤免疫密切相关[4]。我们的前期研究发现,BRD4蛋白可在肺癌、肝癌及结直肠癌等肿瘤中高表达[2~6]。本研究结果显示,肝癌组织中BRD4表达率高于癌旁组织,BRD4表达越高,患者术后肿瘤越容易复发,且BRD4表达越高患者生存期越短,表明BRD4可作为肿瘤预后的潜在评价指标。
多项研究指出,BRD4与部分肿瘤细胞的增殖密切相关。体外实验表明,过表达BRD4基因可增强相关肿瘤细胞的增殖能力及活力。Liu等[7]报道,BRD4存在于细胞的多个部位,在细胞增殖过程中,BRD4可发生质-核穿梭,该过程增加了细胞的恶性程度,使其运动能力增强,是肿瘤细胞转移的重要因素之一。部分研究者认为,BRD4基因内包含特定核定位序列,当肿瘤细胞发生质-核穿梭后,细胞核内部的BRD4可影响细胞周期相关蛋白Cyclin E/D1表达,而这两者表达量的相对比例可影响或加速细胞周期G/S期的转变,经过上述过程,BRD4可最终促进肿瘤细胞的增殖。Rhyasen等[8]将合成的BRD4慢病毒载体转染到人结肠癌细胞株SW-620及RKO中,结果显示细胞增殖率较对照组加快,认为BRD4可加速肿瘤细胞增殖;同时研究发现,在裸鼠皮下荷瘤实验过程中,过表达BRD4基因的裸鼠皮下形成的瘤体明显生长加速且瘤体更大。Jiang等[9]用As2O3抑制相关肝细胞癌BRD4表达后,发现BRD4基因明显被抑制,同时可影响JAK2/STAT3信号通路,该通路被抑制后可影响肝癌细胞的生长。同时,BRD4蛋白与多个细胞凋亡相关信号分子及通路有关。研究显示,BRD4与非小细胞肺癌的发病同样关系密切,BRD4高表达可促进肿瘤细胞发生恶性转变,且促进相关肿瘤细胞上皮发生EMT转化,促进肿瘤细胞的侵袭转移,同时抑制肿瘤细胞凋亡。该过程的发生可能与Bcl-2/Bax比例失调有关,最终促使Caspase-3改变[6]。在BRD4与肝癌的发病研究中,也发现BRD4过表达可能激活BRD4/Twist/WNT5A信号来诱导肝癌细胞增殖和EMT[6,7,10]。
另有研究指出,BRD4可通过诱导缺氧诱导因子HIF的激活及下游相关分子的表达,促进肿瘤细胞增殖和恶性转变;同时该研究指出,高表达的BRD4可促进上皮细胞的恶性转化,加速肿瘤细胞的增殖,促进其转移过程[7]。本研究结果显示,通过慢病毒载体抑制BRD4表达后,细胞增殖明显减弱,同时凋亡能力增强。这表明可通过抑制BRD4基因表达,在体外抑制相关细胞增殖,并促进其凋亡过程。
相关研究表明,BRD4过表达不但可促进多种肿瘤细胞增殖,还可抑制肿瘤细胞凋亡。我们的前期研究显示,在肝癌及结直肠癌细胞中,应用慢病毒载体过表达或抑制BRD4基因表达后,可导致多种相关肿瘤细胞侵袭及迁移能力的变化,该过程可能与PI3K/AKT通路激活有关[2,7,9]。有研究者采用BRD4-RNAi转染人结直肠癌LOVO细胞后发现,CXCR-12趋化因子及其受体的表达会上调,同时也会激活JAK2/STAT3信使RNA的转录与下游多种相关蛋白表达水平,促使相关细胞凋亡率升高[8,9]。我们的前期研究发现,肝癌裸鼠剔除BRD4基因后,可明显抑制癌细胞向肺脏转移的倾向[11]。Rhyasen等[8,9]研究发现,通过抑制细胞BRD4基因表达可增加促凋亡蛋白Bax表达,亦会抑制抗凋亡蛋白Bcl-2表达,而Bax和Bcl-2表达水平的改变可影响Caspase-3、Caspase-9激活,并最终促进细胞凋亡的发生。我们在后续研究中发现,通过抑制BRD4基因可促使细胞外相关信号调节蛋白1/2,并促进肿瘤细胞凋亡。此外,多项研究发现,在高表达BRD4的非肿瘤细胞上,可通过过表达BRD4基因阻断Fas/FasL信号通路及下游相关蛋白,并最终抑制相关细胞凋亡[11~15]。
本研究结果表明,通过体外抑制BRD4表达后,肝癌HCCLM3细胞凋亡率明显增加。肿瘤细胞的高增殖率及低凋亡率是其恶性度的集中表现。同时,我们发现,shRNA-1组抑制BRD4表达效率较好,效果明显。本研究结果显示,抑制BRD4表达后,HCCLM3细胞凋亡率增加,表明可在体外通过抑制BRD4基因表达促进细胞凋亡。我们也观察到BRD4高表达患者的肿瘤复发率较低表达患者升高,术后生存期较低表达患者缩短。
综上所述,BRD4表达可影响患者预后,高表达BRD4的患者术后生存期缩短。通过体外慢病毒载体转染肝癌细胞HCCLM3,使其BRD4表达抑制,可抑制细胞增殖、促进细胞凋亡,有望成为肝癌潜在的治疗靶点及治疗药物研发新方向。

