烟草育苗基质典型腐生真菌的分离鉴定及其碳源代谢特征分析
周浩,向立刚,陈乾丽,汪汉成,余知和
1 长江大学生命科学学院,湖北 荆州 434025;
2 贵州省烟草科学研究院,贵阳 550081
漂浮育苗是目前我国烟草生产采用的主要育苗方式,烟苗生产效率高,长势整齐,易于管理[1-3]。近年来,随着育苗大棚的连续使用及育苗漂盘的重复使用,局部烟区育苗工厂发生多种苗期病害,如苗期灰霉病[4]、立枯病[5]、根腐病[6]等。此外,苗期长期低温寡照,温室大棚内湿度高,育苗基质易滋生多种微生物,其中,基质上出现苔藓[7]和腐生真菌较为常见,它们严重影响烟苗的生长,导致部分烟苗枯死。有关烟草育苗基质上出现腐生真菌尚未见报道。为此,本文对烟苗漂盘育苗基质上出现的典型腐生真菌进行分离,并结合形态学特征和rDNA-ITS序列分析对其进行了鉴定,同时对其在Biolog FF板上碳源代谢特征进行了分析。研究结果对了解烟草育苗基质腐生真菌的种类和指导烟草苗期病害的防治提供了理论基础。
1 材料与方法
1.1 样品采集
2017年3—4 月在贵州省遵义市正安县斑竹烟叶站育苗大棚内,采集典型的带有腐生真菌的烟苗苗盘基质置于无菌采样袋内,4℃保存于贵州省烟草科学研究院微生物实验室,待用。
1.2 腐生菌分离
采用组织分离法[8]对基质上典型腐生真菌进行分离,样品于PDA培养基、28℃黑暗下培养3 d,用接种针挑取边缘的菌丝接种到PDA培养基上纯化培养,重复接种三代。将纯化的培养物依次编号,并于4℃下保存。
1.3 腐生菌鉴定
1.3.1 形态学鉴定将纯化的菌株接种到PDA培养基28℃黑暗培养3 d,观察菌落形态;7 d后从平板上挑取少量菌丝进行镜检,观察其菌丝和分生孢子的形态特征。
1.3.2 分子生物学鉴定
将保存的菌株接种至PDA 培养基上,生长7 d,从培养皿中刮取菌丝,放入装有50 μL裂解液(大连宝生物工程有限公司)的离心管中,80℃水浴裂解15 min,取裂解后液体3 μL,采用引物 ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对 ITS内转录间隔区进行 PCR 扩增[9-11]。PCR扩增体系:Premix Taq(EX Taq version 2.0 plus dye)(大连宝生物工程有限公司) 25 μL,DNA模板 3 μL,引物( 20μmol/L)各1 μL,去离子水补足至50 μL。PCR反应条件:94℃预变性10 min,94℃变性30 s,55℃退火30 s,72℃延伸105 s,进行30个循环,72℃后延伸5 min。PCR产物经处理后送至上海捷瑞生物工程有限公司进行测序。测序结果在GenBank(www.ncbi.nlm.nih.gov)数据库中进行BLAST对比分析。在NCBI 数据库中登录该真菌的基因序列信息。用分子进化遗传分析软件MEGA 7.0中Neighbor-Jioning方法构建ITS序列系统进化树。
1.4 致病性测定
致病力测定选用烤烟主栽品种云烟87,烟苗在贵州省烟草科学研究院温室内培育至两片子叶。将分离的3株腐生真菌在PDA 培养基上活化培养3 d,用直径8 mm的打孔器从菌落边缘打取菌碟,将菌碟1)分别接种于刺过伤口的烟苗叶片上,2)分别接种于无伤口的烟苗基质上,以未接菌烟苗处理作为对照。接菌后,将烟苗置于相对湿度70%、23℃恒温培养10 d,观察烟苗发病情况。采集发生病害的烟苗样品,采用组织分离法对病原菌进行分离,并参照1.3.2的方法对病原菌进行分子生物学鉴定。
1.5 碳源代谢特征分析
采用BIOLOG FF 96孔微孔板对分离所得真菌进行鉴定,并进行其碳源代谢特征分析,按照BIOLOG公司FF的操作指南进行碳代谢测试[12-14]。收集在PDA平板上培养7 d的腐生真菌的分生孢子,用分生孢子调整接种液的浊度为75% T,将菌悬液倒入V型加样槽中,移液器将100 µL菌悬液依次加入微孔板所有孔中,28 ℃黑暗培养,96 h后检测分离真菌对95种碳源物质的代谢情况。根据真菌利用95种碳源物质进行新陈代谢过程中产生的氧化还原酶与显色物质发生反应而导致的颜色变化、以及微生物生长造成的浊度差异进行鉴定。获得真菌的代谢“指纹图谱”,通过智能软件将获得的图谱与数据库比对,获得最大限度的匹配,得出鉴定结果。根据鉴定结果,以菌株JZ-1、JZ-2和JZ-3为对象,根据其在Biolog FF微孔板上96 h后的代谢图谱,分析腐生真菌对95种碳源的代谢特征。
2 结果与分析
2.1 腐生真菌分离
经组织分离共得到3株菌株,依次编号为JZ-1、JZ-2和JZ-3,各菌株的菌落形态如图1所示。腐生真菌菌株JZ-1、JZ-2及JZ-3在PDA 培养基上生长良好,2 d即可长满培养皿。初生菌落均为白色,3 d后转为黄绿色,5 d后菌株JZ-1、JZ-2变为绿色,菌株JZ-3变为墨绿色。

图1 菌株菌落形态Fig.1 Colony morphology of strains
2.2 腐生菌鉴定
菌株JZ-1和JZ-2的菌丝纤细无色,具分隔,多分枝。分生孢子梗丛束疏松,环状排列,主分枝呈树状,其上有众多次级分枝。分生孢子呈球形、倒卵圆形,大小为2.50~3.75 μm。菌株JZ-3分生孢子梗呈环状排列,次级分枝单个或以2~3个为一组,分枝弯曲或波状。分生孢子呈球形,直径为2.5~4.8 μm。形态学鉴定结果表明,3株真菌均与木霉菌属Trichoderma真菌形态类似。
引物ITS1F/ITS4从菌株JZ-1、JZ-2和JZ-3基因组中均扩增出长度约为600 bp的DNA片段。利用Blast进行同源性比较比对,结果显示菌株JZ-1(MG171155)和JZ-2(MG171156)与已报道的Trichoderma harzianum(KJ000320)同源性达100%,菌株JZ-3(MG171157)与已报道的Trichoderma asperellum同源性达100%(表1)。
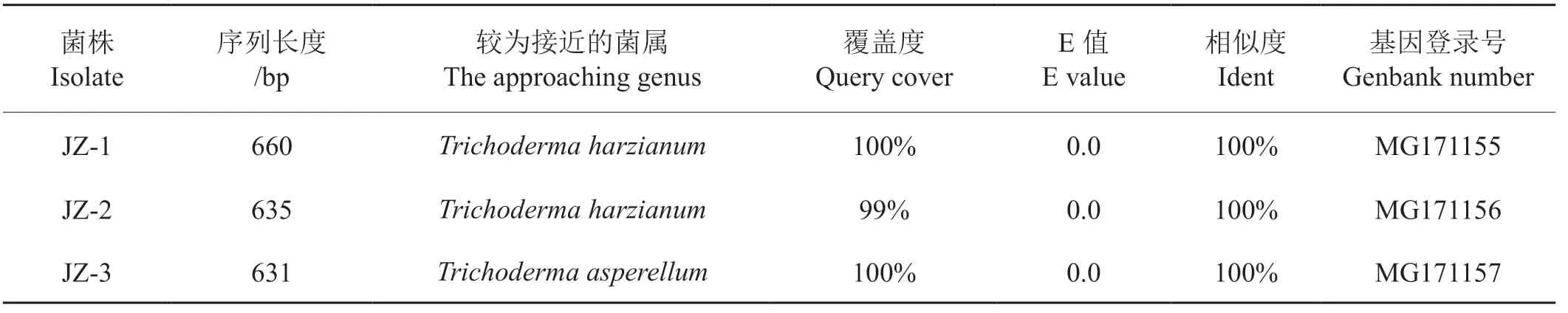
表1 腐生真菌的分子生物学鉴定Tab.1 Molecular identification of saprophytic fungi
3个菌株的系统发育树如图2所示。
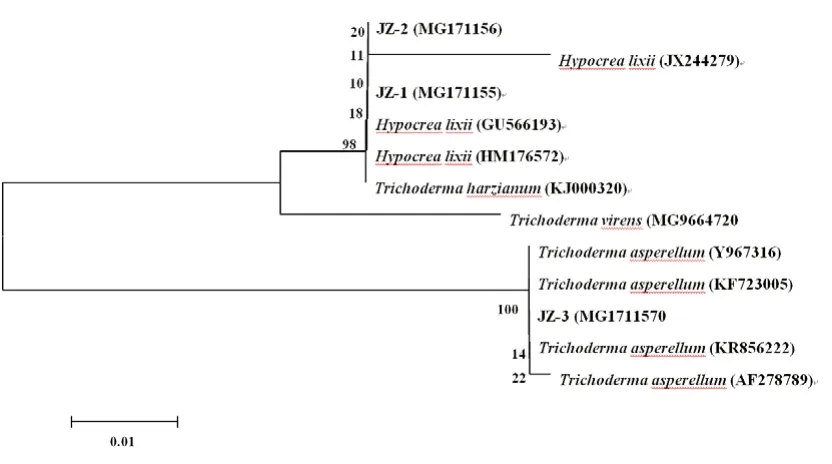
图2 腐生真菌JZ-1、JZ-2和JZ-3的ITS序列系统进化树Fig.2 Phylogenetic tree of saprophytic fungi JZ-1, JZ-2 and JZ-3
综合形态学特征及ITS序列分析结果,菌株JZ-1和JZ-2被鉴定为哈茨木霉(Trichoderma harzianum),菌株JZ-3被鉴定为棘孢木霉(Trichoderma asperellum)。
2.3 致病性测定
致病性测定结果如图3所示。叶片创伤接菌10 d后,菌株JZ-1、JZ-2和JZ-3均可使烟苗发病(图3 B中b、c、d)。发病部位初呈水渍状,逐渐扩展,病斑褐色,叶片随着接菌时间的延长而腐烂,最后烟苗腐烂至死。基质接菌10 d后,菌株JZ-1、JZ-2和JZ-3均未能使烟苗发病(图3 D中b、c、d)。

图3 腐生菌致病性测定Fig.3 Determination of the pathogenicity of saprophytic fungi
对菌株JZ-1、JZ-2和JZ-3创伤接菌的感病烟苗重新进行病原菌分离,得到菌株R-JZ-1、R-JZ-2和R-JZ-3。对其进行分子生物学鉴定,经鉴定,R-JZ-1和R-JZ-2 ITS基因序列与已报道的Trichoderma harzianum同源性达100%,菌株R-JZ-3的与已报道的Trichoderma asperellum同源性达100%。它们的基因登录号分别为MH598839、MH598840和MH598841。
2.4 碳源代谢特征分析
腐生真菌的碳源代谢特征如表2所示。哈茨木霉JZ-2能利用单糖、醇、多糖等59种碳源,有57种碳源能促进其产孢,其中,D-纤维二糖、糊精、赤藓糖醇、D果糖等24种碳源能促进该菌株大量产孢。棘孢木霉JZ-3能利用单糖、醇、多糖能利用55种碳源,有53种碳源能促进其产孢,其中,N-乙酰基-ß-D-葡萄糖胺、赤藓糖醇、D果糖、乳果糖、麦芽糖、D-甘露醇、D-甘露醇、D-蜜二糖、α-甲基-D-半乳糖苷、D-山梨醇、D-塔格糖11种碳源能促进该菌株大量产孢。菌株JZ-2和JZ-3都能利用的碳源有44种,都无法利用的有27种。
3 讨论
形态学特征分析是一种传统的、基础的微生物鉴定方法,通过显微镜观察菌丝、孢子和分生孢子梗的形态来确定归属[15]。真菌ITS序列分析是目前最常用的分子鉴定方法之一,通过核苷酸序列的同源性比对来确定待测微生物的属种。Biolog鉴定是基于微生物对碳源代谢的特征性图谱来进行鉴定的。本文采用3种方法相结合的手段对烟草育苗基质中典型腐生真菌进行了分离与鉴定,并对其碳源代谢特征进行了系统分析。研究结果对了解育苗基质中腐生真菌的种类和指导烟草苗期病害的防治奠定了基础。
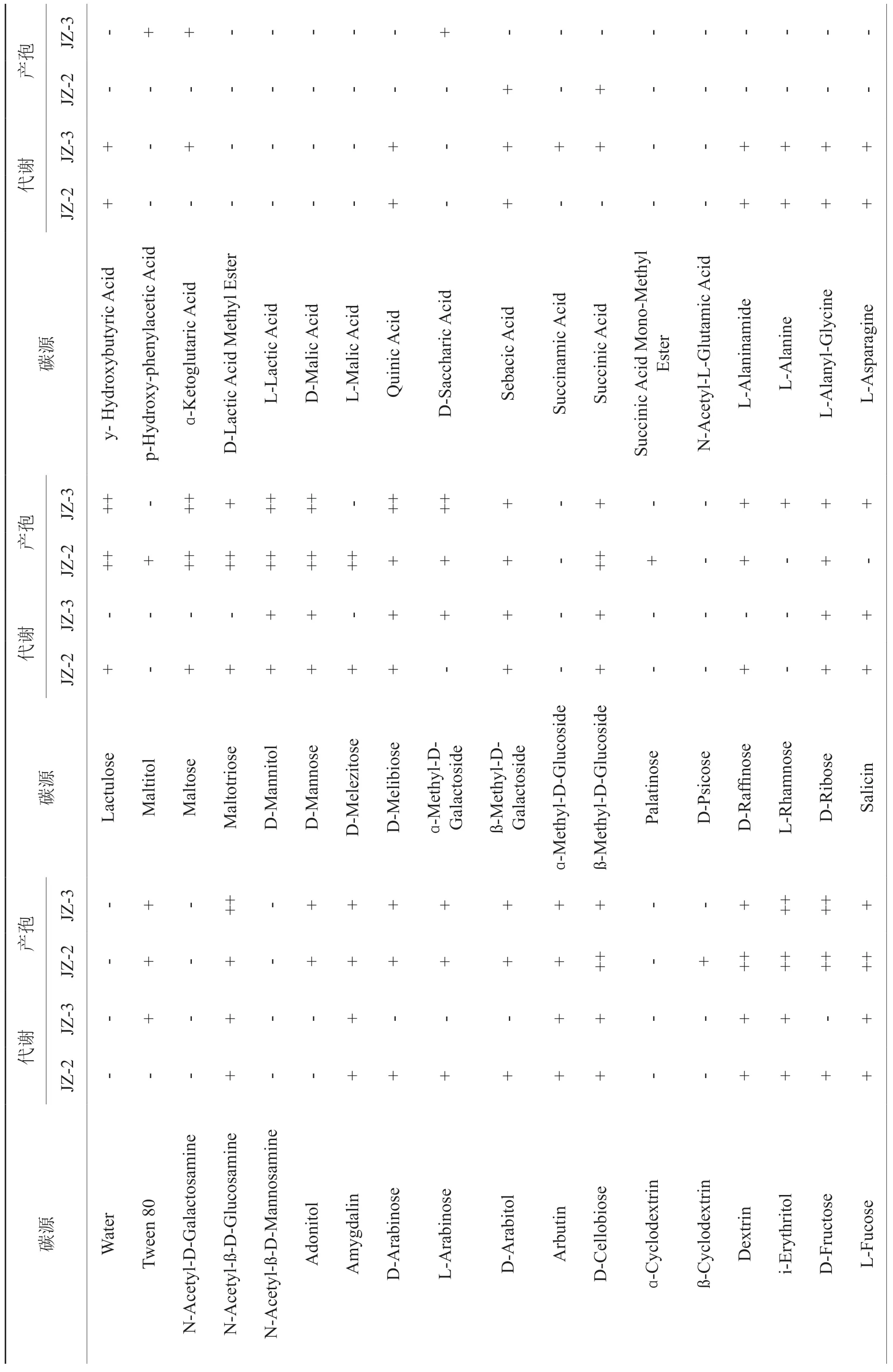
表2 腐生真菌对Biolog FF 板碳源的利用及其产孢情况Tab.2 Carbon substrate utilization and sporulation of saprophytic fungi on Biolog FF microplate
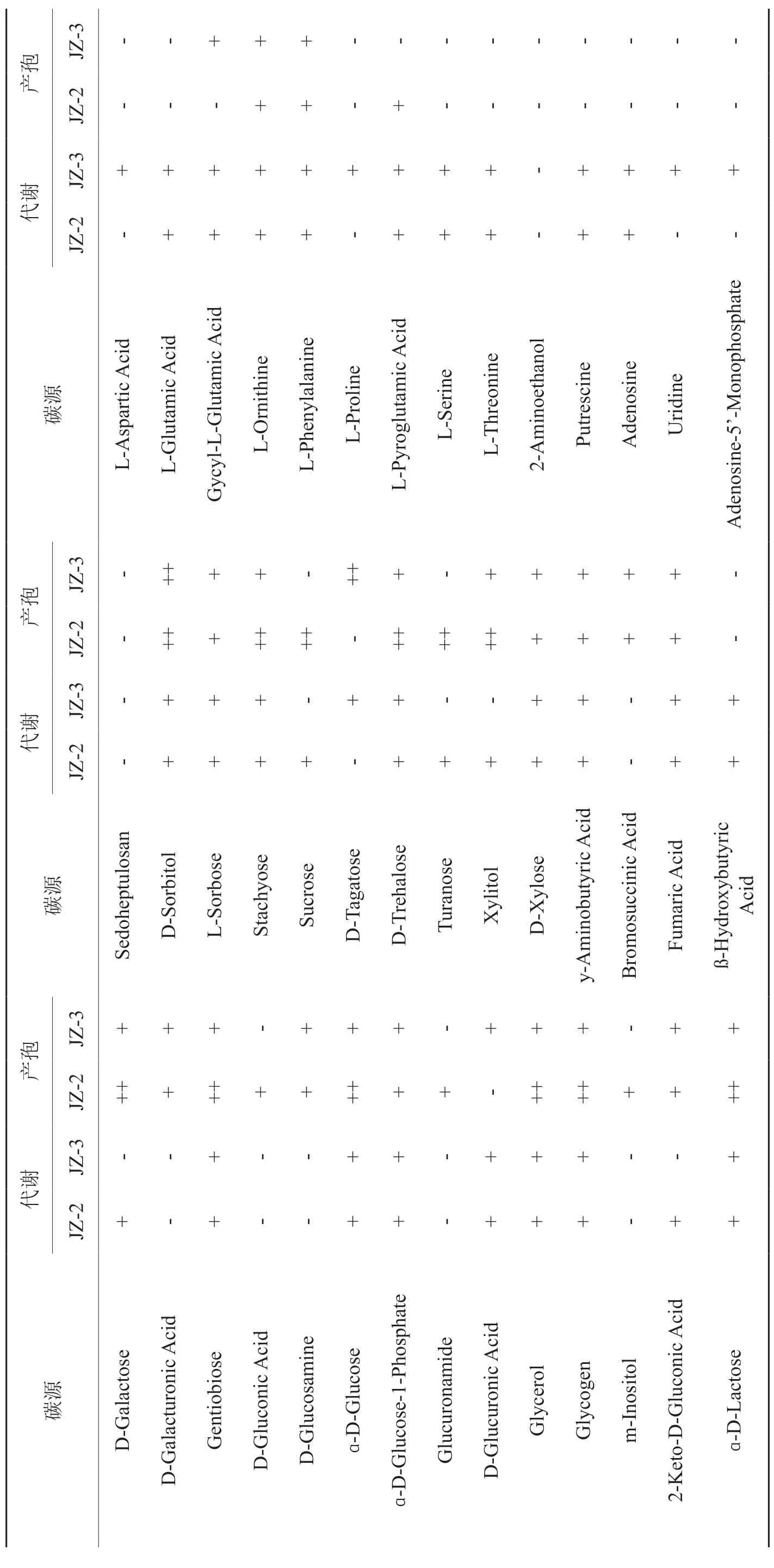
续表2
漂浮育苗基质是烟草漂浮育苗的核心,除具有支持和固定植株外,更重要的是充当中转站的作用,使来自营养液的养分和水分得以中转至烟苗。目前国内外常用的基质主要是富含有机质的材料,如草炭或腐熟的植物残体等再附加膨胀珍珠岩、蛭石等[2]。育苗基质出现菌落可能是基质纯度和物料腐熟程度不合乎要求,抑或是环境中微生物利用其丰富的营养而生长。木霉适应环境能力强,广泛存在于自然界土壤、空气和腐烂植物残体等多种基质中[16-18]。为此,本文较容易从烟草育苗基质中分离获得木霉菌。据报道,木霉菌具有产生抗生素、细胞壁分解酵素和诱导植物抗性等特性,可用于生物防治、土壤改良、生物肥料等[19]。木霉菌可以适应一定范围的生物胁迫和生理压力[20-21]。作为生防菌,研究发现木霉菌具有比一般致病菌更强的竞争和生存能力,在抑制病原菌生长、尤其在土传病害的防治中起着重要作用[22],成为一种很有开发利用价值的生防菌。庄敬华等人的研究表明生防木霉菌(Trichoderma virideT23)对甜瓜安全,对动物和环境无较大影响[23]。相比而言,本文发现烟草育苗期,条件合适时漂盘基质表面出现大量腐生菌木霉,且生长茂盛,覆盖育苗基质,在烟苗有伤口的情况下可作为致病菌侵染烟苗。由于育苗基质中腐生木霉的相关研究鲜有报道;为此,烟草育苗基质腐生木霉是否影响烟苗的生长、及如何降低其对烟苗的危害还有待下一步深入研究。此外,本文仅分离出木霉,在育苗基质中的微生物还有很多,下一步有待探究其它微生物的种类和作用,为烟草的健康育苗提供基础。
微生物碳代谢特征能反应微生物对多种碳源的利用情况,本文通过分析获得了源自育苗基质的腐生木霉对不同碳源的代谢信息,这些信息为抑制腐生木霉菌的生长及下一步对该类真菌引起病害的防治提供理论依据。哈茨木霉和棘孢木霉均能够利用44种碳源,能促进其大量产孢的碳源有赤藓糖醇、L-海藻糖、乳果糖、麦芽三糖、D-甘露糖、D-松三糖和D-山梨醇;都不能被其利用的碳源有核糖醇、景天庚醛聚糖、苹果酸等27种碳源。为此,今后烟草育苗基质的选择,可以考虑选择富含不能被木霉代谢的载体基质。此外,本文获得木霉菌的碳源代谢信息为今后其生防菌剂开发过程中碳源的选择奠定了基础。

