卷烟烟气小动物口鼻暴露方法的建立及评价
高茜,刘欣,管莹,曾婉俐,向海英,米其利,杨光宇,李雪梅
云南中烟工业有限责任公司技术中心 云南省昆明市红锦路367号
卷烟烟气是一种含有颗粒物、挥发性有机物和气体的混合物。在利用动物模型研究其生物学效应的暴露方法中,口鼻暴露系统和全身暴露系统是烟气生物学效应研究的两种主要方式,其中口鼻暴露方式与全身暴露相比,避免了动物毛发对暴露气溶胶的吸附和过滤[1],同时还可以迅速使暴露塔内的气溶胶分布均匀并节省样品等优点,是各类化学物质及混合物啮齿类动物急性、亚急性和亚慢性吸入暴露的主要方式[2]。国际经济合作与发展组织(OECD)测试导则(TG)健康效应部分TG 403、436、412、413等都对可吸入化学物质及混合物小动物口鼻暴露方法学的关键技术要求进行了详细的描述,其中包括对化学物质暴露环境参数和浓度的稳定性作出了明确的规定,如下:
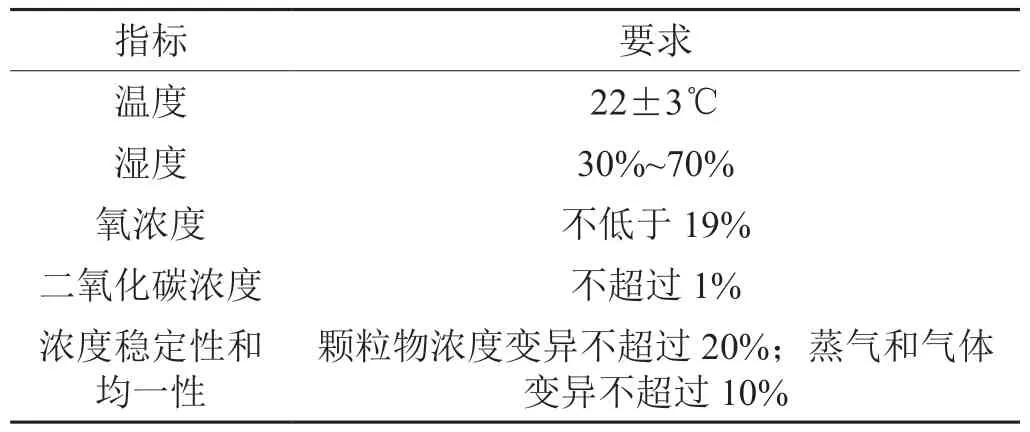
指标 要求温度 22±3℃湿度 30%~70%氧浓度 不低于19%二氧化碳浓度 不超过1%浓度稳定性和均一性颗粒物浓度变异不超过20%;蒸气和气体变异不超过10%
目前啮齿类动物烟气吸入暴露的大多数研究注重生物学效应指标,忽视烟气颗粒物浓度、粒径分布特征和挥发性有机物等暴露特征指标,而上述指标对烟气的生物学效应研究至关重要,因为在动物暴露过程中颗粒物的浓度及其粒径分布特征直接决定着烟气在动物肺中的沉积剂量和部位,也决定着机体对烟气成份的生物学效应[3-5]。目前在小动物口鼻暴露系统上的方法学研究鲜有报道,本研究参考OECD测试导则中吸入暴露的技术要求[6-7],分析不同稀释倍数下4种卷烟烟气颗粒物和挥发性有机物浓度的均一性和稳定性,建立了小动物卷烟烟气口鼻暴露方法,并进一步检测了卷烟烟气暴露小鼠肺灌洗液(BALF)中炎性因子的变化,以期为进一步应用暴露系统开展健康效应研究提供参考。
1 材料与方法
1.1 材料和仪器
材料:市售4种品牌卷烟(2018年2月购自云南昆明当地市场),分别标记为1、2、3和4号,焦油量、烟气烟碱量和烟气一氧化碳量如下:
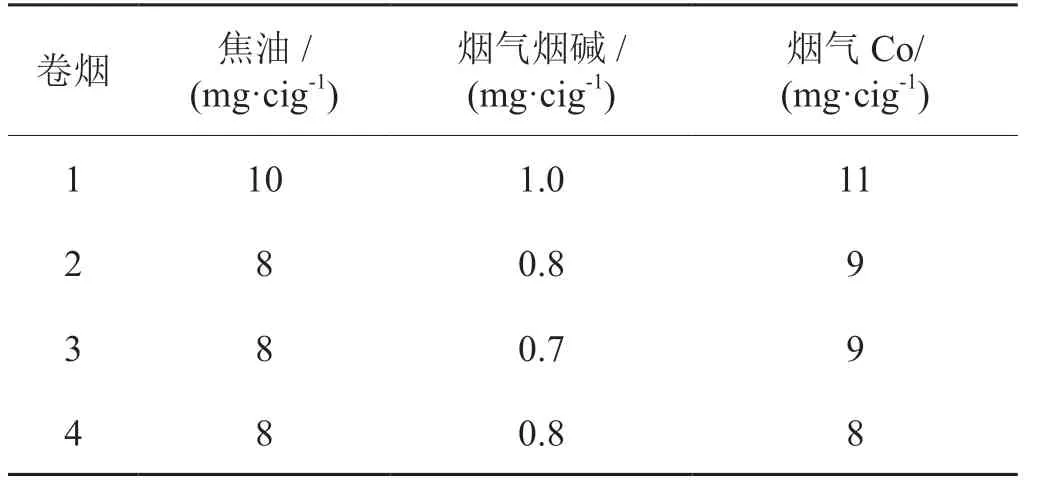
卷烟 焦油/(mg·cig-1)烟气烟碱/(mg·cig-1)烟气Co/(mg·cig-1)1 10 1.0 11 2 8 0.8 9 3 8 0.7 9 4 8 0.8 8
抽吸前4种卷烟样品置于恒温恒湿箱中,温度为(22±2)℃,湿度(60±5)%平衡48h;IL-10、IL-6和TNF-α酶联免疫试剂盒均购自美国Invitrogen公司;洁净空气(80%氮气,20%氧气,北京华宇辰气体有限公司)。
仪器:总挥发性有机物气体分析仪TVA-1000B(FID检测器1~10000 ppm,美国Thermo科技仪器有限公司);SMPS 3938 粒径谱仪(扫描粒径0.01-1.0µm,美国TSI公司);十通道转盘式吸烟机(HRHTSM610,北京慧荣和科技有限公司);小动物口鼻暴露系统(HRH-MNE3026,北京慧荣和科技有限公司,红外二氧化碳传感器,电化学氧浓度传感器,铂热电阻温度传感器,氯化锂电阻式湿度传感器);全自动酶标仪(ELX-80,美国BioTek)。
1.2 动物
BALB/c小鼠,SPF级,北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,共计110只,雌55只,雄55只,6周龄,体重18~22g,同性别动物体重范围为平均体重的±20%内。动物饲养于汇智泰康生物技术(北京)有限公司屏障设施,使用许可证号:SYXK(京)2018-0009,每笼同性别5只,温度控制在20℃~26℃范围内,相对湿度控制在40%~70%,光照12 h。
1.3 方法
1.3.1 烟气发生和口鼻暴露系统
采用ISO 3308—2012将4种品牌卷烟烟气由十通道转盘式吸烟机分别发生,每支烟抽吸持续时间2s,抽吸频率60s,抽吸容量35.0 mL/2s,抽吸口数6口,抽吸流量图为钟形,最大流量出现在抽吸后的0.8~1.2s之间。烟气与洁净空气(空气经3级HEPA高效过滤后)分别按比例稀释混匀后进入口鼻暴露系统。本试验根据前期预试验发现烟气低于15倍稀释时,口鼻暴露系统二氧化碳高于1%,氧浓度低于19%,动物处于缺氧的状态,不符合OECD 吸入毒性测试导则对氧和二氧化碳浓度要求,故以15倍稀释为起点,2~3倍的组间间距,分别设置15、50、100和300倍稀释浓度进行检测。本次试验采用的口鼻式暴露系统为不锈钢材质,可分为3个模块,每个模块分为2层,每层最多可装载10只大鼠或小鼠,3个模块最多同时暴露60只动物;每个模块分别设置有颗粒物浓度采样口、颗粒物粒径检测采样口、温湿度采样口、氧浓度和二氧化碳检测采样口,可根据染毒动物数量的需要对3个模块进行组合。装置内缸正压,外缸微弱负压,试验样品烟气由暴露装置的底部与洁净空气涡旋混合后,进入内缸均匀分散到各暴露口,动物呼出的废气与剩余烟气从暴露装置顶部抽出后过滤排出,参见示图1。
1.3.2 试验设计
选择模块1第1层第1号孔为作为采样参考孔,每个模块随机选定2个采样孔,分别命名为A、B、C、D、E和F孔,3个模块共计6个采样孔;每天首先测量参考孔,然后依次测量其他采样孔,重复测量3次,连续测量5天。检测指标包括:粒径分布、颗粒物和TVOC浓度,根据上述指标检测结果计算所有采样孔测量数据的变异系数和参考孔的时间变异系数,利用公式CV2空间%=CV2总变异%-CV2时间%[5]计算出口鼻暴露系统烟气分布空间变异系数。其中时间变异系数代表暴露期间卷烟烟气浓度在口鼻暴露系统中的稳定性,空间变异系数是反映不同暴露孔之间烟气浓度是否均一,由两者所组成的总变异的大小决定整个暴露系统烟气的稳定性和均一性。
选择颗粒物和TVOC浓度均一性和稳定性最佳的稀释倍数,建立口鼻暴露方法,对40只小鼠随机分为4组,每组10只,分别进行4种卷烟烟气的暴露,每天每只动物吸入2支烟,连续14天,同时设置平行洁净空气对照组, 10只动物,给予同等流量的洁净空气(由80%氮气和20%氧气组成,经三级HEPA过滤)。

图1 口鼻暴露系统剖面图Fig.1 Cross-section schematic diagram of oro-nasal exposure system
第14d结束给烟,所有动物用10%水合氯醛按0.9mL/100g bw腹腔注射麻醉,用1mL无菌生理盐水灌注肺部。将1mL灌洗液300g离心5分钟,留取上清液-20℃保存。用ELISA方法检测上清液中IL-10、IL-6和TNF-α含量。
1.3.3 染毒环境条件的监测
染毒期间实时监测暴露仓内环境参数,包括温度、相对湿度、氧气浓度、CO2浓度,每隔30min记录一次数据。
1.3.4 颗粒物粒径分布和浓度检测
采用TSI SMPS 3938 扫描电迁移率粒径谱仪,在采样孔以0.2L/min气溶胶流量和2.0L/min鞘气流量采样,工作液体蒸馏水,采样1min,分辨率1s,对10-1000nm粒径范围内颗粒物进行自动计数和粒径分级,各烟气每天测量3次,连续测量5天;每次测量结束,利用AIM 10.1.0.6(Aerosol Instrument Management)软件计算颗粒物数量浓度和拟合分布特征。
1.3.5 TVOC检测
采用Thermo TVA-1000B总挥发性有机物检测仪,将采样探头分别插入采样孔,以1.0L/min流速采样,使用氢离子火焰(FID)检测器,待检测浓度稳定显示20 s后记录数值,各烟气每天测量3次,连续测量5天。仪器在测量前用甲烷气体进行200 ppm单点校准,可检测范围1~10000 ppm。
1.3.6 数据处理
使用IBM SPSS Statistics 19.0软件建立数据库,对颗粒物数量中值粒径、颗粒物数量浓度和TVOC数据进行平均值和标准差的计算,数据以平均数±标准差(±s)表示。组间差异用单因素方差进行分析。P<0.05表示有统计学意义。
2 结果与讨论
2.1 温湿度、氧和二氧化碳浓度检测结果
连续监测暴露仓内温度、湿度、氧气和二氧化碳浓度,每天记录3次,连续监测5天,结果表明染毒过程中4种不同卷烟烟气分别在不同稀释比例下温度在21.2~25.4 ℃之间,相对湿度在40.4%~57.3%之间,氧浓度在21.9%~22.9%之间,二氧化碳浓度0.32%~0.96%之间,均符合OECD吸入毒性暴露仓内温湿度、氧浓度和二氧化碳的要求。其中1:15倍稀释时暴露仓内二氧化碳的浓度在0.75%~0.96%之间,接近1%。
随着稀释比例的增加,暴露仓内二氧化碳浓度逐步降低,在1:100和1:300稀释比例时维持在0.28%~0.41%之间,温湿度和氧气与稀释空气一致。
2.2 不同品牌卷烟主流烟气粒径分布特征和挥发性有机物检测结果
在各稀释条件下,4种卷烟主流烟气的粒径范围在100nm在700nm之间,各不同粒径尺寸颗粒物浓度从108~109个/cm3之间变化,与相关研究结果相一致[8-12]。15倍稀释时,由于稀释倍数小,每种烟气的粒径数量中值的均值变异系数高,而在50和100倍稀释条件下粒径数量中值均值相对15倍稀释数值变小且变异系数低,随着稀释倍数的增加未发生明显的改变,其主要原因是由于低稀释倍数时,颗粒物在暴露仓内总体气流量低,颗粒物在运动过程中互相碰撞,撞击结合在一起的概率大于分离的概率使颗粒物发生了团聚,导致颗粒物的数量中值粒径不稳定且大于高稀释倍数时的粒径[13]。由此可以判定,在动物口鼻暴露烟气时应考虑高浓度颗粒物的团聚作用,需要对颗粒物进行稀释。随着稀释倍数的增加,颗粒物在暴露仓中撞击结合和分离达到动态平衡并稳定,故颗粒物的粒径和数量浓度相对稳定。
2.3 主流烟气颗粒物数量浓度和TVOC均一性和稳定性检测结果
4种卷烟主流烟气分别进行15、50、100和300倍洁净空气稀释的情况下,小鼠口鼻暴露时暴露仓不同位置采样孔,其颗粒物数量浓度和TVOC浓度在15倍稀释时时间变异系数随着稀释比例的增高均逐步降低,同时根据公式CV2空间%=CV2总变异%-CV2时间%计算出主流烟气稀释时颗粒物数量浓度和TVOC空间分布变异系数,具体数值见表2。
4种卷烟在15和50倍稀释时其颗粒物数量浓度和TVOC时间变异系数不符合OECD 化学物质吸入毒性试验导则中对吸入颗粒物浓度时间变化不超过均值的±20%和蒸气不超过均值±10%的要求,在100和300倍的稀释情况下,4种卷烟颗粒物和TVOC的时间变异系数均符合OECD的要求。此外各不同比例的稀释情况下无论是在同层还是不同层面的采样孔,颗粒物数量浓度和TVOC浓度均未见显著性差异,其中15倍稀释情况下时间和空间变异最高,50倍次之,100和300倍稀释相近且最低。由此可见,稀释气流参数的设置(流量和控制精度)对于烟气口鼻暴露的时间变异和空间变异具有很大的影响。尽管OECD导则中对空间变异并未做出明确的规定,结合以往研究均认为蒸气和气体物质口鼻暴露系统总变异系数范围为3%~10%[14-15]。本研究前期试验发现低于15倍时口鼻暴露系统中二氧化碳和氧浓度不符合OECD标准,因此以15倍为起点2~3倍间距设计了50、100和300倍稀释。若以60kg体重人体为例,每天1~20支烟暴露情况下,根据《实验动物和人体每公斤体重等效剂量折算系数W表》[16]分别计算人与小鼠、大鼠和豚鼠相应吸烟支数转换,20g小鼠稀释倍数在17~330倍,200g大鼠在3~50倍,400g豚鼠在2~27倍。而要产生相同的生物学效应或按照符合国家标准的试验方法,300倍或更高稀释倍数比100倍稀释需要对动物进行更长的暴露周期或更多卷烟的消耗,不符合动物试验的3R原则,即减少、优化和替代,且有暴露浓度小于最大无作用剂量(每天小于1支烟或更少),脱离实际生物学效应研究的可能性,因此选择100倍的稀释浓度建立卷烟烟气口鼻暴露方法,也是本次研究不同稀释倍数中稳定且时间和空间差异小的稀释比例,符合实际应用,详细参数见表3。
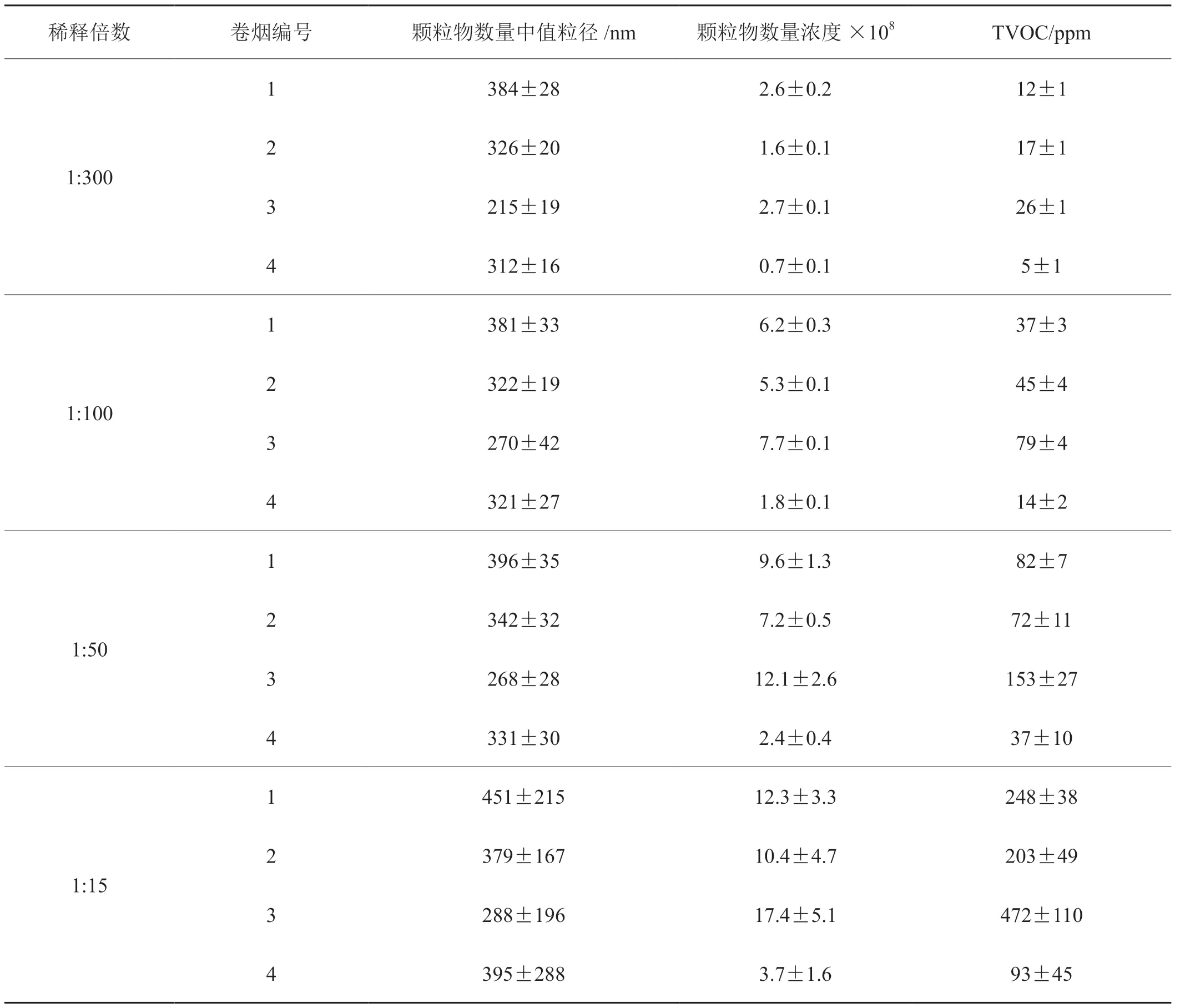
表1 不同稀释倍数下烟气颗粒物特征和挥发性有机物检测结果(n=15)Tab.1 Comparison of count median diameter, number concentration and TVOC of four mainstream cigarette smokes under different dilution ratios ( n=15)

表2 卷烟烟气颗粒物数量浓度和TVOC浓度在不同稀释倍数时变异系数检测结果(n=15)Tab.2 Coefficient Variation of Particle number concentration and TVOC of typical cigarette smoke under different dilution ratios(n=15)

表3 卷烟烟气口鼻暴露系统参数Tab.3 Oro-nasal exposure systme parameters for cigarette smoke exposure
2.4 卷烟烟气暴露小鼠肺灌洗液中IL-10、IL-6和TNF-α检测结果
本研究发现经连续14d暴露,与对照组相比,4种卷烟烟气小鼠肺灌洗液中促炎性因子IL-6和TNF-α释放水平增高了近2倍(P<0.05),具体数据见表4,与文献[17-21]结果相一致。各烟气暴露组IL-10变异系数在6.9%~8.6%之间,TNF-α变异系数在13.4%~17.6%;IL-6变异系数在16.8%~23.2%之间;尽管各项指标变异系数有所差异(各指标灵敏度不同),但均维持较为稳定的检测结果,未发现明显偏离均值的数值。故由此可判定,本研究所建立的小动物口鼻暴露方法生物学指标检测结果可靠稳定。
同时,本研究结果表明卷烟烟气可增强肺内淋巴细胞的粘附作用,有助于淋巴细胞炎性渗出,参与炎性发展过程;4号卷烟烟气暴露小鼠灌洗液中TNF-α与其他3种卷烟烟气相比,释放水平低近20%(P<0.05),4号卷烟烟气TVOC和颗粒物浓度是其他卷烟烟气均值的约1/4,故可初步判断TVOC和颗粒物浓度与炎性因子TNF-α间有一定的剂量-效应关系趋势,但仍需要进一步通过设置更多剂量梯度予以证实;此外,有研究认为IL-10是调节性T(Treg)细胞发挥免疫功能的重要细胞因子[22]。Treg细胞的抑制作用主要是通过分泌IL-10等细胞因子参与[23],本次研究抑制因子IL-10释放水平与对照组相比,未见显著性差异,说明4种卷烟烟气均未引起肺Treg细胞的损伤。

表4 卷烟烟气100倍稀释后对小鼠肺灌洗液IL-10、IL-6和TNF-a释放水平的影响(n=10,pg/mL)Tab.4 Release level of IL-10, IL-6 and TNF after diluting four mainstream cigarette smokes 100 times
3 结论
口鼻暴露仓内主流烟气的颗粒物粒径尺寸主要分布在100~700nm之间,呈正态分布,各不同粒径尺寸颗粒物数量浓度从108~109个/cm3之间变化。
本研究建立了卷烟烟气口鼻暴露方法,使每只动物吸入的主流烟气无论是颗粒物的粒径特征还是数量浓度以及TVOC浓度均一性和稳定性均达到OECD测试导则中的要求,经生物学效应指标的验证,所用方法结果稳定可靠。

