SHC介导的胰岛素信号转导MAPK途径与先天性心脏病的关系
夏丽滨,石鑫,沈艳,陈艳,骆志玲
(1昆明医科大学第二附属医院,昆明650101; 2云南省阜外心血管病医院)
先天性心脏病(CHD)是人类最常见而严重的出生缺陷之一,是婴幼儿非感染性疾病中主要死亡原因。活产婴儿的CHD发生率高达6‰~8‰[1]。最常见非综合性CHD(ns-CHD)包括房间隔缺损(ASD)和室间隔缺损(VSD)两种类型,二者发病率分别占CHD的10%~20%和20%~30% 。Kumar等[2]实验证实,GDM组大鼠其子鼠心脏发育异常的发生率较正常对照组明显增高(10%vs 0)。因此胰岛素或糖代谢与CHD发生是否存在某些潜在关联,胰岛素相关信号通路是否存在与心脏发育相关的信号通路相互协作和共享有待研究。2014年12月~2017年1月,本研究选取发病率最高的两种ns-CHD类型:ASD和VSD患者的右房心肌组织,并以风湿性心脏病(RHD)二尖瓣狭窄(MS)的右心房心肌组织为对照,对比分析病例-对照的表达差异基因及信号通路变化,重点寻找与糖代谢和/或胰岛素相关信号通路的变化,探索胰岛素相关信号转导与ns-CHD的发生是否享有共同的信号通路。
1 资料与方法
1.1 临床资料 收集ns-CHD患者37例(病例组),其中ASD 23例、VSD 14例,男12例、女25例,年龄(29.0±18.75)岁;对照RHD MS患者12例(对照组),其中男3例、女9例,年龄(47±11.25)岁。ns-CHD、RHD根据超声心动图及外科手术证实结果诊断。合并心外疾病、遗传性综合症、左室射血分数低于50%、冠心病、慢性肝肾功能异常、血糖、血脂异常、服用抗凝药物者除外。本实验符合赫尔辛基宣言要求,被招募研究参与者均知情同意,并经昆明医科大学伦理委员会批准。
1.2 取材和标本制备 病例组与对照组均收集心脏右心房外侧壁心肌组织。心房组织均在心脏停跳前快速获取,心房组织离体后冰上迅速分割成小块,用0.1%DEPC生理盐水冲洗,快速装入DEPC处理过的冻存管,置于液氮中冻存。
1.3 RNA提取和DGE测序 用于DEG分析的样本选自上述样本,其中ns-CHD(ASD)患者5例,年龄(25±12.4)岁;RHD MS患者2例,年龄(36.4±7.4)岁。组织液氮研磨后,用TRIzol(Invitrogen, USA)抽提RNA。总RNA利用Agilent2100生物芯片分析系统检测合格后,根据Yue等[3]的研究,运用IlluminaTruSeq RNA样本制备工具进行转录组文库构建及DGE分析。构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检合格后,根据说明书步骤,用Illumina HiSeq 2000进行测序。测序仪产生的原始数据经Base Calling转化为序列数据,去掉低质量序列、Adptor序列等,经过数据处理后进行数据分析。采用NOIseq方法[4]筛选得到样本间的差异表达基因。并使用超几何检验进行GO(Gene Ontology)功能显著性富集分析以及KEGG Pathway显著性富集分析[5,6]。
1.4 基因定量检测 采用实时荧光定量PCR(RT-QPCR) 法。37例ns-CHD和12例RHD患者的mRNA用TansScript One-Step gDNA Removal and cDNA Synthesis SuperMix (Transgen, China)逆转录为cDNA。所需验证基因定量PCR引物用Primer3[7]设计。每个样本重复3次,以Tubulin基因的表达为内参,进行Q-PCR。定量PCR在Bio-rad CFX96 (Bio-rad, USA)上进行,循环条件如下:95 ℃预变性2 min;35个循环,温度及时间分别为95 ℃、15 s和60 ℃、 30 s。获得目的基因表达的Ct值(Ct值=实验Ct值-对照Ct值)。
1.5 基因差异表达的筛选 用NOIseqmethod[4]进行ns-CHD组及RHD组的基因差异表达的筛选。筛选条件为倍数值≥2及Q值≥0.8。
1.6 DGE测序和基因定量检测 7个样本文库均在Illumina平台上进行测序,过滤了原始数据之后,在7个样本中,80%以上的原数据皆可被映射到同源转录组。根据Pathway分析给出有差异表达的基因,在SHC介导的MAPK激酶系统通路上,选择5例ns-CHD和2例RHD对比中有表达有差异的基因共16个进行基因表达验证。
1.7 统计学方法 采用SPSS16.0统计软件。RT-PCR实验的资料分析用REST软件提供的迭代统计检验[8]进行病例组与对照组间的基因差异表达分析,计量数据比较符合正态分布则采用t检验,不符合正态分布则采用Mann-WhitneyU检验;计数资料比较釆用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
2.1 DGE测序和基因定量检测情况 对每个基因进行定量检测,标记片段均映射到了参考序列,而仅有1 bp的错配。映射到参考序列的多基因目标段被过滤,而其余标记段进行纯化[5, 6]。
2.2 筛选的差异表达基因 得到26个显著差异表达的基因(表1)。其中共有8个基因下调,这8个基因中编码胶原蛋白有2个:COL3A1、COL1A1,平滑肌钙调蛋白和锚定蛋白各1个:CNN1和ACTG2,骨骼肌钙调蛋白TNNT1 1个及肌球蛋白的轻链MYL2。这6个下调的基因均与肌细胞的生成有关,另外PITX2和LTBP2两个基因表达存在下调。在表达上调的基因中,一些免疫相关基因如HLA-DQA2变化较大(log2比值=12.39)。
2.3 GO功能富集分析及Pathway分析 GO分析可见与糖相关的胰岛素信号通路MAPK途径在病例组与对照组之间差异有统计学意义。与胰岛素相关的胰岛素信号通路MAPK途径在病例组与对照组之间差异有统计学意义。Pathway分析结论相似。胰岛素信号通路中SHC介导的MAPK激酶系统变化最为明显。通路上的多个基因表达在病例组中一致下调,见图1。
2.4 基因表达验证 验证在37个ns-CHD和12个RHD样本中进行,基因信息表见表2。每个基因的扩增效率均大于0.95,Ct值与浓度的相关性R2> 0.99。获得每个样本每个基因的Ct值,以每个样本中Tubulin基因表达为参照。用REST软件提供的迭代统计检验[8]进行病例组与对照组之间的基因差异表达,结果见表3。通路中的6个基因PTPRF (LAR),SHC4 (SHC),ARAF (Raf), MAP2K2 (MEK1/2),MKNK2 (MNK),ELK1 (Elk1)在病例组中的表达量均明显下调(P均<0.05)。此6个基因均位于胰岛素信号通路(KEGG通路:map04910 )控制细胞增生分化的途径上。
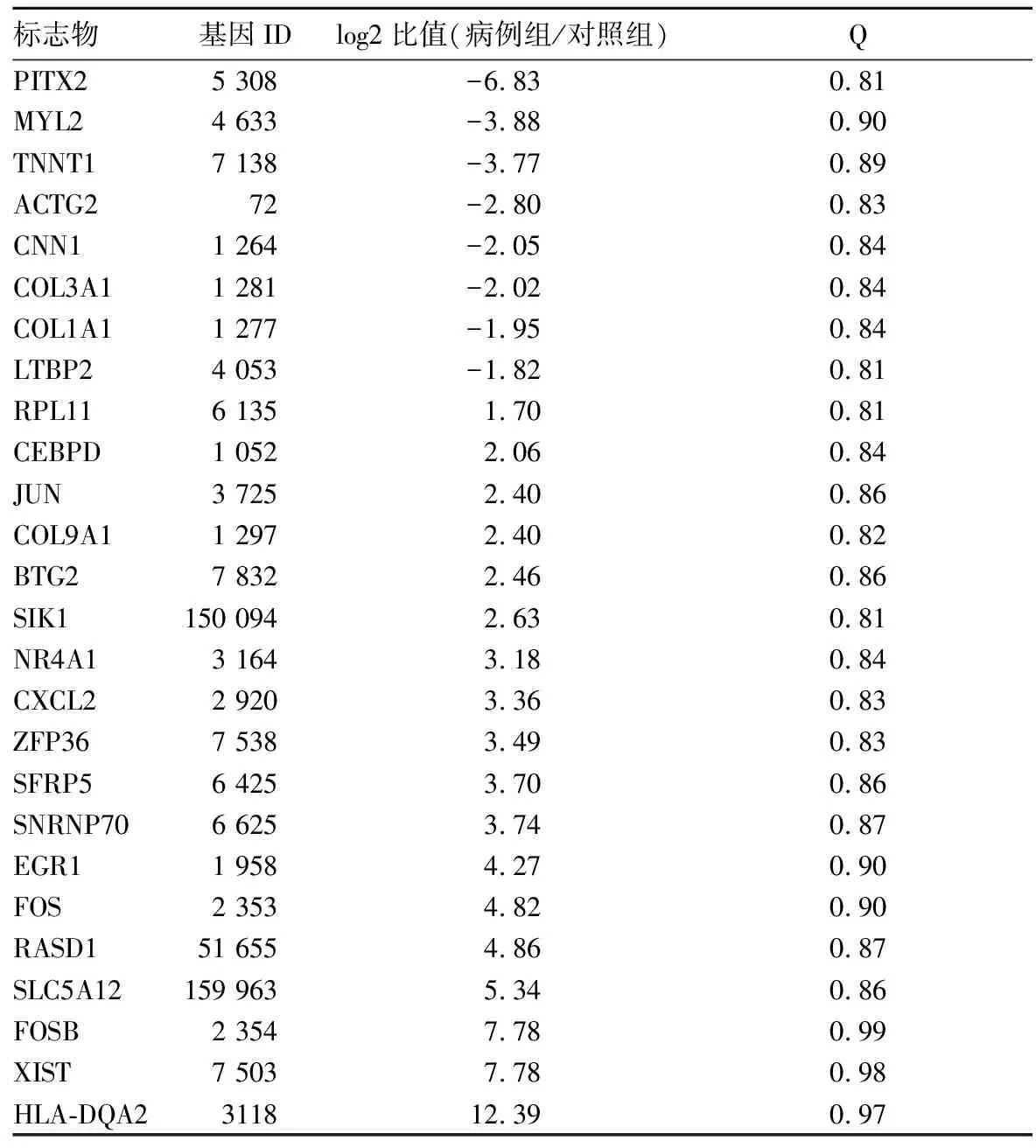
表1 病例组及对照组样本差异表达基因
3 讨论
CHD的病因及发病机制目前仍不明确。2007年至2011年,昆明医科大学第一附属医院GDM产妇胎儿心脏畸形发生率为2.99%,较文献报道的正常妊娠胎儿心脏畸形发生率(0.8%)高。且Wren等研究也显示妊娠期糖尿病(GDM)新生儿的心脏异常几率是正常妊娠的5倍。因此,我们认为胰岛素或胰岛素样受体触发的信号通路可能卷入到ns-CHD的发病过程中。
胰岛素不仅可调节体内代谢,并且可作为一种生长因子促进有丝分裂。胰岛信号通路中可能参与到心脏发育的通路可能有两条,一条是通过激活PI3K途径激活蛋白的合成。有报道称[9]激活PI3K/Akt/mTOR信号通路能抑制心脏细胞的凋亡及改善心肌功能。但本研究中我们对比患者和对照的基因表达,未能发现PI3K上游的胰岛素受体底物(IRS)表达发生变化,因此未能确定PI3K通路是否卷入ns-CHD的发生中。
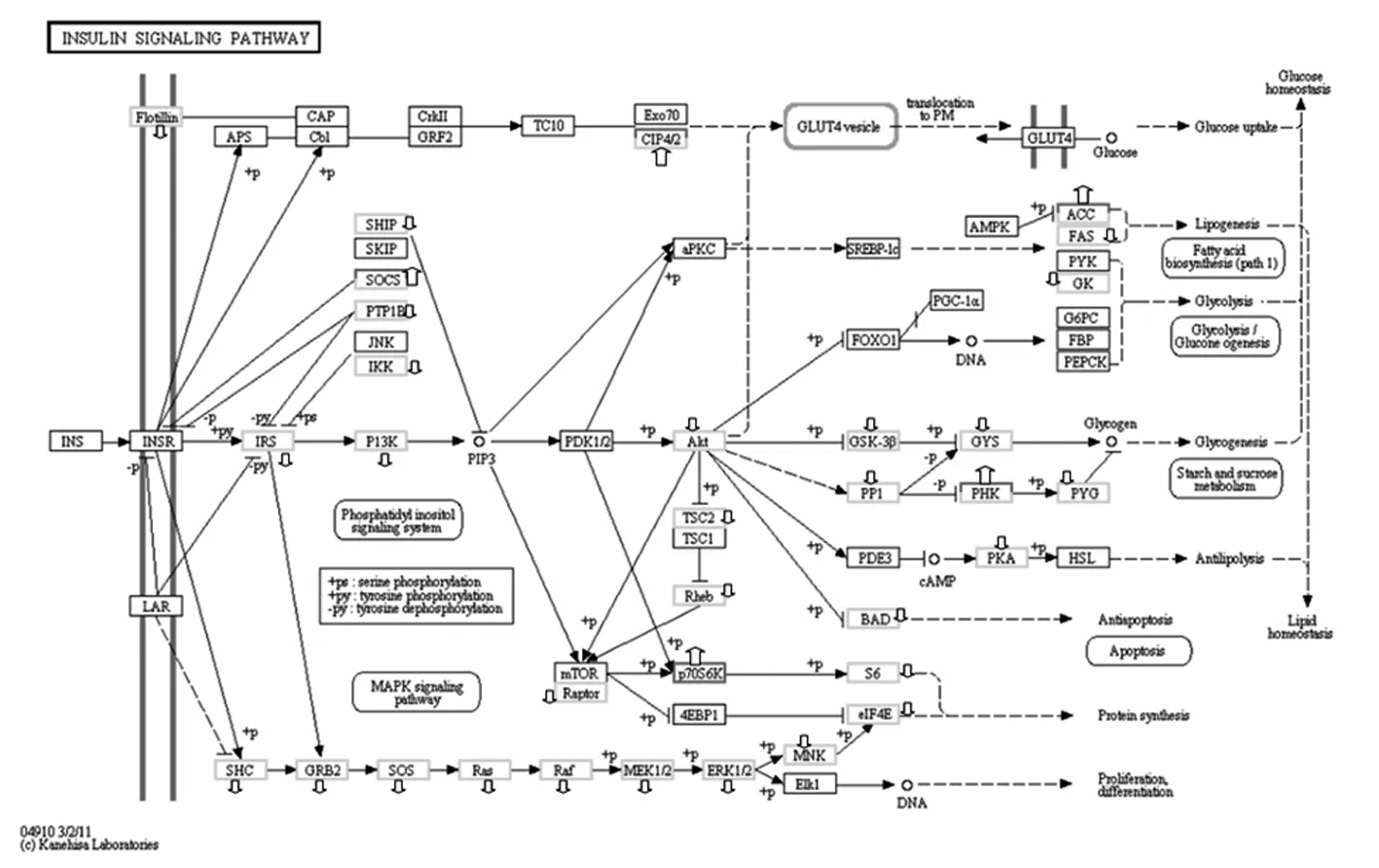
注:空心箭头方向上下分别代表基因表达上调和表达下调。
图1CHD患者胰岛素信号转导通路基因的差异表达
另一条是通过SHC激活Ras-MAPK通路激活细胞的增生与分化。本研究我们发现,胰岛素信号通路中,SHC(SHC4)及其下游的效应基因Ras-MAPK等在CHD患者心脏中表达明显下调。因此这条通路很可能卷入ns-CHD的发生机制中。MAPK通路对心脏的发育非常重要[10]。
本研究还发现,Ras-MAPK系统的下游效应基因MKNK2和ELK1表达亦在先天性心脏病中的表达也被抑制。MKNK2为钙依赖丝氨酸/苏氨酸蛋白激酶家族中的一员。其被Ras-MAPK激活后能磷酸化真核生物起始因子4E (eIF4E)。eIF4E对mRNA的翻译起始很重要,并在癌症的发生、细胞分化中扮演重要角色[11]。而ELK1本身为一转录因子,其是转录因子Ets家族及三元复合物(TCF)亚家族中的一员。本研究中其表达明显被抑制,病例中此基因的表达量仅为对照中的0.05倍。有报道称此基因参与肌动蛋白细胞骨架相关基因的转录[12]。
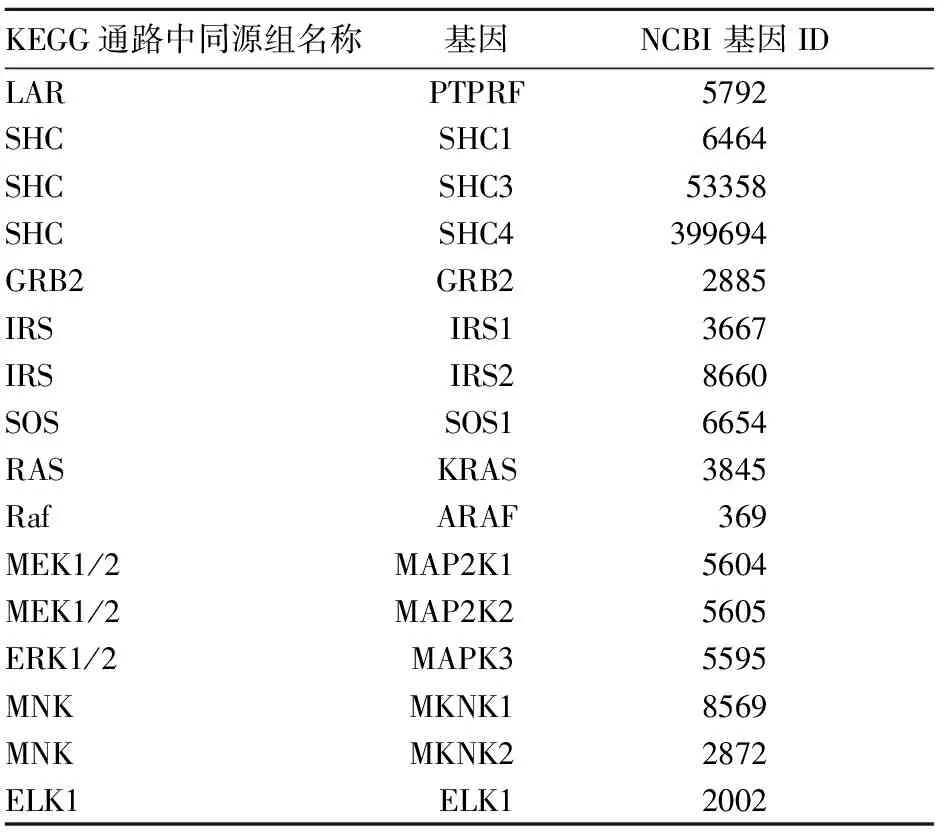
表2 用于表达验证的基因
本研究结果显示,病例组SHC4基因表达显著下调。其在先心病病例中的表达为对照中的0.178倍,差异有统计学意义。SHC4基因是SHC基因家族中的一员。SHC是个受体家族,其中包括SHC1(ShcA)、SHC2(ShcB)、SHC3(ShcC)、SHC4(ShcD)。ShcA偶联抗原,细胞因子受体和Ras蛋白后能激活淋巴和骨髓细胞。在胚胎期其与MAPK系统偶联调节心脏的发育和血管形成[13]。ShcA的表达异常可影响心肌细胞发育和导致心脏功能降低,SHC4(ShcD)于2007年在黑色素瘤细胞中被发现。在成人的神经系统和肌肉组织中有较高表达,并参与磷酸化 (MuSK)。近期有报道称,ShcD在小鼠心肌及骨骼肌中高表达。综合SHC现今所了解的功能及在本研究病例与对照中的差异表达,我们认为SHC4很可能卷入到先天性心脏病的发病机制中。SHC1在病例中的表达量为对照中的0.188倍,虽然其统计学上无阳性(取α= 0.05),但我们注意到关于样本及对照组的差异仅源于偶然[(P(H1))]的对立假设可能性仅有0.057,P(H1)非常接近α。故此基因亦有可能卷入到先天性心脏病的发病机制中。
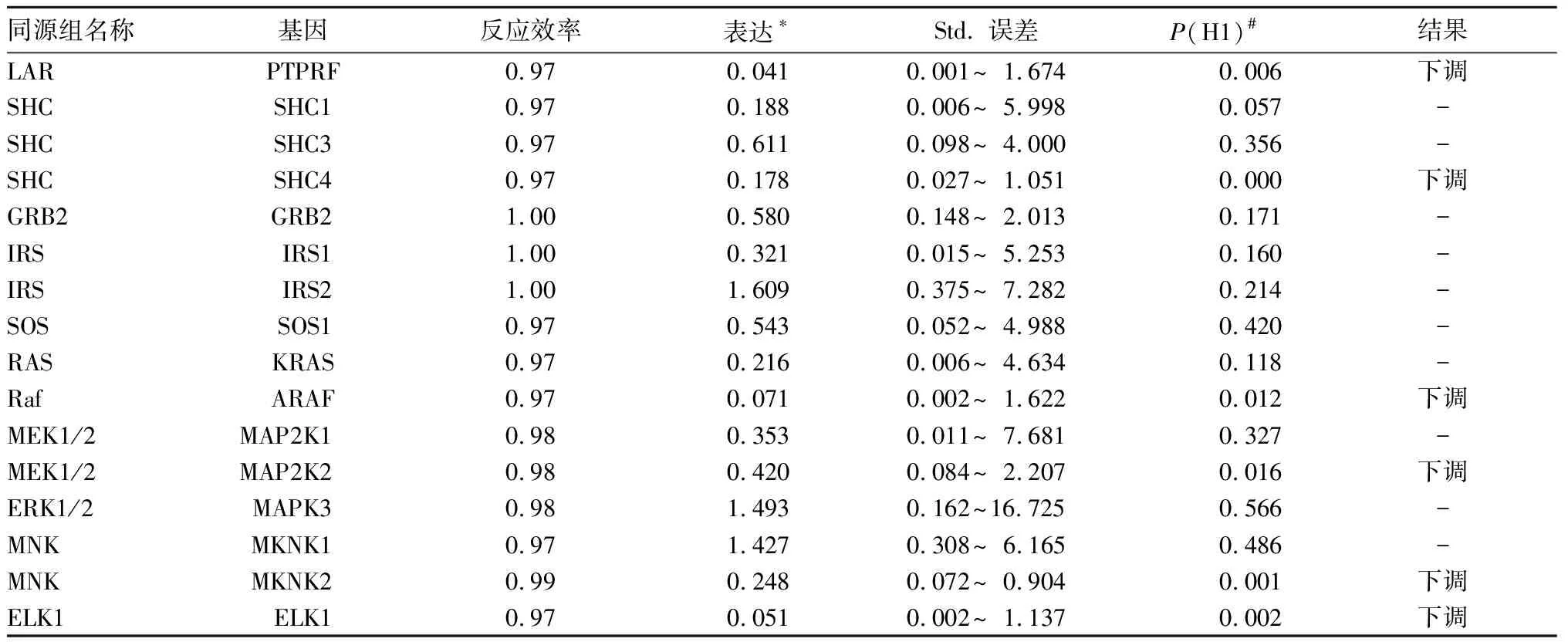
表3 基因表达验证结果
注:*表示实验组样本中的上调及下调(与对照组比较)用平均因子“表达”表示,如PTPRF在实验组中表达下调(与对照组比较)平均因子为0.041;#表示样本及对照组的差异仅源于偶然对立假设的可能性。
除了作为一种信号接头分子,SHC还被认为与细胞的氧化压力相关。SHC1基因编码的p66Shc蛋白被认为是线粒体上与细胞色素C一起产生氧自由基(ROS)的核心原件。高糖环境可促氧自由基的生成,而ROS的堆积可能致使胰岛素抵抗[14]。因此与ROS产生相关的SHC基因可能卷入到胰岛素抵抗的形成中[15]。但目前GDM孕妇体内的高糖环境或氧压力是如何对胎儿中的SHC基因表达影响仍未见报道。如能揭示他们之间的关系,也许可解释GDM产妇其胎儿易患先心病的分子病理原因。
致使先心病患者SHC基因表达下调的因素仍未知。虽然我们发现了KEGG通路中SHC的上游调控基因PTPRF表达在ns-CHD患者中下调,与对照比较差异有统计学意义。PTPF为蛋白酪氨酸磷酸酶受体,是LAR 亚家族中的一员。LAR家族与调控胚胎发育的关键信号通路Wnt/β-catenin 信号通路相关[16]。在小鼠中发现在胰岛素抵抗的肌肉组织中PTPRF基因超表达。但在心肌细胞中,PTPRF与SHC的直接关系仍未见报道。只在神经细胞中有报道称PTPRF通过SHC可以促神经营养因子的生成。因此,促成在心肌细胞中SHC表达降低的上游效应分子仍有待寻找。
为确定SHC-Ras-MAPK系统的信号下调为先天性心脏病病因,我们查询了此系统与RHD的关系。并未发现SHC基因与RHD发生相关的报道,Ras-MAPK系统与RHD相关的报道也未发现,仅发现1例报道在RHD患者心肌中MAPK下调[17]。在整个SHC-Ras-MAPK信号通路上,我们发现信号通路中的基因SOS1(SOS)和KRAS(Ras)的表达虽然在ns-CHD患者中成下调趋势但并未成统计学阳性。这也许是由于他们的表达变化较小,用现有的样本量无法发现统计阳性。或是SHC信号传递的减弱,并不依赖于这两个基因的表达量的降低。要真正找出SHC-Ras-MAPK信号通路与nc-CHD发生的关系,补齐这缺失的一环仍非常重要。
本研究中的对照组采用了风湿性心脏病的右房组织,主要是由于正常人心房组织难于获得。除风湿性心脏病患者外,对照心房组织还可来源于非疾病死亡正常人的心脏组织或引产的胎儿。这些对照组织各有其优势与缺点。非疾病死亡正常人的心脏组织作为对照较好,但其较难获得,不易凑足用于后期基因表达验证的例数。且非疾病死亡正常人的心脏组织获取需经历一定死亡时间,心脏停跳时间的延长亦会影响基因表达。引产的胎儿亦是正常对照的一个来源,但引产药物、年龄的不匹配等因素亦会影响最终分析结果。在DEG分析中,显著下调的基因多是肌肉的组成成分,如胶原、锚定蛋白和肌球蛋白。这可能反映了先心病中心肌发育不全分子因素。而显著上调的基因中包含HLA-DQA基因,这可能反映了风湿性心脏病发生的免疫调节异常。
综上所述,SHC介导的MAPK通路变化可能影响心脏发育,SHC基因与胰岛素抵抗可能是GDM新生儿心脏畸形患病率增加的原因之一。

