腐乳毛霉醇提物不同极性部位抗氧化活性及细胞保护作用研究
贺君宇 钱海玲 李小妹 石孟琼 张永峰 涂 璇 邹 坤
(1.宜昌市第一中学,湖北 宜昌 443001;2.三峡大学 医学院,湖北 宜昌 443002;3.三峡大学 生物与制药学院,湖北 宜昌 443002)
腐乳是中国老百姓喜爱的常见传统美食,其所含大豆异黄酮、大豆皂苷、大豆低聚糖、大豆多肽等成分具有较强的抗氧化活性,对心脑血管、内分泌、免疫系统疾病有较好的治疗作用[1].目前,国内外学者对于腐乳的研究多集中在菌种选育、产品开发等研究上,但是对其药理作用研究较少.由于黄酮和皂苷类成分可有效清除体内过量产生的自由基,本文选用钼酸铵法、1,1-二苯基-2-苦基肼(DPPH)法、铁离子还原(FRAP)法和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基法分别对腐乳毛霉醇提物不同极性部位进行抗氧化活性评价;然后以人肝细胞L-O2为研究对象,采用四氯化碳(CCl4)诱导其损伤,观察它们对损伤的保护作用,为今后进一步研究开发提供理论基础.
1 材料与方法
1.1 药物和细胞
腐乳和新鲜豆腐购自宜昌市西陵区大明菜市场.
1.2 细胞
L-O2细胞购自中国科学院上海细胞研究所.
1.3 试剂
PDA 培养基(杭州微生物试剂有限公司);DPPH、ABTS、2,4,6-三吡啶基三嗪、Vit C、二甲基噻唑二苯基四唑嗅盐(MTT)、二甲基亚砜(DMSO);DMEM 培养基(美国Gibco);乳酸脱氢酶(LDH)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒(南京建成);其他试剂均为国产分析纯.
1.4 仪器
洁净工作台(上海博讯);倒置显微镜(日本Olympu);CO2培养箱(日本Sanyo);多功能酶标仪(瑞士TECAN);XL-4流式细胞仪(美国Backman).
1.5 方法
1.5.1 腐乳毛霉的分离纯化
用接种针在腐乳中挑取1×1×1cm3大小方块接种在PDA 培养基上,在25℃恒温培养箱中培养3 d,然后挑取孢子,用分段划线法进行多次培养分离,直至得到纯化的毛霉菌株为止.
1.5.2 腐乳毛霉发酵及其提取物不同极性部位制备
称取豆腐5.0kg,加入95.42g葡萄糖混匀后.分别装入50个锥形瓶中,灭菌后.用接种环将纯化的毛霉菌株接种于豆腐培养基上,放入25℃恒温培养箱中培养.20d后,收集菌丝和培养基,置于60℃烘箱中干燥,然后用80%乙醇,70℃回流提取3 次,合并提取液,回收乙醇,浓缩至稠膏后,依次用石油醚、乙酸乙酯、正丁醇进行萃取,回收溶剂后,得到石油醚部位3.296g、乙酸乙酯部位8.934g、正丁醇部位28.447g和水部位49.086g.将各萃取物用DMSO 配制成适宜溶液,细胞实验的溶液经0.22微米孔径滤膜过滤.
1.5.3 总抗氧化能力测定
按照Lee等[2]介绍的方法测定总抗氧化能力.
1.5.4 清除DPPH、自由基和铁离子还原能力测定
参照Dehghan 等[3]介绍的方法测定清除DPPH、自由基和铁离子还原能力.
1.5.5 腐乳毛霉醇提物不同极性部位对L-O2细胞的影响
取L-O2 细胞分别加入不同浓度(3.125、6.25、12.5、25、50、100μg/mL)的腐乳毛霉醇提物4 个部位的培养基,培养24h后,用MTT 法测定细胞活力.1.5.6 腐乳毛霉醇提物不同极性部位对CCl4致L-O2细胞氧化损伤的影响
将L-O2细胞先用20mM CCl4作用2h后,分别加入不同浓度(6.25、12.5、25μg/mL)腐乳毛霉醇提物不同极性部位作用24h,然后进行相关实验.
1)对L-O2细胞形态及活力影响.各组L-O2细胞经过相应处理后,在显微镜下观察其细胞形态及进行细胞活力测定,具体检测方法详见“1.5.5”.
2)对L-O2细胞内ROS含量影响.各组L-O2细胞经过相应的处理后,收集细胞,进行L-O2细胞内ROS含量检测.具体方法参见试剂盒说明书.
3)对LDH 活性影响.各组L-O2细胞经过相应的处理后,收集上清液,按照试剂盒说明书介绍的方法进行LDH 活性检测.
4)对SOD、GSH-Px、CAT 活性和MDA 含量影响.L-O2细胞经过相应的处理后,收集上清液,按照试剂盒说明书进行SOD、GSH-Px、CAT 活性和MDA 含量检测.
1.6 数据统计分析
2 结 果
2.1 腐乳毛霉的性状特征
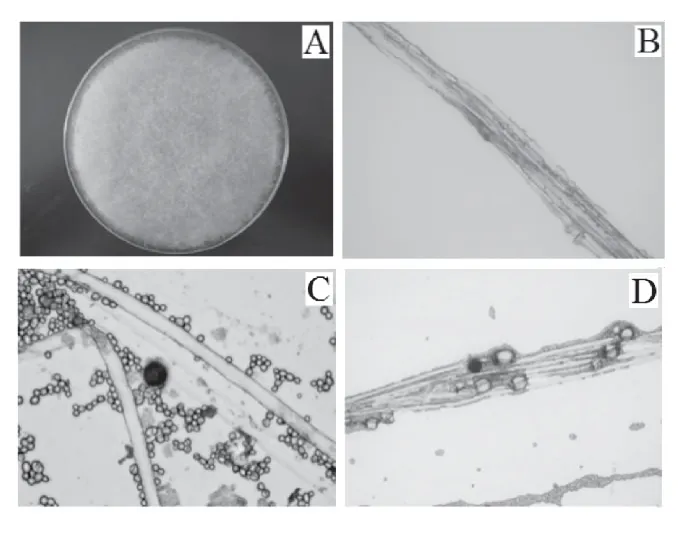
在PDA 培养基上培养5d 后,肉眼可见菌丝呈白色絮状,菌丝长度约1~1.5cm.显微结构:孢囊梗呈假轴状分枝,孢子囊球形,囊轴呈球形或卵形、无色或淡褐色,孢子近球形、卵形.根据菌落形态和显微结构,可判断为毛霉(如图1所示).
2.2 腐乳毛霉提取物不同极性部位的总抗氧化能力
由图2A 可见,腐乳毛霉醇提物4个部位均具有较强抗氧化能力,由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位;经统计分析,乙酸乙酯部位较正丁醇部位、正丁醇部位较水部位、水部位较石油醚部位均具有显著性差异(P<0.05或P<0.01).
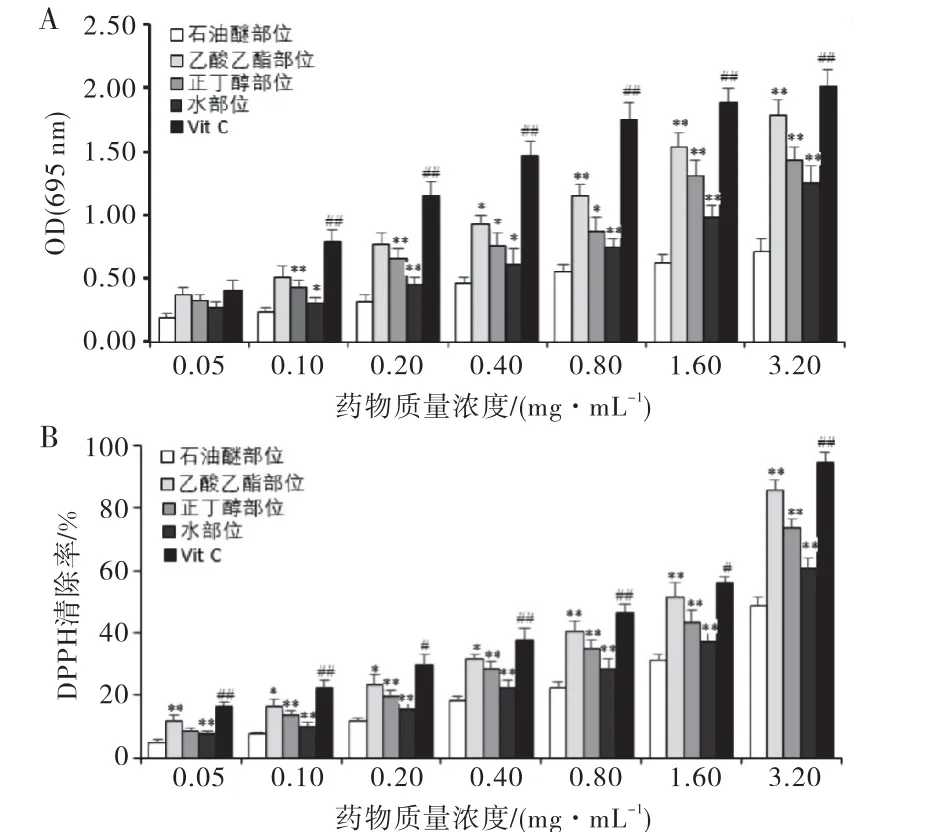
图2 腐乳毛霉醇提物不同极性部位的总抗氧化和DPPH 自由清除能力
2.3 腐乳毛霉醇提物不同极性部位的DPPH 自由清除能力
由图2B可见,腐乳毛霉醇提物4个部位均具有较强清除DPPH 能力,由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位;经统计分析,乙酸乙酯部位较正丁醇部位、正丁醇部位较水部位、水部位较石油醚部位均具有显著性差异(P<0.05或P<0.01);Vit C、乙酸乙酯、正丁醇、水和石油醚部位的IC50依次为0.490、0.835、1.416、2.550和4.310.
2.4 腐乳毛霉醇提物不同极性部位的铁离子还原活性
由图3A 可见,腐乳毛霉醇提物4个部位均具有较强还原铁离子能力,由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位;经统计分析,乙酸乙酯部位较正丁醇部位、正丁醇部位较水部位、水部位较石油醚部位均具有显著性差异(P<0.05或P<0.01).
2.5 腐乳毛霉醇提物不同极性部位的ABTS自由基清除能力
由图3B可见,腐乳毛霉醇提物4个部位均具有较强清除ABTS自由基能力,由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位;经统计分析,乙酸乙酯部位较正丁醇部位、正丁醇部位较水部位、水部位较石油醚部位均具有显著性差异(P<0.05或P<0.01);Vit C、乙酸乙酯、正丁醇、水和石油醚部位的IC50依次为0.377、0.672、1.068、2.092和3.508.
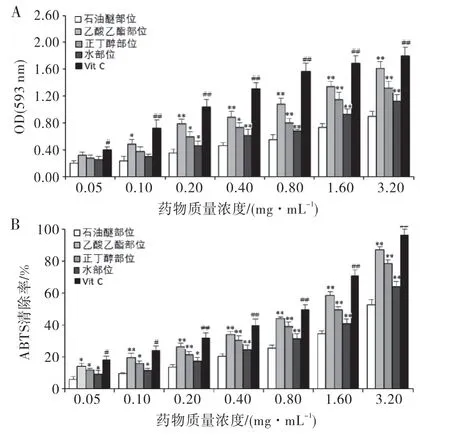
图3 腐乳毛霉醇提物不同极性部位的铁离子还原活性和ABTS自由基清除能力
2.6 腐乳毛霉醇提物不同极性部位对L-O2细胞活性的影响
由图4可见,腐乳毛霉醇提物不同极性部位在3.125~100μg/mL 的浓度范围内作用L-O2 细胞24h均未见有细胞毒性,与空白组(0μg/mL)比较,均具有显著性差异(P<0.05或P<0.01).综合分析腐乳毛霉醇提物不同极性部位的量效关系,选取6.25、12.5、25μg/mL 3个浓度进行后续实验.
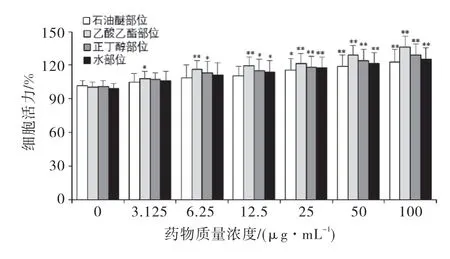
图4 腐乳毛霉醇提物不同极性部位对L-O2细胞活性的影响
2.7 腐乳毛霉醇提物不同极性部位对CCl4 致L-O2细胞损伤的影响
由图5A 可见,正常组L-O2细胞生长良好,细胞贴壁生长,呈多边形,分界清楚,表面光滑;模型组细胞生长缓慢、数目少,可见核溶解、细胞膜破损、结构不清晰,皱缩变圆;用腐乳毛霉醇提物4个部位干预后,细胞状态均出现不同程度的改善.分析细胞活力发现模型组细胞活力降为近50%,与正常组比较具有显著性差异(P<0.01);当用腐乳毛霉醇提物4个部位干预后,其活力明显提高,与模型组比较,均具有显著性差异(P<0.05或P<0.01)(图5B).
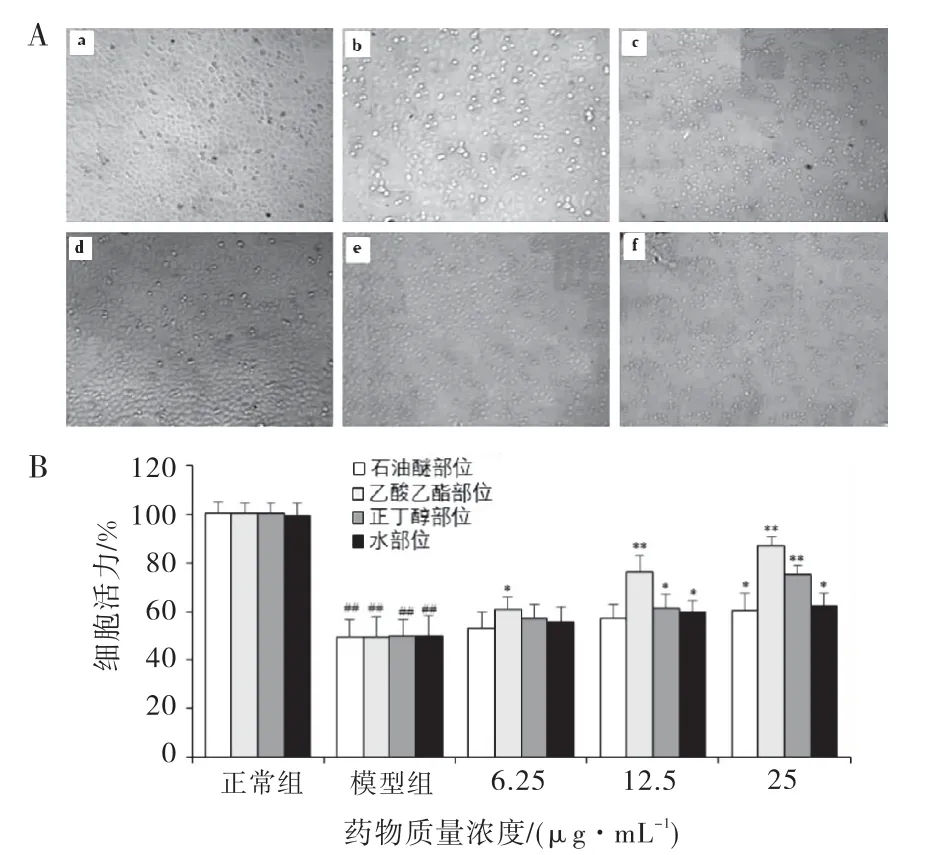
2.8 腐乳毛霉醇提物不同极性部位对CCl4 致L-O2细胞损伤胞内ROS的影响
L-O2细胞经CCl4处理后,可见胞内ROS升高了4.5 倍,与正常组比较具有显著性差异(P<0.01),当用腐乳毛霉醇提物4个部位(6.25、12.5、25 μg/mL)干预后,ROS水平明显降低,与模型组比较,均具有显著性差异(P<0.05或P<0.01),由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位(图6A).
2.9 腐乳毛霉醇提物不同极性部位对CCl4 致L-O2细胞损伤后培养液中MDA含量和LDH 活性的影响
由图6B、C 可见模型组L-O2 细胞培养液中MDA 含量和LDH 活性明显升高,与正常组比较具有显著性差异(P<0.01);当用腐乳毛霉醇提物的4个部位(6.25、12.5、25μg/mL)干预后,MDA 含量和LDH 活性明显降低,与模型组比较,均具有显著性差异(P<0.05或P<0.01).
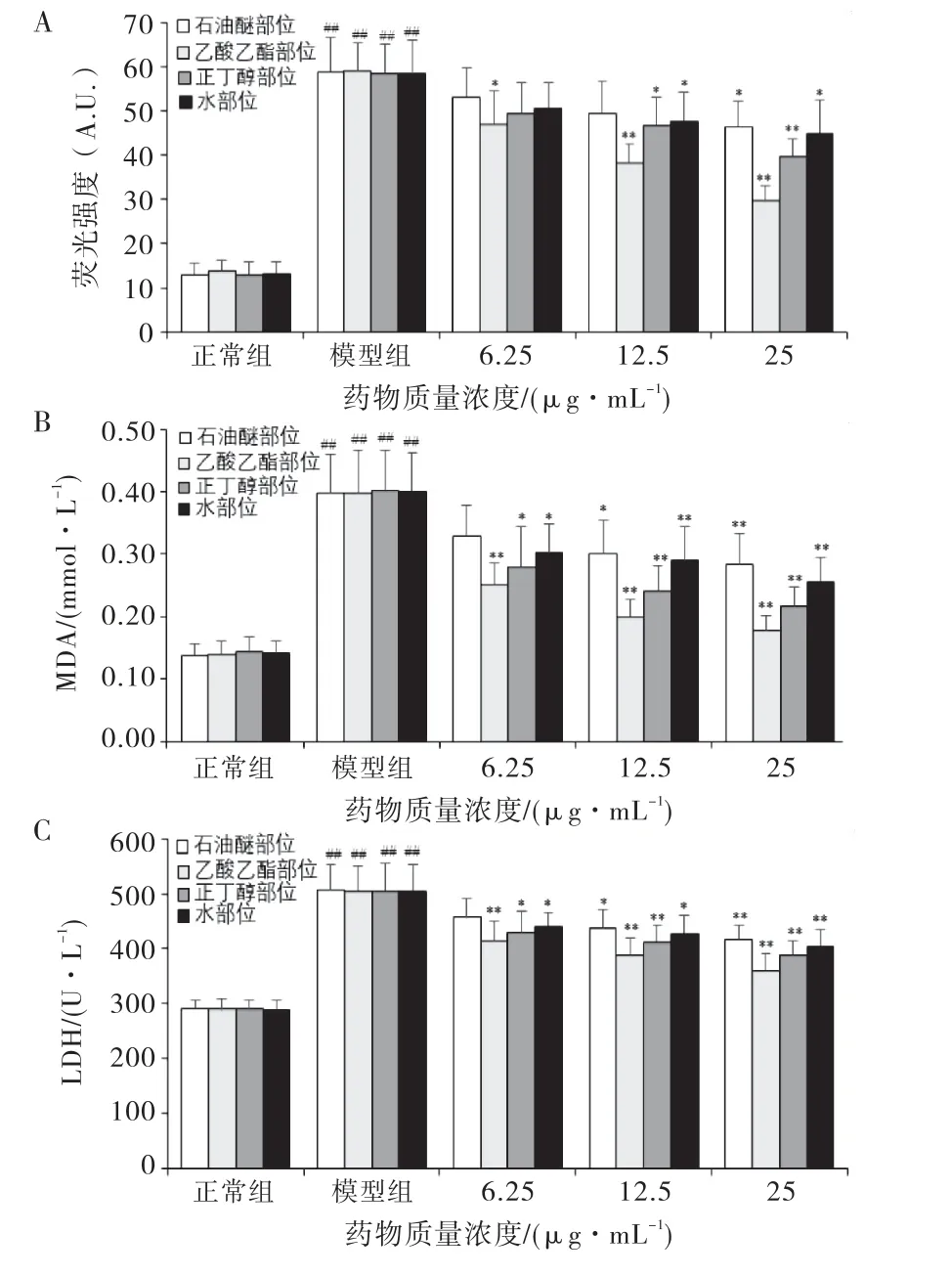
图6 腐乳毛霉醇提物不同极性部位对CCl4 致L-O2细胞损伤胞内ROS含量和培养液中MDA 含量和LDH 活性的影响
2.10 腐乳毛霉醇提物不同极性部位对CCl4 致LO2细胞损伤后培养液中SOD、GSH-Px和CAT 活性影响、
由图7 可见模型组L-O2 细胞培养液中SOD GSH-Px和CAT 活性明显降低,与正常组比较具有显著性差异(P<0.01);当用腐乳毛霉醇提物4个部位(6.25、12.5、25μg/mL)干预后,SOD、GSH-Px和CAT 活性明显升高,与模型组比较,均具有显著性差异(P<0.05或P<0.01).
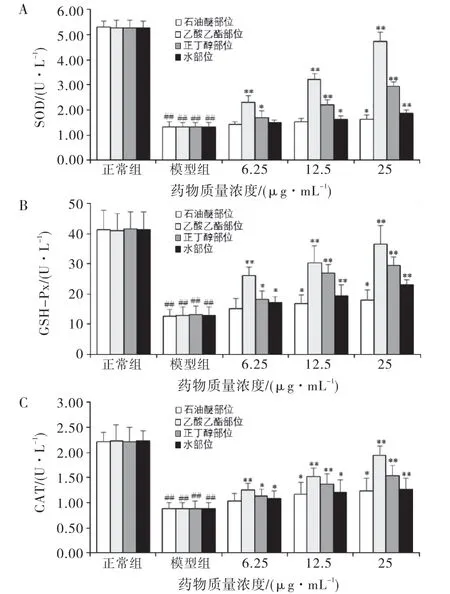
图7 腐乳毛霉醇提物不同极性部位对CCl4 致L-O2细胞损伤后培养液中SOD、GSH-Px和CAT 活性的影响
3 讨 论
研究中,将制备得到的腐乳毛霉醇提物的4个部位用钼酸铵法、DPPH 法、FRAP法和ABTS法分别对其抗氧化能力进行了比较分析.研究发现4个部位均具有较强的抗氧化、清除DPPH 和ABTS自由基及还原铁离子能力,其抗氧化能力由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位.
ROS是导致肝损伤的重要因素之一,虽然细胞正常情况下也会产生少量ROS,但是它会被胞内的内源性抗氧化酶清除;当肝脏受到机体内生的或者外源的不良刺激时会导致ROS过量生成,与胞膜上的磷脂双分子结合,引起脂质过氧化,破坏膜的完整性,使其通透性增加,导致细胞内酶(如LDH 等)泄漏.因此,ROS损伤被认为是引起肝细胞损伤的重要因素.在实验中,发现L-O2细胞损伤后,胞内ROS 含量和培养基中LDH 的活性明显升高,当用腐乳毛霉醇提物4个部位处理后,ROS含量和LDH 活性均明显降低.
众所周知,大量生成的ROS可使导致脂质过氧化产物MDA 大量生成,SOD 是生物体内清除ROS的重要物质,它清除ROS以减轻其对细胞造成的损伤,CAT 可使H2O2分解,从而使细胞免于遭受H2O2损伤.GSH 和GSSG 是细胞内含量最丰富的非蛋白巯基,当细胞处于氧化应激状态或某些代谢紊乱时,巯基与体内的ROS等结合,使其还原为容易代谢的酸类物质,从而减轻对细胞的损伤[4].由此可见,细胞内SOD、GSH-Px、CAT 等抗氧化酶是防止氧化应激导致肝细胞损伤的第一道防线,这些抗氧化酶为清除细胞内过量生成的ROS、减轻细胞氧化应激损伤提供了保障.在实验中,发现4个部位处理组的培养液中SOD、GSH-Px、CAT 的活性明显升高,MDA含量明显降低;从高到低依次为乙酸乙酯、正丁醇、水和石油醚部位.实验提示腐乳毛霉醇提物4个极性部位可通过清除过量生成ROS,减轻CCl4对L-O2细胞引起的氧化损伤,进而发挥对细胞保护作用.此结果与L-O2细胞形态学结果相一致.
综上所述,腐乳毛霉醇提物的4个部位均具有较强的抗氧化、清除DPPH 和ABTS自由基及还原铁离子能力,对CCl4引起L-O2细胞损伤具有显著的保护作用,证实其作用机制与其抗氧化作用有关.在腐乳毛霉醇提物4个极性部位中,其作用效果由强到弱依次为乙酸乙酯、正丁醇、水和石油醚部位.

