烟曲霉素5 L罐发酵条件优化及中试
王昊鹏,杨 萌,吴黎明,倪 辉,肖安风,张中印*
(1.河南科技学院 资源与环境学院,河南 新乡453003;2.中国农业科学院蜜蜂研究所,北京100093;3.集美大学 食品与生物工程学院,福建 厦门361021)
烟曲霉素(fumagillin)是一种重要的天然活性物质,是由烟曲霉菌(Aspergillus fumigatus)代谢产生的。现有研究报道,烟曲霉素能够防治蜜蜂[1-3]、鱼[4-5]和虾的微孢子虫病;同时,烟曲霉素及其结构类似物(fumagillin B、TNP-470和CKD-732等)能够抑制新生血管生成[6],被作为肿瘤细胞血管生成抑制剂用于癌症的治疗[6-7];烟曲霉素也用于治疗艾滋病患者的感染[8]和器官移植时减轻肠道感染微粒子病[9]的情况;此外,烟曲霉素能够改善由于饮食诱导的肥胖症[10-12],有望成为减肥新药物。
目前,国内关于烟曲霉素的发酵生产研究还处于实验室阶段,同时由于知识产权和贸易保护等因素,使国外的相关研究成果难以参考与借鉴,而烟曲霉素又作为新型的抗生素药物,在医药、作物病害防治、蜂业、蚕业和渔业养殖[13-17]等方面均有重要应用,因此进行烟曲霉素的发酵试验具有十分重要的意义。
发酵罐是发酵工业的心脏,是实现产品由实验室到商品化成品的必要设备[18]。该研究在烟曲霉素摇瓶发酵的基础上,进行5 L发酵罐的工艺优化及中试放大,以获得具有产业化应用价值的发酵工艺参数。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
烟曲霉(Aspergillus fumigatus)CEA-1701:中国农科院蜜蜂研究所。
1.1.2 试剂
烟曲霉素标准品:北京百威灵科技有限公司;甲醇(色谱纯):美国Tedia公司;消泡剂:按照泡敌∶植物油∶水(V/V)=1∶1∶3配制,其中泡敌购自厦门汇盛生物有限公司;玉米粉:漳州闽成玉米制品有限公司;其他生化试剂及药品均为国产分析纯。
1.1.3 培养基
菌种活化培养基:采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,土豆200 g,琼脂15 g,葡萄糖20 g,定容至1 000 mL,1×105Pa灭菌20 min。
发酵培养基:甘油33.5 g/L,酵母提取粉3.1 g/L,玉米粉1.7 g/L,MgSO4·7H2O 0.5 g/L,K2HPO41.5 g/L,KCl 0.5 g/L,FeSO4·7H2O 0.013 g/L。初始pH调整为6.0±0.5,1×105Pa灭菌20 min。
1.2 仪器与设备
LC-20AT高效液相色谱仪(inertsustainRC18色谱柱(250×4.6 mm,5 μm)):日本岛津公司;MJX 智能型霉菌培养箱:上海博迅实业有限公司;TDL-40B 台式离心机:上海安亭科学仪器厂;PE20实验室pH计:梅特勒-托利多仪器(上海)有限公司;GZX-DH 电热恒温干燥箱:上海跃进医疗器械厂;SW-CJ-2FD双人单面净化工作台:苏州净化设备有限公司;BIOTECH-5BG-7000A 5 L自动发酵罐:上海保兴生物设备工程有限公司。
1.3 方法
1.3.1 单孢子菌悬液的制备
将烟曲霉CEA-1701接种到PDA斜面培养基,28 ℃恒温培养5~7 d得到成熟孢子。无菌操作下,用无菌生理盐水洗下孢子,倒入装有玻璃珠的无菌锥形瓶中,充分振荡30 min。待孢子充分打散后,测菌悬液OD600nm值,并用无菌生理盐水调整其OD600nm至2.0,即得单孢子菌悬液[19]。
1.3.2 初始发酵条件
5 L发酵罐,以1%接种量将单孢子菌悬液在火焰保护下接种至装液量为3.5 L的发酵罐中。发酵温度30 ℃,初始pH为6.0±0.5,无菌空气通气量为0.5 m3/h,搅拌转速500 r/min,发酵培养168h,每12h取样测定烟曲霉素含量和生物量产量。
1.3.3 生物量的测定
准确移取5 mL发酵液于室温条件下5 000 r/min离心10 min,然后转移、保存上清液测定烟曲霉素的含量,将沉淀的菌体用蒸馏水清洗3次后于80 ℃烘箱内烘干至质量恒定,称质量,统计生物量。
1.3.4 烟曲霉素含量的测定
样品处理:将离心得到的上清液,通过0.22 μm的滤膜过滤于棕色进样瓶中,过程尽量避光。
色谱分析条件:InertsustainRC18反相柱,紫外检测器检测波长350 nm,柱温25 ℃,进样20 μL,流速0.8 mL/min。流动相为水(A)、甲醇(B),溶剂梯度洗脱程序为:0~2 min,A/B=80∶20(V/V);2~5 min,A/B=70∶30;5~15 min,A/B=30 ∶70;15 ~25 min,A/B=10 ∶90;25 ~27 min,A/B=10 ∶90;27~28 min,A/B=80∶20;28~40 min,A/B=80∶20。
烟曲霉素标溶液制备:以烟曲霉素标准品1 000 mg/L为母液,色谱纯甲醇为溶剂,稀释成不同质量浓度的标准溶液5 mg/L、10 mg/L、20 mg/L、40 mg/L、80 mg/L、100 mg/L、150 mg/L、200 mg/L,每个梯度做5个平行,绘制烟曲霉素标准曲线,得到标准曲线回归方程为y=209 858x-12 376,相关系数R2=0.999 8,根据回归方程计算烟曲霉素质量浓度。
1.3.5 发酵过程中参数的测定
通过5 L发酵罐的溶氧电极测定发酵液的溶氧量(dissolved oxygen,DO),通过pH电极测定发酵液pH。
1.3.6 单因素试验优化
分别考察不同转速条件(500 r/min、600 r/min、700 r/min、800 r/min)、不同发酵温度(25 ℃、30 ℃和35 ℃)、不同发酵pH(pH为6.0、7.0和自然pH条件(6.2~6.5))、不同接种量(1%、3%、5%)、不同碳源(甘油、葡萄糖和可溶性淀粉)作为单一碳源时,烟曲霉CEA-1701产烟曲霉素的变化情况。
1.3.7 20 L发酵罐中试
根据5L发酵罐优化结果,采用经验放大法进行20 L罐的中试试验。在以发酵温度30 ℃,自然pH,搅拌转速270 r/min,通气量0.5 m3/h的条件下,考察0.5%、1%和3%接种量对烟曲霉素产量的影响,发酵周期内每12 h取样测定烟曲霉素含量和生物量产量。
2 结果与分析
2.1 不同转速对烟曲霉素产量的影响
结合摇瓶试验研究,发现发酵液中菌丝体形态对烟曲霉素的产量影响较大,如果发酵过程出现菌丝体结团现象将不利于烟曲霉素的合成,在发酵罐放大试验中,可以通过搅拌来解决菌丝体结团的现象。一方面,搅拌能够提高发酵液的溶氧量,使菌丝体在剪切力的作用下被充分切碎、打散;另一方面,过高的搅拌转速剪切力过大易引起菌体细胞破损,造成代谢异常,过低的搅拌转速菌丝体相互缠绕结团形成菌丝球,不利于发酵生产[20]。
保持5 L发酵罐初始发酵条件不变,分别考察500 r/min、600 r/min、700 r/min、800 r/min转速条件对烟曲霉CEA-1701产烟曲霉素、生物量、pH以及DO的影响。结果如图1所示。
由图1可知,烟曲霉素产量变化曲线整体呈现出先增后降再增最后趋于稳定的趋势。搅拌转速为500 r/min时,由于搅拌转速低,烟曲霉CEA-1701生长较慢,在发酵36 h时才达到最大生物量16.38 g/L,48 h时才在发酵液中检测到烟曲霉素,96~168 h DO快速回升表明菌体出现大量衰亡,发酵周期内检测到烟曲霉素的最高产量为46.01 mg/L;搅拌转速为600 r/min时,烟曲霉素产量得到大幅提高,达到90.78 mg/L,但溶氧从24 h就基本趋于20%的水平,这说明溶氧还可以进一步的提高;搅拌转速为700 r/min和800 r/min时,发酵曲线变化趋势基本一致。在36~120 h时,溶氧变化曲线均出现持续掉零现象[21],但菌体仍维持一定的生物量产量,这说明烟曲霉CEA-1701为兼性厌氧菌。发酵周期内烟曲霉素的最高产量分别达到90.22 mg/L和94.75 mg/L。综上所述,最终选择转速800 r/min进一步优化5 L发酵罐发酵工艺。
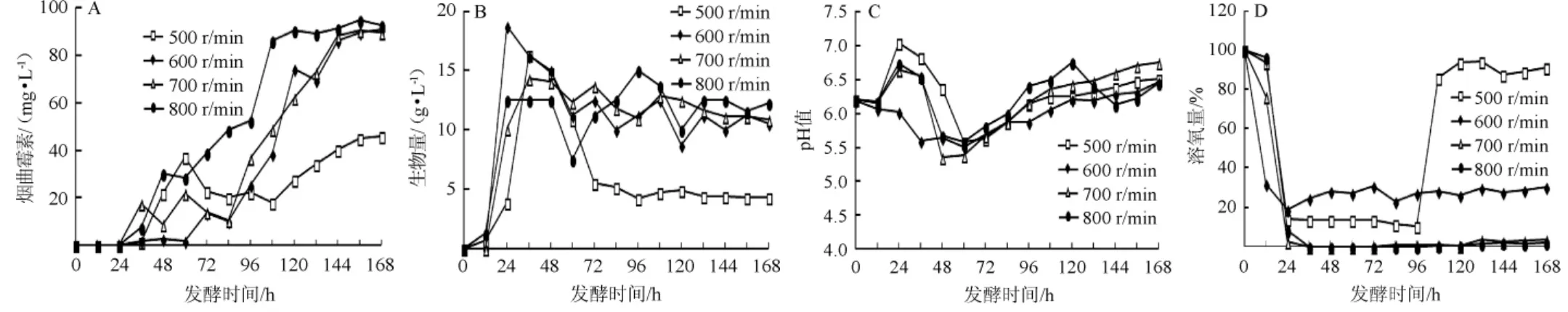
图1 不同搅拌转速对烟曲霉CEA-1701产烟曲霉素(A)、生物量(B)、pH(C)以及溶氧量(D)的影响Fig. 1 Effects of different stirring speed on fumagillin production (A),biomass (B), pH (C) and dissolved oxygen (D) by Aspergillus fumigatus CEA-1701
2.2 不同温度对烟曲霉素产量的影响
发酵温度的调控对微生物生长和代谢产物的积累具有重要意义[22]。发酵温度过高菌体易老化,细胞内部分酶活性降低;发酵温度过低菌体无法正常生长,这在摇瓶实验中已经得到验证。基于摇瓶发酵温度的研究结果,选取25 ℃、30 ℃和35 ℃三个温度梯度进行5 L发酵罐温度优化,结果如图2所示。

图2 不同发酵温度对烟曲霉CEA-1701产烟曲霉素(A)、生物量(B)、pH(C)以及溶氧量(D)的影响Fig. 2 Effects of different fermentation temperatures on fumagillin production (A), biomass (B), pH (C) and dissolved oxygen (D) by Aspergillus fumigatus CEA-1701
由图2可知,3种不同发酵温度烟曲霉素的发酵曲线趋势大致相同:其中以30 ℃和35 ℃进行发酵时较25 ℃能够较早的产生烟曲霉素,当发酵温度为30 ℃时,整个发酵周期pH变化在5.5~7.0之间,相对较稳定,烟曲霉素获得了较高的产量为94.7 mg/L;35 ℃发酵时,24~48 h时pH下降较快,96 h后又出现持续的升高,这是由于35 ℃烟曲霉CEA-1701生长过快导致的,烟曲霉素最高产量达到81.17 mg/L;25 ℃发酵时,24 h生物量产量仍较低,36~96 h生物量变化曲线出现上下波动,pH明显较高,这主要是因为发酵温度低菌体生长代谢慢,发酵液粘稠导致的。由图2(d)可知,25 ℃发酵时,最先出现溶氧下降,而生物量并不是最先增加的,这是由于发酵初期温度低,溶氧量低,菌体生长缓慢导致的;35 ℃和30 ℃的DO变化曲线基本一致,均在发酵36 h出现掉零现象。综上所述,30 ℃发酵时,能够较早的生成烟曲霉素并且烟曲霉素产量最高达到94.7 mg/L,整个发酵过程pH变化较稳定,因此,进一步的研究选择发酵温度为30 ℃。
2.3 不同发酵pH对烟曲霉素产量的影响
发酵过程的pH是动态变化的,pH影响菌丝体的生长代谢,过高的pH不利于烟曲霉素的积累[23],当发酵液pH值超过7.5时烟曲霉素将会分解,根据摇瓶实验及现有报道,选择pH为6.0、7.0和自然pH条件下,对比不同pH条件下5 L发酵罐中烟曲霉素产量、生物量、pH以及DO变化情况,结果如图3所示。
由图3可以看出,不同pH条件下的烟曲霉素产量变化曲线、生物量和DO变化曲线基本呈现出一致的变化趋势。pH为6.0和自然pH条件下,能够较早的生成烟曲霉素,其中自然pH条件下,烟曲霉素获得了较高的产量达到82.08mg/L;生物量变化曲线说明,在pH为6.0、7.0和自然条件下烟曲霉CEA-1701均能正常生长,其中以pH为7.0获得了较高的生物量产量17.5 g/L,烟曲霉素最高产量为72.81 mg/L;DO变化曲线可以看出,自然pH条件下,DO最先出现下降,这说明自然pH条件下更适宜烟曲霉CEA-1701的生长。综上所述,选择在自然pH条件下进行。

图3 不同发酵pH对烟曲霉CEA-1701产烟曲霉素(A)、生物量(B)、溶氧量(C)的影响Fig. 3 Effects of different fermentation pH on fumagillin production (A), biomass (B), dissolved oxygen (C) by Aspergillus fumigatus CEA-1701
2.4 不同接种量对烟曲霉素产量的影响
对接种量的优化,是在解决发酵菌体结团的情况下,考察接种量为1%、3%和5%对烟曲霉CEA-1701产烟曲霉素、生物量、pH以及DO的影响,结果如图4所示。
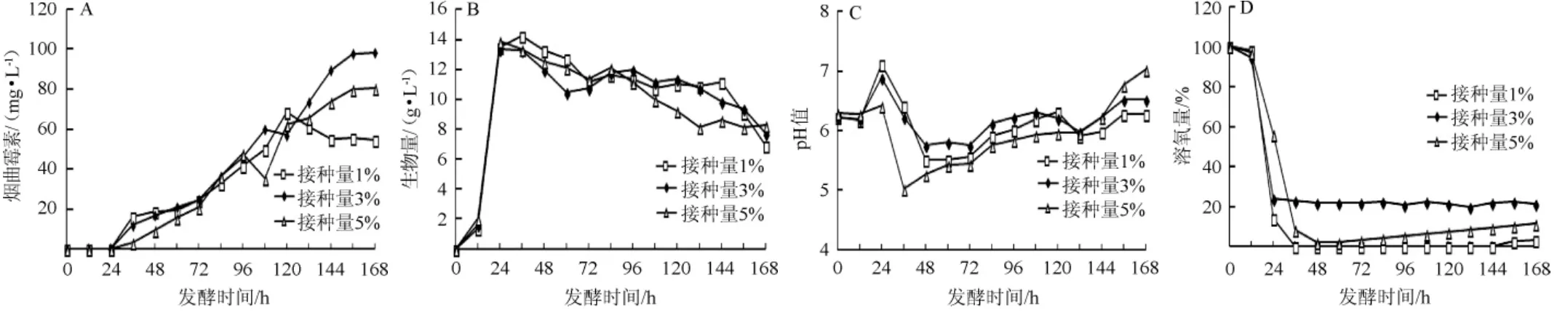
图4 不同接种量对烟曲霉CEA-1701产烟曲霉素(A)、生物量(B)、pH(C)以及溶氧量(D)的影响Fig. 4 Effects of different inoculum on fumagillin production (A), biomass (B), pH (C) and dissolved oxygen (D) by Aspergillus fumigatus CEA-1701
由图4可以看出,不同接种量条件下的发酵曲线变化基本一致。1%和3%接种量在发酵前120 h烟曲霉素产量都略高于5%接种量,1%、3%和5%发酵周期内烟曲霉素最高产量分别达到68.82 mg/L、97.76 mg/L和80.42 mg/L;生物量变化曲线基本一致,都呈现出急速上升然后缓慢下降的趋势;pH变化曲线显示,5%接种量的pH变化波动较大;DO变化曲线显示3%接种量条件下较早的达到了溶氧平衡状态,5%接种量发酵后期DO出现持续回升。综合来看,选择3%接种量进行下一步的研究。
2.5 不同碳源对烟曲霉素产量的影响
根据摇瓶试验结果,可溶性淀粉作为单一碳源发酵时,菌丝体容易出现结团现象,考虑到5 L发酵罐能够通过搅拌解决菌丝体结团现象,因此再一次利用可溶性淀粉作为单一碳源,同时对比甘油和葡萄糖作为碳源时的发酵效果,结果如图5所示。

图5 不同碳源对烟曲霉CEA-1701产烟曲霉素(A)、生物量(B)、pH(C)以及溶氧量(D)的影响Fig. 5 Effects of different carbon sources on fumagillin production (A), biomass (B), pH (C) and dissolved oxygen (D) by Aspergillus fumigatus CEA-1701
由图5可以看出,甘油作为碳源能够较早的合成烟曲霉素,烟曲霉素的最高产量为82.81 mg/L;可溶性淀粉和葡萄糖分别作为发酵碳源时,烟曲霉素的最高产量分别达到69.47 mg/L和62.81 mg/L。生物量变化曲线显示发酵初期可溶性淀粉获得了较高的生物量,产量达到19.44 g/L,这主要是因为可溶性淀粉作为发酵碳源初期发酵液中有部分沉淀导致的;其他两种碳源发酵时生物量变化基本一致。pH变化曲线显示,可溶性淀粉作为发酵碳源时,整个发酵周期pH都较高;葡萄糖作为发酵碳源,发酵初期pH较低,这是因为葡萄糖作为碳源产生酸性物质较多;甘油作为碳源时,发酵周期内pH变化较稳定。溶氧变化曲线可以看出,可溶性淀粉作为发酵碳源在发酵72 h时就出现DO持续升高,这可能是因为发酵pH过高导致菌体过早死亡;甘油作为发酵碳源时,从36 h溶氧DO就出现持续掉零,这说明菌体代谢活动旺盛。
综上所述,再解决发酵菌体接团现象时,可溶性淀粉未能获得较高的烟曲霉素产量,经过对比,适宜烟曲霉CEA-1701产烟曲霉素的发酵碳源为甘油。
2.6 20 L发酵罐不同接种量发酵曲线
根据5 L罐的发酵条件,首先控制20 L罐与5 L罐保持相同的发酵温度、pH、通气量和允许的最高转速270 r/min进行发酵试验,对比不同接种量时烟曲霉素的发酵效果,同时为了能够了解扩大培养后的发酵周期,在烟曲霉素产量出现下降时再终止发酵,结果如图6所示。
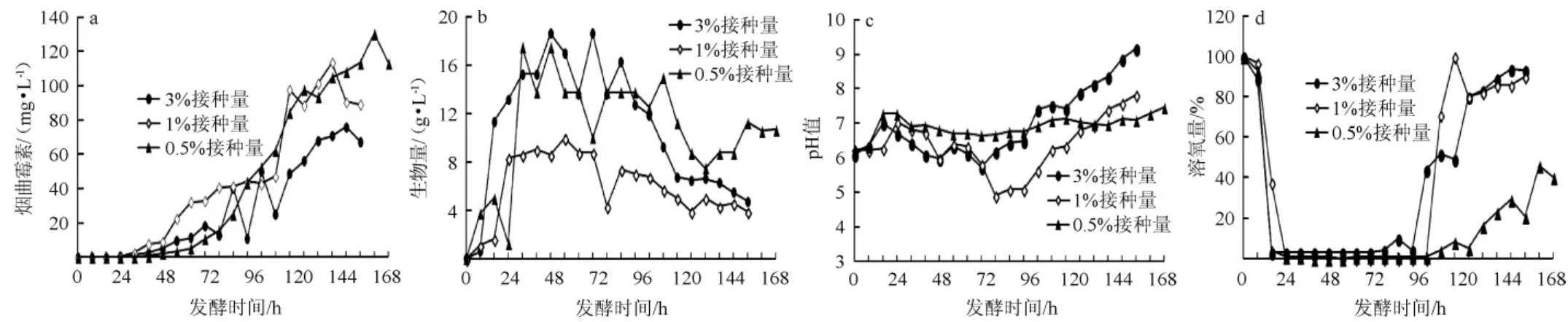
图6 不同接种量条件下的烟曲霉CEA-1701 20 L罐发酵曲线Fig. 6 Fermentation curve of Aspergillus fumigatus CEA-1701 in 20 L fermenter with different inoculum
由图6(a)可以看出,3%和1%接种量较0.5%接种量能够较早的生成烟曲霉素,这主要是接种量高能够较快的积累一定的生物量;3%和1%接种量分别发酵至228 h和216 h时烟曲霉素产量达到最高分别为75.91 mg/L和113.58 mg/L;0.5%接种量72 h后烟曲霉素发酵曲线呈现出持续增长的趋势,240 h时测得烟曲霉素产量达到113.31 mg/L,此时烟曲霉素曲线仍呈上升趋势,后续又接着发酵了24 h最终烟曲霉素产量达到130.57 mg/L。
由图6(b)可知,不同接种量的生物量变化曲线总体呈现出先增后平稳再降低的趋势,其中3%和1%接种量的生物量积累速度快于0.5%接种量;3%和0.5%接种量的生物
量最高分别达到18.62 g/L和17.5 g/L,1%接种量生物量较低,最高生物量积累量为8.37 g/L。
由图6(c)可知,0.5%接种量时整个发酵过程pH变化较稳定,3%和1%接种量发酵后期pH出现持续升高,这跟6(d)DO变化曲线相关,发酵至144 h后3%和1%接种量的DO都出现明显回升,主要是因为大量菌体的自溶,含氮物质的分解试放导致的。0.5%接种量发酵至192 h后DO才出现缓慢的增长,这说明在无法提高转速和改善发酵液溶氧量的情况下,较低的接种量反而有利于发酵状态的稳定。
3 结论
5 L发酵罐优化得到的发酵条件为:甘油为碳源,搅拌转速800 r/min,发酵温度30 ℃,接种量3%,通气量0.5 m3/h,自然pH,在此发酵条件下发酵培养168 h,烟曲霉素产量达到97.76 mg/L。
通过对转速的优化发现,在通气量一定的条件下,一定范围内提高转速有利于烟曲霉素的积累;温度优化时发现,发酵初期适当的高温有利于烟曲霉CEA-1701的快速繁殖,发酵后期适当降低温度有利于烟曲霉素积累,这一点可以考虑后续进行分段控温发酵。pH优化发现,发酵初期较高的pH有利于生物量的积累;对接种量进行优化,得出3%的接种量更有利于烟曲霉CEA-1701的生长和烟曲霉素的积累;通过不同碳源发酵对比,发现利用甘油作为单一碳源有利于烟曲霉素的积累。
20 L发酵罐进行发酵时,发酵周期较长,0.5%接种量较1%和3%接种量更有利于烟曲霉素的积累,发酵168 h时烟曲霉素产量达到62.55 mg/L,发酵至252 h烟曲霉素积累量达到最高130.57 mg/L,中试效果良好。

