斑马鱼早期胚胎发育囊胚sphere时期的蛋白组学研究
陈 漪,胡瑞芹,冉皓宇,陈良标
(1. 海洋生物科学国际联合研究中心(上海海洋大学, 中国科学技术部), 上海 201306;2. 水产种质资源发掘与利用教育部重点实验室(上海海洋大学), 上海 201306; 3. 水产科学国家级实验教学示范中心(上海海洋大学),上海 201306)
斑马鱼(Daniorerio)作为脊椎动物中的模式生物,具有繁殖容易、发育快、体外受精、体外发育、胚胎透明等优点,有利于研究胚胎发育过程。斑马鱼胚胎的早期发育是一个非常复杂的过程,涉及到了细胞分裂、细胞运动、胚层形成、背腹分化、前后轴线分化以及器官形成等多个方面[1-3]。这些生理进程中诸多信号通路互相协调、共同作用,联合控制着整个发育过程。近年来国内外有大量的研究均采用斑马鱼为实验动物展开,并且在与生物早期胚胎相关的诸多领域中有重要发现,例如环境或化学因素对发育过程的影响、细胞活动、物质形成以及组织和器官的形成机制等。
斑马鱼胚胎发育至4hpf即胚胎球型期(sphere),是介于囊胚(blastula)和外包(epiboly)两个时期之间的过渡时期。研究sphere时期的基因和蛋白质表达的模式有助于揭示斑马鱼早期发育关键时期的调控机制。在斑马鱼的胚胎形成过程中,从囊胚期到外包期的过程是合子基因起始表达的关键时期,胚层细胞也开始分化和协同运作,然而其调控网络复杂且机制尚不明确。有研究发现在斑马鱼胚胎囊胚期,分子粘连蛋白在深层细胞间形成放射状的相互联系[4]促使胚胎正常外包;有许多信号通路涉及到斑马鱼胚胎囊胚到外包的调控过程,诸如Wnt/PCP通路、PDGF-PI3K通路、Eph-Ephrin信号通路、Jak-Stat信号通路及MAP激酶级联反应等[5-9]。
蛋白质是基因功能的最终执行者,也是细胞增殖、分化、凋亡等生命活动的直接体现者[10]。利用蛋白质组学可以从蛋白质水平了解生物个体、组织器官的发育形成过程和基因调控机制。蛋白质组学的研究实现了同基因组、转录组分析的对接,为发育生物学各领域的研究提供更可靠的理论依据[11-12]。
基于高通量测序的基因组和转录组研究已经广泛的应用于斑马鱼胚胎发育过程,通过转录组可以对各个阶段的基因表达模式和表达差异动态变化进行比较分析。然而全基因组序列和转录组水平的基因表达并不足以阐明参与调控斑马鱼胚胎发育过程的一些生物功能和机制。在整体的功能研究中需要在基因水平和蛋白水平上相互验证、互为补充[13]。蛋白组学的研究在许多鱼类的发育过程中均有报道,诸如在金鱼(Carassiusauratusl)胚胎发育早期[14]、鲑鱼从体节期到器官形成阶段[15]、草鱼(Ctenopharyngodonidellus)的肝脏器官发育[16]及斑马鱼卵巢发育阶段[17-18]等。
常规的2D-GE和 MudPIT的蛋白组鉴定方法能够检测到的蛋白质数量十分有限。相对和绝对定量的等量异位标签iTRAQ (isobaric tags for relative and absolute quantitation) 是由美国ABI应用生物系统公司研发的一种多肽体外标记技术[19]。 iTRAQ标记联合质谱分析具有分离能力强、分析范围大、高灵敏度及定性分析结果较可靠等优点,现已成为差异蛋白质组学定量研究的主要工具之一[20]。iTRAQ标记与LC-MS/MS串联质谱技术已被广泛应用于生命科学蛋白质组学研究的各个方面。在斑马鱼中,iTRAQ被广泛用于鳃组织[21]、肝组织[22]、中枢神经系统[23]以及胚胎[24]的蛋白质组学研究中。
本研究以高通量和高灵敏度的iTRAQ蛋白质组定性定量技术为基础,结合高效液相色谱-串联质谱法(LC -MS /MS),检测斑马鱼胚胎发育sphere时期蛋白质表达情况,探索新的蛋白质,并进一步分析这些蛋白质的生物学功能,从而获得不同蛋白在该时期的表达情况及其参与的生物学过程,以期为进一步研究斑马鱼胚胎发育过程及其调控机制提供基础数据和参考。
1 材料与方法
1.1 实验材料
斑马鱼及胚胎收集:AB品系的野生型斑马鱼购于北京中国科学院遗传与发育生物学研究所,在本实验室循环养殖系统中养殖传代。孵化后斑马鱼在3 L鱼缸中养殖至性成熟,以适宜水环境饲养,水温为(28.5±0.5) ℃, pH值7±0.5,电导率450~550μS;通过自动光照系统控制光照周期(明14 h,暗10 h)。每天2次(9∶00, 18∶00)按时投喂初孵丰年虫。繁殖时将雌雄斑马鱼(各1条)置于孵化缸内以隔板隔开,次日将隔板抽离,使雌雄鱼追尾产卵,约10 min后将亲鱼转移至另一盛有干净循环水的缸中并标记产卵日期。收集孵化缸底斑马鱼胚胎,置于培养皿中,清洗并加入E3培养基,斑马鱼胚胎在恒温培养箱中发育,温度为(28.5±0.5) ℃。发育至4 hpf的斑马鱼胚胎在PBS缓冲液中快速剥去卵壳,去卵壳的斑马鱼胚胎取100枚收集到干净的1.5 mL EP管中,吸去多余的PBS,放入液氮中速冻5 min,-80 ℃保存待用。共取3组相同时期、相同处理条件、相同数目不同亲本斑马鱼所产的胚胎样品。
1.2 主要试剂与仪器
iTRAQ Reagent-8Plex Multiplex Kit购自AB Sciex公司;液相Easy nLC/ Ultimate 3000、色谱柱(C18 1.9 mm 150 μm×120 mm)、色谱预柱(C18 3 mm 100 μm×20 mm) 均购自于Thermo Scientific公司;HPLC分级液相1260 infinity Ⅱ购自Agilent公司;HPLC分级色谱柱xBridge peptide BEH 130 C18 column 购自Waters公司;Q-Exactive HF质谱仪购自Thermo Scientific公司。
1.3 斑马鱼鱼卵蛋白质提取和iTRAQ标记
1.3.1 斑马鱼卵蛋白质提取、定量及电泳
每组冷冻保存的样品溶解后加入裂解液(含8 M尿素)、50 mM 的NH4HCO3以及蛋白酶抑制剂。裂解样品速度1 000 g以上,4 ℃离心30 min,取上清液。提取的总蛋白进行去高丰度处理(高丰度卵黄蛋白)。根据 Bradford 法测蛋白浓度,确定 SDS-PAGE 和 iTRAQ 分析所需要的蛋白量。各取25 μL蛋白质样品5∶1(v/v)加入5×体积上样缓冲液,沸水浴5 min,转速14 000 r·min-1离心10 min后取上清液,进行10% SDS-PAGE电泳。电泳条件:恒流14 mA,时间90 min。电泳后进行考马斯亮蓝染色检测蛋白质量。
1.3.2 蛋白Trypsin酶切和iTRAQ标记
蛋白质定量后每个样品取200 μg置于离心管中,加入5 μL的1 M DTT(二硫苏糖醇),37 ℃孵育1 h后,加入20 μL 1 M的IAA (吲哚乙酸),混匀后,室温下避光反应1 h。吸取所有样品加入超滤管中,离心后弃收集液;加入100 μL UA(8M urea,100 mM Tris-HCl,pH8.0)至超滤管中,离心后弃收集液,重复2次;加入0.5 M TEAB 100 μL,离心后弃收集液,重复3次;更新收集管,在超滤管中加入胰蛋白酶,按照蛋白和酶50∶1(w/w)的比例加入Trypsin,37 ℃酶解12~16 h。取100 μg 酶解片段脱盐处理,按照AB公司试剂盒iTRAQ Reagent-8Plex说明书进行标记。3组蛋白质样品进行iTRAQ标记标签分子量分别为113(A-4h-1)、114(A-4h-2)、117(A-4h-3)。标记之后取少量样本混合,进行LC-MS/MS质谱检测,查看iTRAQ标记效率。
1.4 高pH条件下HPLC分离肽段混合物及质谱分析
1.4.1 高pH条件下C18色谱柱的HPLC分级
将标记抽干后的肽段样品用100 μL液相A流动相复溶,涡旋振荡,转速14 000 r·min-1离心20 min,吸取上清液进行色谱上样;准备60个空白1.5 mL离心管,依次标记为1~60,用于收集分离得到的组份1~60。在高pH条件下HPLC仪中进行反相分离。使用色谱柱(C18 1.9 mm 150 μm×120 mm),流速为0.7 mL·min-1。A相流动相为2%乙腈(ACN)、98% Milipore水,pH10;B相流动相为98% ACN和2% Milipore水,pH10。B相梯度如下:0~3 min升至 5%,保持2min,5~45 min升至35%,45~53 min升至90%,保持7 min。从5 min开始,依次收集每1.5 min洗脱物到1~60号离心管中,真空冷冻离心干燥。
1.4.2 质谱分析
将干燥后的样品用5 μL 0.5%的甲酸(FA)重溶,并将收集到的60个组分合并成多个组分,将合并后的组分转速14 000 r·min-1离心10 min,吸取上清上样10 μL,进行高效液相色谱-质谱串联(HPLC-MS/MS)分级分析。采用毛细管高效液相色谱,每份样品采用纳升流速HPLC液相系统进行分离。色谱柱以95%的A液平衡。样品由自动进样器上样到质谱预柱(C18 3 mm 100 μm×20 mm),再经分析柱分离,流速及相关液相梯度如下:流速为600 nL·min-1,A相流动相为0.1% FA、99.9% Milipore水;B相流动相为0.1% FA、99.9% ACN。B相梯度如下:初始5%,0~16 min升至10%,16~51 min升至22%,51~71min升至30%,71~72 min升至95%,72~78 min维持95%。每份样品经毛细管高效液相色谱分离后用质谱仪进行质谱分析。质谱全扫描质量范围300~1400 m·z-1,分辨率150 000,选取一级信号强度最高的20个离子进行二级质谱分析,二级质谱全扫描质量范围200~2 000 m·z-1,动态排除设置为12 s。
1.4.3 数据库检索
使用Proteome Discovery搜库软件(Thermo Fisher) ,Mascot (Version 2.2)搜索引擎对Uniprot database斑马鱼数据库(uniprot-danio+rerio_170221.fasta)进行搜库。搜库参数如表1所示。结果过滤参数为:Peptide FDR≤0.01,Peptide score>10。
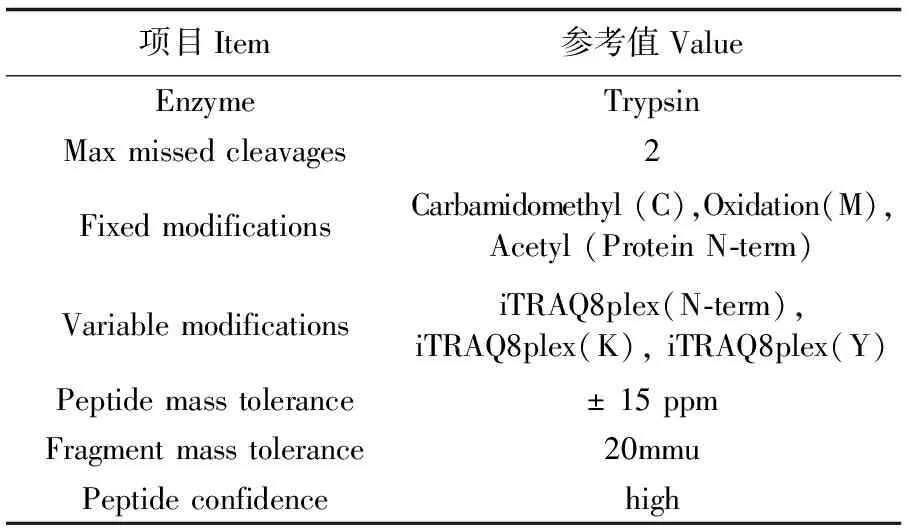
表1 蛋白质数据库检索参数Tab.1 Protein database retrieval parameters
1.5 生物信息学分析
对鉴定出的蛋白进行生物过程及分子功能分析。通过Gene Ontology数据库(http://www.geneontology.org)对鉴定蛋白作GO功能注释分析;通过KEGG公共数据库(http://www.kegg.jp/kegg/pathway.html)对鉴定蛋白作KEGG功能注释分析,进行Pathway代谢通路注释;将鉴定到的蛋白和KOG数据库(cluster of orthologous groups of proteins,蛋白相邻类的聚簇)进行比对,对蛋白质进行直系同源分类并预测这些蛋白可能的功能,然后做功能分类统计。
2 结果与分析
2.1 斑马鱼胚胎发育4hpf时期形态
斑马鱼早期胚胎发育根据形态可以划分成7大时期——合子期(zygote)、卵裂期(cleavage)、囊胚期(blastula)、原肠胚期(gastrula)、体节期(segmentation)、咽囊期(pharyngula)及孵化期(hatching period),随后进入仔稚鱼阶段。斑马鱼的早期胚胎发育在4hpf时期进入决定胚胎发育方向的关键时期。胚胎从受精至发育4 h,胚胎处于囊胚后期,动物极囊胚细胞进行不同步分裂,由于细胞的持续分裂与细胞运动,胚盘由原先的椭球形变为球型,细胞向外扩展(图1-A),胚盘变平与卵黄形成水平边界(图1-B),称之为球型(sphere)阶段。从图1-C中红色箭头所示处可以明显看到箭头上方较小的囊胚细胞和下方较大的卵黄细胞。经历sphere阶段之后,胚胎卵黄细胞逐渐向动物极突起,胚层开始不均一增厚,胚胎进入外包期(epiboly)。
2.2 蛋白提取SDS-PAGE电泳分析
斑马鱼胚胎4hpf时期提取的各组蛋白样品经 Bradford 法蛋白定量及SDS-PAGE电泳。对电泳结果分析表明,3个平行重复样本中总蛋白在10~220 kDa分子量范围内得到有效分离,3组样品蛋白特异条带明显,相应的蛋白条带清晰、完整,蛋白没有发生明显降解。从电泳谱带上看,各组斑马鱼胚胎总蛋白中的高丰度脂质得到有效的去除,样品之间平行度较好,整体蛋白电泳谱带具有相似的带型,蛋白条带分布均匀、分辨率高且呈现多样性,含有的蛋白亚基种类和数量相似(图2)。初步表明蛋白的提取效果较为理想,蛋白总量和纯度满足进行下一步蛋白标记,液相色谱分级分离实验。
2.3 质谱鉴定和iTRAQ定量分析
经质谱分析并比对uniprot-danio+rerio_170221.fasta 数据库结果得出:iTRAQ标记效率为98.00%,鉴定到的总蛋白为1 178个,鉴定共计获得唯一肽段7 351个(图3),其中2段以上不同肽段覆盖的蛋白704种,占全部鉴定蛋白的59.76%;5段以上不同肽段覆盖蛋白398种,占全部鉴定蛋白的33.78%。通过iTRAQ标记,LS-MS/MS技术有效的分离和鉴定出了斑马鱼4hpf发育阶段胚胎中蛋白质的表达情况。3次重复实验之间的蛋白定量比值平均值都在1附近,表明3组蛋白样品之间重复性较好,检测出的蛋白质可信度较高。
对鉴定获得的1 178个蛋白质的分子量和等电点两种基本理化性质的分布进行统计分析,结果显示,所有鉴定到的蛋白质的相对分子质量分布在6.0~545.4 kDa之间,等电点范围为3.61~12.12。其中蛋白质等电点主要分布在5.0~8.9之间,占鉴定到蛋白总数的77.92%,92%的蛋白质相对分子质量在10~110 kDa之间(图4,图5)。

图1 斑马鱼4hpf时期胚胎形态Fig.1 Features of Danio rerio embryo in 4hpf stage注:A为胚胎正面观,B为侧面观;A、B比例尺为200 μm;C比例尺为100 μm;B、C中红色箭头所示为与胚胎囊胚细胞与卵黄细胞交界处Notes: A shows surface view of embryo, B shows lateral view of embryo; scale bar of A and B is 200 μm, scale bar of C is 100 μm; the red arrows in B and C point out the cell boundary
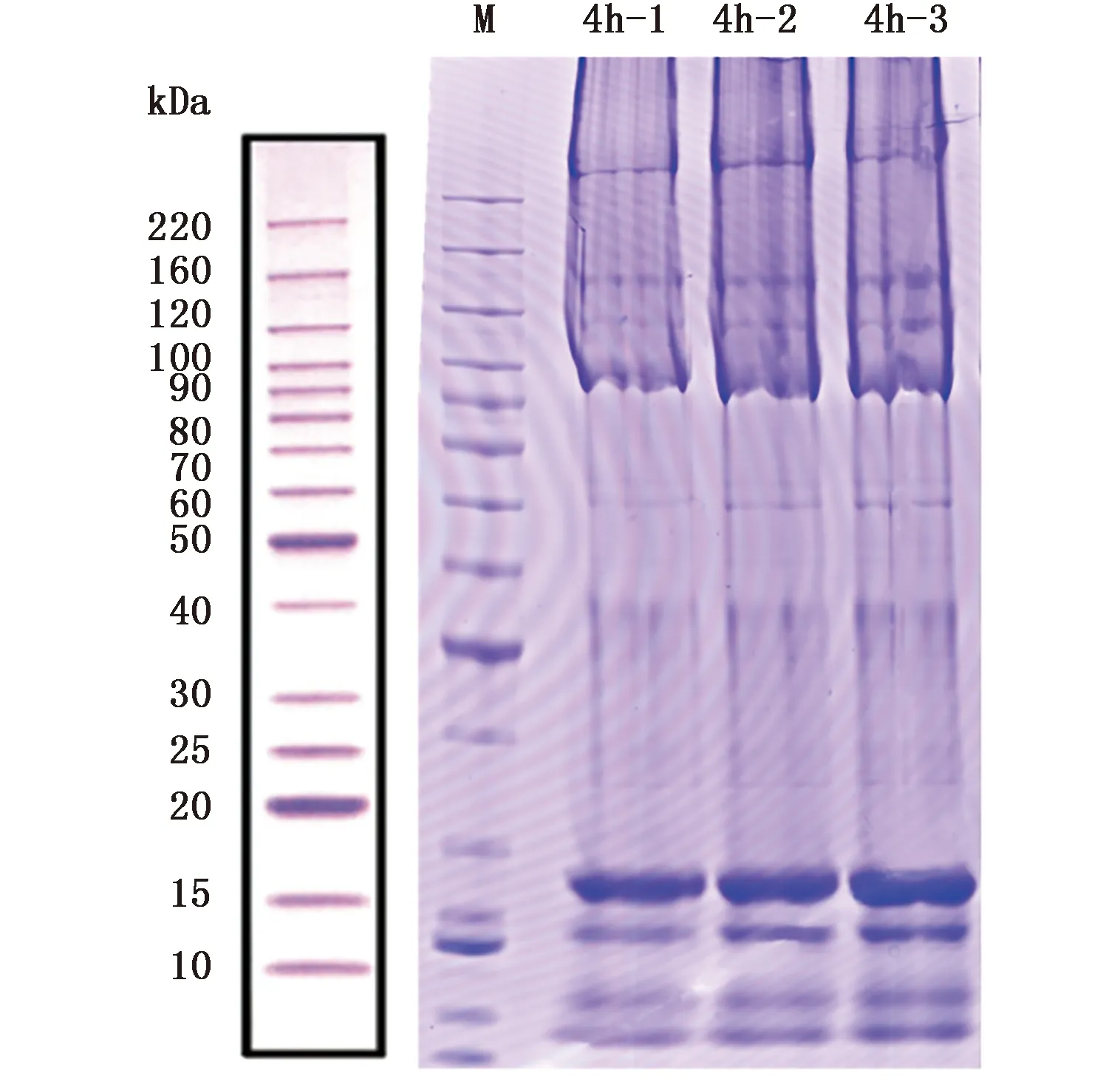
图2 斑马鱼4hpf胚胎蛋白SDS-PAGE图谱Fig.2 SDS-PAGE diagram ofDanio rerio 4hpf embryos protein注:M:蛋白标准marker;4h-1、4h-2、4h-3:分别为3组不同批次的4hpf斑马鱼胚胎蛋白Notes: M:protein marker; 4h-1,4h-2,4h-3 are 3 different groups of Danio rerio 4hpf embryos, respectively

图3 鉴定肽段数量分布图Fig.3 Peptide count distribution
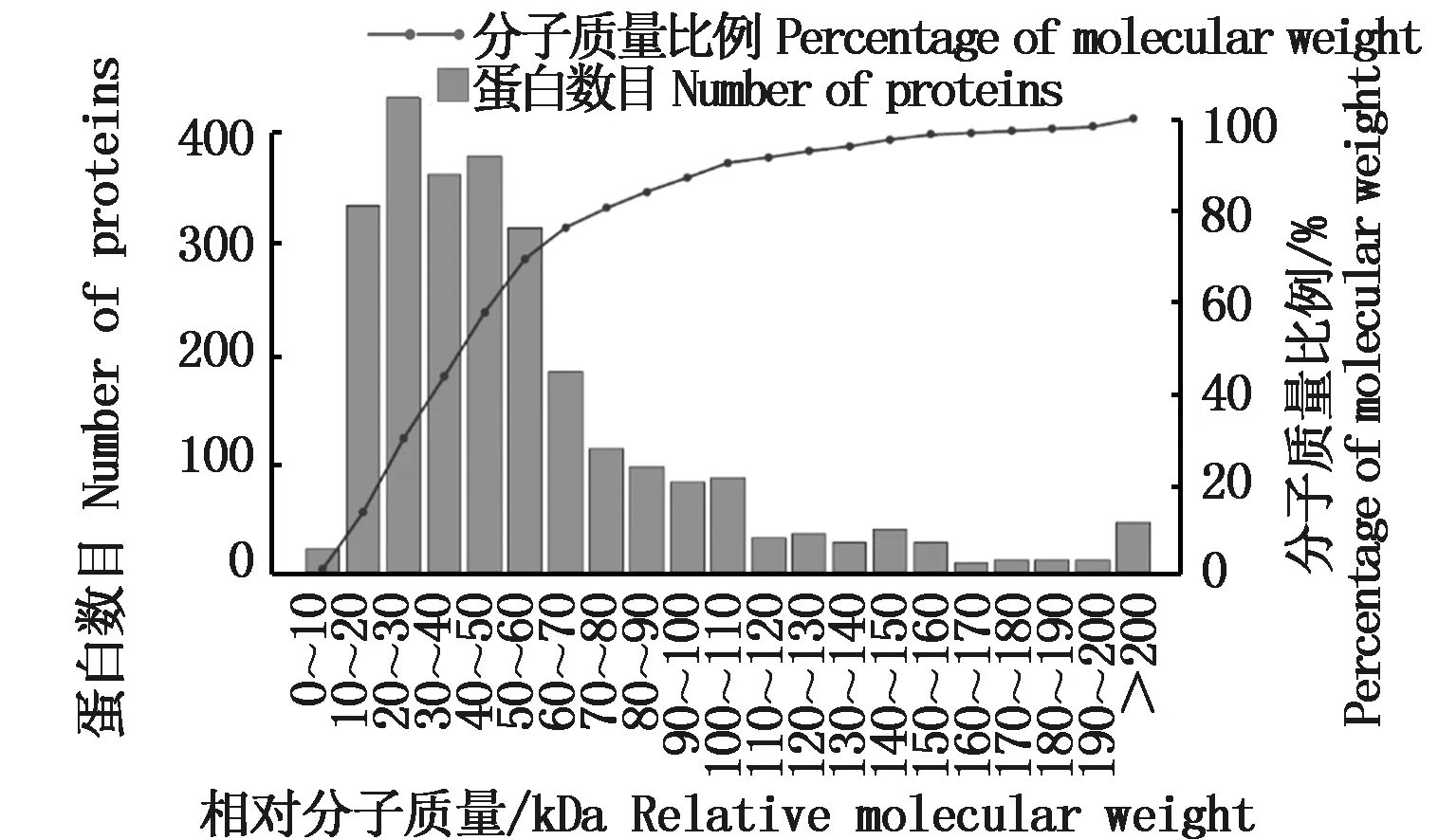
图4 鉴定蛋白质相对分子质量分布图Fig.4 Relative molecular weight distribution of protein

图5 鉴定蛋白质等电点分布图Fig.5 Isoelectric point distribution of protein
本研究对检测到的所有蛋白进行了相对平均表达量的测定。定量结果发现,金属结合蛋白、转移酶类、水解酶类的表达量较低;而卵黄蛋白原、热休克蛋白、肌动蛋白和微管蛋白则具有明显的高表达(表2)。实验结果表明,iTRAQ标记方法对胚胎中低丰度蛋白也有良好的检测效果。经分析,胚胎中高表达的蛋白质对于维持胚胎的正常营养供应、细胞运动、能量代谢十分重要。另外,在鉴定出的蛋白中有426个未知蛋白,在数据库中没有相应的注释,其中20个蛋白具有显著的高表达,初步推测这些未知蛋白在胚胎发育4hpf时期具有重要的功能,但其具体功能有待进一步的研究。
2.4 蛋白功能的注释分析
研究进一步通过生物信息分析的方法对鉴定出的蛋白进行功能注释分析。对检测到的蛋白分别进行了GO 注释(图6)、COG 注释(图7)。这些蛋白分别注释到了3类总共48个不同的GO term上。共有769个蛋白与生物过程(biological process)的功能相关,分析中可以看出在斑马鱼4hpf发育阶段表达量较高的蛋白参与较多的生物过程分别是细胞代谢、刺激应答、单一生物体过程、生物调节、细胞进程以及发育过程(图6-A)。经分析有673个蛋白具有细胞组成(cellar component)功能,在该阶段胚胎中,参与细胞组成的主要蛋白类型为大分子复合物、细胞器组成蛋白、细胞成分蛋白以及细胞膜组成蛋白(图6-B)。912个蛋白质注释到分子功能(molecular function)上,蛋白参与数目较多的分子功能分别为催化活性、结合活性、分子结构形成活性和分子转运活性(图6-C)。 COG(cluster of orthologous groups of proteins, 蛋白相邻类的聚簇)是对蛋白质进行直系同源分类的数据库。在COG注释分析中发现,其中参与细胞信息存储处理的蛋白有119种,其中最显著的是蛋白翻译、核糖体结构与生物合成功能;参与细胞代谢过程的有107种,主要与碳水和脂质代谢相关;参与细胞进程与信号传导的有183种,大多数为翻译后修饰与分子伴侣相关蛋白。
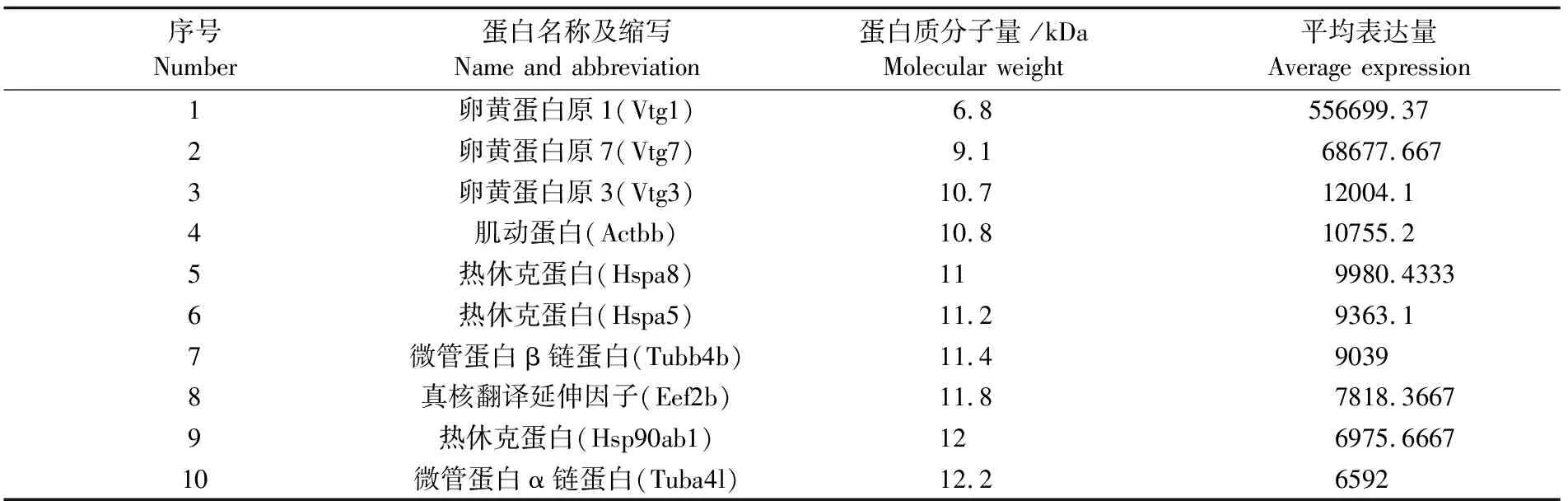
表2 斑马鱼4hpf时期胚胎高表达蛋白质Tab.2 High expression proteins in 4hpf stage of Danio rerio embryo
对鉴定出蛋白进行KEGG Pathway代谢通路注释,发现这些蛋白所涉及到的Pathway多达129条,其中富集蛋白数目在10个以上的有30条(图8)。参与蛋白最多的是核糖体相关通路,其次还有碳代谢、剪接体相关通路、细胞内吞作用、氧化磷酸化、RNA转运、氨基酸的生物合成与降解、细胞骨架调节相关通路等。
3 讨论
在斑马鱼早期胚胎发育过程中蛋白质的含量和蛋白质水平的调控对于胚胎的正常发育进程十分关键。蛋白质组能够直观的反映特定时期内的胚胎中基因和其它相关调控因子在决定胚胎表型和细胞的分化命运时发挥功能的情况。
斑马鱼的胚胎发育的囊胚阶段(2.25~4.66 hpf)[25],胚胎在形态上和分子水平上都发生复杂的变化。在基因层面,囊胚中期,胚胎经历母型-合子型转换(MZT)过程,大量合子型基因表达并伴随着母源mRNA降解[26];在细胞层面,囊胚晚期胚胎细胞进行着快于任何发育阶段的细胞重排和细胞运动,继而动物极下包,进入原肠胚阶段。斑马鱼胚胎发育的4 hpf时期(sphere),是介于囊胚和外包两个时期之间的过渡时期,胚胎刚刚由母源型调控转为合子型调控,开始了大量的基因转录活动,该时期积累的蛋白质以及它们的调控作用影响了胚胎发育后续的外包(epiboly)阶段。
本研究采用iTRAQ标记与LC-MS/MS串联质谱技术,在斑马鱼早期胚胎发育4 hpf时期的胚胎中共鉴定到1 178种蛋白质,这些蛋白质广泛的参与到细胞中的物质合成与代谢、细胞信号传递、细胞运动和细胞骨架、细胞增殖及其调控、细胞分化与转录调控等各项生命活动过程。尽管目前对斑马鱼早期各个阶段的转录组均有比较详尽的分析和研究,但是关于斑马鱼早期胚胎发育的蛋白组学研究仍然较少且研究的发育时期并不完全。TAY等[27]对斑马鱼早期发育6~72 hpf中的10个不同时期进行蛋白质组研究,通过双向电泳进行检测,发现大量的蛋白质表达量随着发育时长变长而增加,同时对这些蛋白进行定性并鉴定到了108个已知蛋白。斑马鱼单胚胎的蛋白质组研究中,在斑马鱼3hpf去卵黄和未去卵黄胚胎中分别鉴定到499种和260种蛋白,在5hpf未去卵黄胚胎中鉴定到212种蛋白[28]。斑马鱼早期发育4hpf的胚胎蛋白组目前还没有相关研究报道。在本研究中,利用高灵敏的iTRAQ标记结合质谱分析,在4hpf时期斑马鱼胚胎中鉴定到了更大数量的蛋白质,包括已有报道的卵黄蛋白原(vitellogenin);热休克蛋白heat shock protein 5,heat shock protein HSP 90-beta,heat shock cognate 71 kDa protein等;分子伴侣蛋白chaperonin containing TCP1 subunit 2 (Beta),chaperonin containing TCP1, subunit 7 (Eta)等;细胞骨架蛋白actinin alpha 4,tubulin alpha chain等翻译功能蛋白ribosomal protein,translation initiation factor 4A等[17,22-23],以及之前的蛋白组学研究中未能鉴定出的一些低表达的蛋白质如Ndufa9、RhoA-C、Pgam5、Deltex1等。在本研究中对斑马鱼胚胎发育4hpf时期的蛋白质组进行了大范围的定性和定量检测,得到了更大数据量且更准确的斑马鱼胚胎蛋白组信息。进一步研究这一关键时期中这些蛋白的功能将有助于更深入的了解斑马鱼早期胚胎发育的分子调控机制起到重要的作用。检测结果分析还发现有8个预测的新结构蛋白,类似SNRPD2 结构蛋白、类似ENDOD1结构蛋白、含有SNF2家族 N端和解旋酶(helicase)保守C端结构域蛋白、透明带蛋白样结构域(zona pellucida-like)蛋白。除此之外还有426个,占检测蛋白总数36.16%的蛋白被注释为未知蛋白,这些蛋白可能在斑马鱼早期发育过程中起到重要作用但是具体功能仍有待研究。

图6 斑马鱼4hpf时期表达蛋白GO注释分析Fig.6 GO annotation and analysis of protein in 4hpf embryo注:a:生物过程相关蛋白GO注释;b:细胞组成相关蛋白质GO注释;c:分子功能相关蛋白质GO注释Notes: a: GO annotation of biological process; b: GO annotation of cellar component; c: GO annotation of molecular function
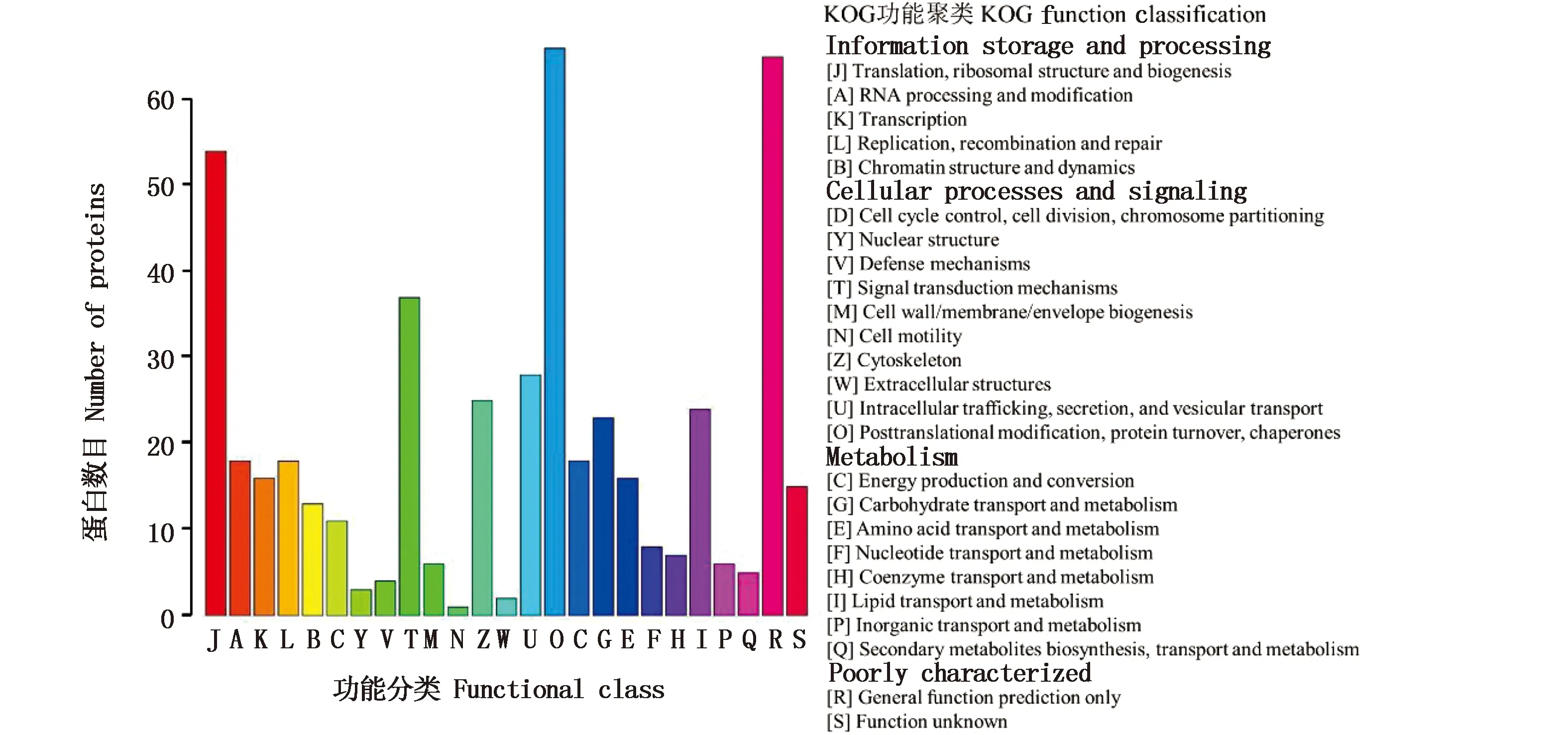
图7 斑马鱼4 hpf时期表达蛋白COG注释Fig.7 COG annotation and analysis of protein at 4hpf stage of embryo

图8 斑马鱼4hpf时期表达蛋白KEGG通路分析Fig.8 KEGG pathway analysis of protein in 4hpf embryo
在本研究中,经检测发现卵黄蛋白原 (vitellogenin, Vtgs)是斑马鱼4hpf时期胚胎中表达量最高的蛋白,同时卵黄蛋白也是斑马鱼从卵子到胚胎发育中持续表达最丰富的蛋白。目前已知在斑马鱼基因组上有7种Vtgs基因,分别为Vtg1~Vtg7,位于基因组的不同的位置上[29]。在斑马鱼中,Vtg大多在肝脏中合成,而在卵巢中也有少量Vtg mRNA的表达,在斑马鱼卵母细胞成熟的过程中,卵黄蛋白原Vtgs最早开始在Ⅱ期表达并迅速在卵子中累积,卵黄蛋白持续表达,直到卵母细胞成熟[29]。在关于斑马鱼卵母细胞成熟过程的蛋白质组学动态研究中,卵黄蛋白Vtgs在斑马鱼早期卵母细胞成熟过程中高表达,研究鉴定到包括Vtg1、Vtg3、Vtg4和Vtg7在卵母细胞成熟的各个阶段表达呈现大幅增加趋势,其中Vtg3在卵母细胞最终成熟阶段上升了5倍[17]。在本研究中发现在斑马鱼4hpf的胚胎中,卵黄蛋白原Vtg1、Vtg2、Vtg3、Vtg7的表达量是检测到的蛋白中表达量最高的4种蛋白,这个结果与先前的斑马鱼卵母细胞蛋白组学研究结果一致,故而认为在斑马鱼的早期胚胎发育过程中,卵黄蛋白由母源卵子提供,在胚胎的合子发育过程中起到了重要的作用,为早期胚胎的发育提供营养物质。
通过对鉴定到的蛋白进行GO注释和KEGG通路分析,发现斑马鱼早期胚胎发育4 hpf时期表达的蛋白广泛参与了许多重要的生物过程。包括对胚胎发育至关重要的信号传导相关通路,如Wnt信号通路、Hedgehog信号通路和TGF-β信号通路;细胞增殖分化及细胞凋亡相关的信号通路,如:P53信号通路、Notch信号通路、NOD-like receptor信号通路等;以及涉及细胞间相互作用和信号传递相关的通路,如:MAPK信号通路、紧密连接、黏着斑连接等。
斑马鱼早期胚胎发育的囊胚过渡和外包过程中,细胞骨架和细胞间的粘连发挥了重要作用,破坏细胞骨架和细胞粘连[30],阻断MAPK信号通路[31],均导致胚胎在外包前发育异常和阻滞。
KEGG通路分析发现4hpf时期表达大量的核糖体组成以及翻译相关蛋白质,说明了核糖体功能和翻译过程在该时期的重要性。核糖体的生物合成过程在细胞中占据实质性的细胞资源,因此它也紧密协调着细胞中的营养效率[32]。在斑马鱼的早期胚胎卵裂增殖阶段,胚胎细胞快速分裂需要大量能量供应新的蛋白合成并且积累物质为下一次分裂做准备,尤其在囊胚时期,细胞开始运动、分化并形成胚层,胚胎细胞的正常生物合成与细胞间的信息传递是保证胚胎正常发育和外包的重要条件。
综上所述,通过iTRAQ标记联合LC-MS/MS的方法可以对4hpf时期的斑马鱼胚胎中的蛋白质组进行有效的分离和鉴定,该技术为研究斑马鱼的早期胚胎发育过程中蛋白质组学提供了高效、可行的研究方法,也为进一步研究斑马鱼的发育过程的调控机制提供了新的研究方向。本研究利用iTRAQ标记建立了斑马鱼早期发育关键阶段sphere时期的蛋白质组表达图谱,为后续研究斑马鱼早期胚胎在发育过程中的蛋白组学研究提供参考和奠定基础。在后期的研究工作中需进一步对4hpf时期前后的蛋白组表达情况进行检测,通过比较分析各个时期的斑马鱼胚胎中蛋白质组的差异变化找出在斑马鱼胚胎发育特定时期发挥关键功能的蛋白,这对研究斑马鱼早期胚胎发育的调控过程具有重要意义。
4 小结
本研究通过iTRAQ蛋白质质谱分析技术对4hpf时期的斑马鱼胚胎中的蛋白质组进行有效的分离和鉴定,检测了斑马鱼早期胚胎发育过程中囊胚sphere时期的蛋白质表达情况,对该时期表达的蛋白质进行定性和定量的鉴定,并分析该时期表达的蛋白质的相应功能和参与调控的生物过程。检测结果共鉴定到的总蛋白数为1 178个,利用生物信息学进行功能分析,发现这些蛋白广泛参与了细胞信号传递、细胞运动和细胞骨架构建、细胞增殖、细胞分化、物质合成与代谢等各项重要的生命活动过程。

