α-突触核蛋白寡聚体经氧化应激途径致帕金森病小鼠模型多巴胺能神经元损伤
洪梅,黄梦阳,江红,康慧聪,许峰,刘晓艳,龚权,胡琦,张存泰,朱遂强
帕金森病(Parkinson disease,PD)是常见的神经变性疾病,全球发病率达0.3%左右[1],临床症状包括静止性震颤、肌僵直、运动迟缓和姿势平衡障碍等[2],病理改变主要是中脑黑质致密部含黑色素的多巴胺能神经元(dopaminergic neuron,DN)变性、缺失及残存神经元内以α-突触核蛋白(α-Synuclein,α-Syn)为主要成分的路易小体形成[3]。α-Syn是一种主要位于突触前末梢的酸性蛋白,在游离状态下其单体呈无序的未折叠结构,与生物膜结合时则表现为α-螺旋结构,当表达增加或变异时,可转变为淀粉纤维样的β-折叠结构,形成寡聚体和多聚体[4,5]。目前认为α-Syn寡聚体毒性是导致DN变性、缺失的重要原因,但具体生物学机制仍不清楚。本研究拟经鱼藤酮持续灌胃构建PD小鼠模型,初步探讨α-Syn寡聚体导致DN变性缺失的可能生物学机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 12月龄清洁级健康雄性C57BL/6小鼠,体质量约28 g,由武汉大学动物实验中心提供,许可证号SCXK(鄂)2008-0004。
1.1.2 主要试剂与材料 鱼藤酮购自美国Sigma公司;氯仿购自天津市化学试剂公司;羧甲基纤维素购自上海KaYon生物科技有限公司;BCA试剂盒购自Thermo Fisher Scientific公司;兔抗小鼠α-Syn、β-actin抗体均购自美国Santa Cruz公司;DAB、Mayor’s苏木素均购自武汉博士德生物公司;兔抗小鼠酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体购自美国Chemicon公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、丙二醛(maleic dialdehyde,MDA)试剂盒购自南京建成生物工程研究所。鱼藤酮溶液的配制:将鱼藤酮粉末溶于12.5%氯仿,配制成50 mg/mL鱼藤酮溶液,20℃避光保存;灌胃时再将鱼藤酮氯仿溶液与2%羧甲基纤维素溶液搅拌混匀,小鼠鱼藤酮灌胃剂量为5 mg/kg,溶液体积为0.01 mL/g。同时,将氯仿、2%羧甲基纤维素按上述比例配制成空白对照溶液。
1.2 方法
1.2.1 灌胃处理 取小鼠48只,随机分为对照组和鱼藤酮组,每组各24只(实验过程中如有小鼠死亡,则根据死亡数量补齐)。鱼藤酮组灌注0.01 mL/g鱼藤酮氯仿溶液,对照组则灌注0.01 mL/g的空白对照溶液,灌胃5 d/周,休息2 d,均连续灌胃12周。
1.2.2 Western blotting检测α-Syn表达水平 于灌胃12周后,各组取小鼠6只,麻醉后断头取中脑,提取蛋白,采用BCA法测定蛋白的含量。以SDS-PAGE凝胶电泳分离蛋白。实验结果以α-Syn与β-actin条带灰度的比值表示α-Syn相对表达水平。
1.2.3 免疫组织化学染色 于灌胃前、灌胃12周后,各组取小鼠4只,麻醉后断头取中脑,常规法制作石蜡切片,切片脱蜡,置PBS中加热煮沸15 min修复抗原,3%H2O2孵育10 min以耗竭内源性过氧化物酶,1%BSA封闭30 min,去除封闭液,加入抗TH一抗抗体(1∶1 000)4℃过夜,PBS漂洗5 min×3次,加入二抗37℃孵育30 min,DAB显色,苏木素复染1~2 min,梯度酒精脱水,二甲苯透明中性树脂封片,显微镜下观察,每个标本选5张连续切片观察黑质部分。每张切片先在低倍镜下选取TH阳性细胞密集区,再在高倍镜下随机选取10个视野,进行阳性细胞数,计算出平均值。
1.2.4 电镜观察 灌胃12周后,各组取小鼠2只,灌注固定后取黑质约0.5 mm3,2.5%戊二醛、1%锇酸铅双重固定,脱水,Epon812包埋,LKB-Ⅲ切片机超薄切片,醋酸铀硝酸铅双重染色,IEM-1200EX透射电镜观察。
1.2.5 氧化应激水平的测定 灌胃前及灌胃12周后,各组取小鼠4只,麻醉后断头取中脑,匀浆,采用BCA法测定蛋白的含量,SOD的测定采用水溶性四唑盐(WST-1)法,GSH-PX的测定采用比色法,MDA测定采用硫代巴比妥酸(TBA)法,具体操作按南京建成生物工程研究所试剂盒说明书进行。
1.3 统计学处理
采用SPSS 17.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验;P<0.05为差异有统计学意义。
2 结果
2.1 中脑黑质α-Syn表达水平比较
Western blotting检测结果显示,灌胃12周后,鱼藤酮组中脑黑质处α-Syn单体和α-Syn寡聚体的表达量均较对照组明显增多(P<0.05及P<0.01),见图1。
2.2 中脑黑质TH阳性细胞数比较
灌胃前,鱼藤酮组和对照组小鼠中脑黑质处TH阳性细胞数分别为(25.15±1.63)个和(24.70±1.69)个,差异无统计学意义(P=0.397)。灌胃12周后,鱼藤酮组和对照组小鼠中脑黑质处TH阳性细胞数分别为(20.90±1.62)和(22.9±2.17),鱼藤酮组较对照组明显减少,差异有统计学意义(P=0.002),见图2。
2.3 电镜结果
灌胃12周后,对照组黑质部胞内细胞器未见明显肿胀,而鱼藤酮组小鼠黑质部胞内线粒体、高尔基体均可见明显不规则肿胀,见图3。
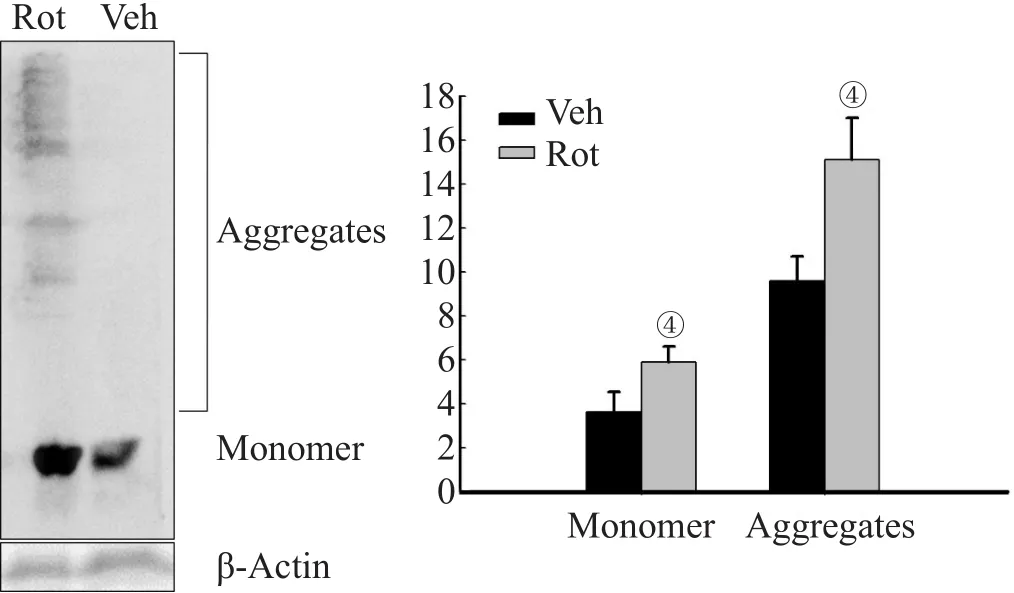
注:灌胃12周后,鱼藤酮组小鼠中脑黑质α-Syn单体及寡聚体的表达较对照组增多。Rot:鱼藤酮组;Veh:对照组;Aggregates:寡聚体;Monomer:单体;④P<0.05,④P<0.01
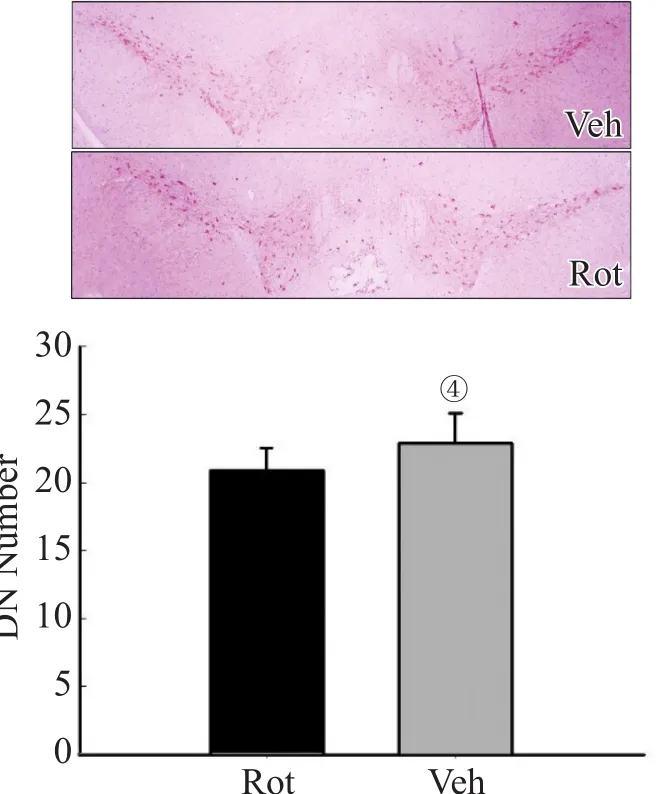
图2 中脑黑质TH阳性细胞数比较(免疫组化,×40)

图3 灌胃12周2组小鼠中脑黑质超微病理(×5000)
2.4 氧化应激水平
灌胃前,2组双侧黑质SOD、MDA、GSH-PX水平差异无统计学意义(P>0.05)。灌胃12周后,鱼藤酮组双侧黑质SOD、GSH-PX水平低于对照组(P<0.05),MDA水平高于对照组(P<0.05),见表1。
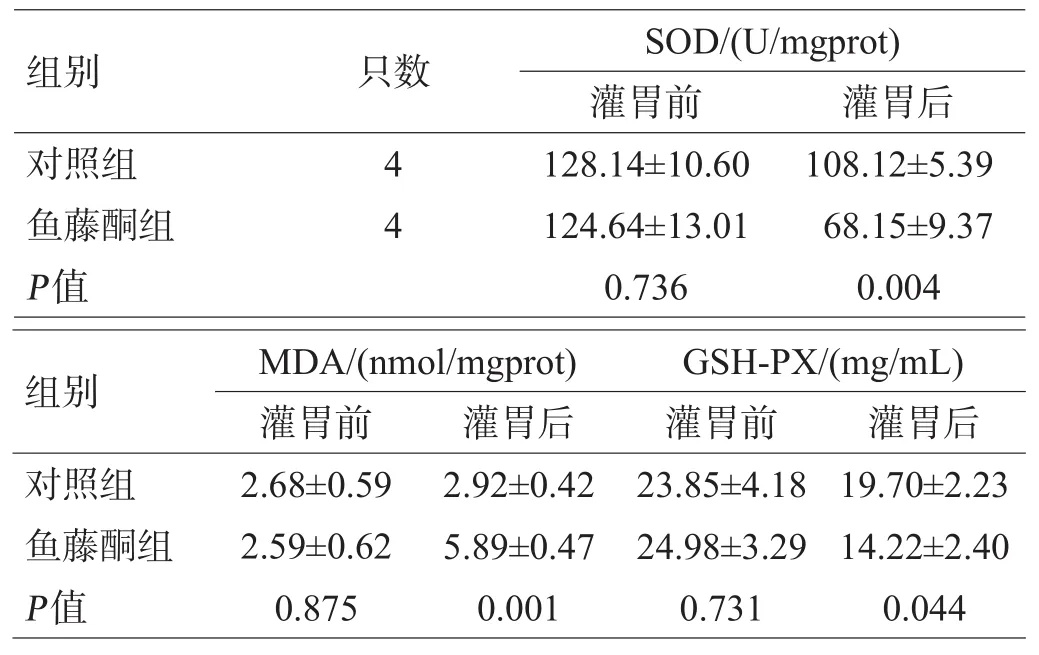
表1 2组小鼠中脑SOD、MDA、GSH-PX表达水平比较(x±s)
3 讨论
PD的经典病理改变为中脑DN变性缺失,目前认为α-Syn异常聚集的寡聚体具有细胞毒性,是导致DN变性缺失的主要原因[4,5],但具体生物学机制仍不清楚。
既往缺乏理想的PD动物模型用于研究α-Syn寡聚体的毒性作用机制。如经皮下注射6-羟基多巴[6]构造的PD大鼠模型虽有行为学改变,但不能在体内形成α-Syn寡聚体。皮下或脑内注射鱼藤酮[7]虽可形成α-Syn寡聚体,但鱼藤酮本身也可直接损伤系统性线粒体复合酶I、诱导神经元凋亡等,导致在此模型体内难以区分α-Syn寡聚体与鱼藤酮的细胞毒性作用。近年采用低剂量鱼藤酮持续灌胃老年小鼠的方法制备出慢性PD模型,发现神经元缺失、α-Syn寡聚体沉积等病理改变由胃肠道神经丛逐渐散播至中脑黑质。模型小鼠脑和血液内鱼藤酮滴度、线粒体复合酶I活性未发现显著性改变[8]。而截断连接脑干和胃肠道的迷走神经干后,再对小鼠采取鱼藤酮持续灌胃处理,则小鼠中脑内未再出现上述病理改变[9]。该模型的生物学机制很可能是肠壁神经丛内形成的α-Syn寡聚体经类朊蛋白途径沿神经传导通路缓慢播散至中脑所致[10],而非鱼藤酮直接损伤DN。因此,此模型是研究α-Syn寡聚体细胞毒性机制的理想动物模型。
本课题组使用C57老年小鼠持续鱼藤酮灌胃构造上述模型,灌胃12周后免疫组化染色结果显示中脑DN明显减少,行为学检测也有显著性改变,证实该PD小鼠模型构造成功[11]。Western blotting结果显示中脑α-Syn寡聚体显著性增加,而寡聚体是α-Syn异常聚集体中的主要毒性成分[12,13]。本研究还发现中脑内SOD、GSH-PX浓度显著降低,MDA显著增多,提示细胞内活性氧物质增加,超氧阴离子自由基的清除能力明显下降,透射电镜也发现黑质部线粒体、高尔基体等均出现不规则肿胀,以上结果提示α-Syn寡聚体有可能通过氧化应激途径导致DN的损伤。Parihar等[14]将从大鼠神经元内先分离出来的线粒体孵育在含有α-Syn寡聚体的溶液中30 min,再采用免疫荧光显像发现α-Syn寡聚体可进入线粒体内,并导致胞内活性氧物质含量和蛋白质酪氨酸硝化水平升高。而Devi等[15]采用蛋白质印迹技术发现PD患者黑质纹状体神经元内线粒体内存在明显α-Syn沉积,且使线粒体复合酶I亚基活性显著降低。因此,α-Syn寡聚体可能通过抑制线粒体复合酶I活性而导致线粒体功能障碍、活性氧物质产生增加,经氧化应激途径导致DN损伤。
研究还发现α-Syn寡聚体可通过其他途径对神经元产生毒性作用。首先,α-Syn多聚体可通过TLR4受体活化神经元周围的胶质细胞[16],活化的胶质细胞上调胞内NADPH氧化酶和诱导型一氧化氮合酶的表达,释放过氧化物、一氧化氮至胞外,进而加重DN损伤[17]。其次,α-Syn聚集物还可结合Tau蛋白,促进Tau蛋白聚集,抑制微管蛋白合成,改变细胞骨架从而导致神经元损伤[18]。再次,α-Syn寡聚体还可在细胞膜上形成跨膜小孔,破坏细胞膜的完整而发挥其毒性作用[19]。最后,α-Syn寡聚体可损伤泛素-蛋白酶体系统或/和自噬-溶酶体途径,致使清除异常蛋白作用下降,进一步加重α-Syn异常聚集,最后导致神经元死亡[20]。
综上所述,经低剂量鱼藤酮持续灌胃老年小鼠可导致中脑内出现α-Syn增多及DN减少缺失,α-Syn寡聚体有可能通过氧化应激途径对DN产生细胞毒性,但详细的生物学机制还需进一步深入研究。

