布比卡因致心肌细胞线粒体损伤大鼠模型的建立
张颖颖,段然,陈永学,赵森明,夏登云*
(1. 河北北方学院附属第一医院麻醉科,河北 张家口 075000; 2. 河北省人民医院麻醉科,石家庄 050000;3. 邯郸市中心医院麻醉科,河北 邯郸 056300; 4. 河北医科大学第三医院,石家庄 050000)
局部麻醉是临床常用的麻醉方法,但是局部麻醉药布比卡因误入血管或过量使用可能会引起严重的心脏毒性反应,造成心脏自律性、传导功能及收缩功能的抑制,对收缩功能的抑制尤为明显,临床表现为心动过缓、低血压,严重时甚至会发生室性心律失常及心脏停搏[1-2]。Hiller等[3]研究发现布比卡因可在心肌组织中蓄积,并诱导线粒体肿胀,进而抑制线粒体能量代谢。但是,由于近年来很多药物对心肌细胞影响的研究都在使用未分化的H9c2细胞,而该细胞并不具有节律性收缩能力。本研究组认为,使用不具备节律性收缩功能的细胞进行研究会引起实验结果与原发性心肌细胞不相符的问题,这在心脏毒性研究中尤其重要。本研究旨在建立一种理想的模拟临床状态下布比卡因中毒的心肌细胞线粒体损伤模型,以便于心脏毒性相关实验研究的进行。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雄性Sprague-Dawley(SD)大鼠10只,体重180 ~ 220 g,由河北医科大学动物实验中心提供【SCXK(冀)2017-003】,于动物室饲养,提供适当光照,室内温度为20~24℃,自由饮食水。实验于河北医科大学药理研究室进行【SYXK(冀)2017-003】。
1.1.2 仪器与器械
实验所用仪器:Langendorff灌流装置、Hitachi H-7500透射电子显微镜、台式高速冷冻离心机、超级恒温水浴箱、恒流泵 (HL-2)、充氧机、加热磁力搅拌器(EMS-9 A)等。实验用手术器械:眼科剪、眼科镊、组织剪、组织镊、5 mL注射器、不锈钢点胶针头、外科缝合线等。
1.2 方法
1.2.1 原代心肌细胞分离
参照Gorelik等[4]分离原代心肌细胞的方法并加以改良。腹腔注射肝素1000 U/kg抗凝20 min,然后用25%乌拉坦腹腔注射麻醉大鼠,75%乙醇消毒胸腹部后,迅速把心脏剪下来,置于0℃、氧饱和的无钙台式液中冲洗血液后,将心脏挂在Langendroff灌流装置上,使用恒流蠕动泵以6 mL/min的速度灌流无钙台式液和II型胶原酶液。消化时间在15 min左右,观察II型胶原酶液变粘稠,且手触心脏其表层变软则结束消化过程。取下消化好的心脏放到KB液中,剪刀剪碎后用吸管轻柔地反复吹打。静置10 min,待细胞自然沉降后吸走上清液并换上新的KB液,以充分去除II型胶原酶。
1.2.2 细胞计数
将计数板及盖玻片擦拭干净,并将盖玻片盖在计数板上。轻轻吹打细胞悬液,使细胞均匀分布。吸出少许细胞悬液滴在细胞入口,使细胞悬液充满盖玻片和计数板之间,静置1 ~ 2 min,使细胞沉降。注意盖玻片下不要有气泡,也避免细胞悬液进入旁边的槽中。在显微镜下对A/B/C/D四个大格内的细胞进行计数,压在大格四周边线上的细胞只计数压在2条边线上的细胞。按公式计数细胞数量:细胞数/mL=四个大格内细胞总数 × 104/4(每一个大格的体积为长1 mm × 宽1 mm × 高0.1 mm=0.1 mm3,1 mL=1000 mm3,因此计算时需×104。
1.2.3 电镜下线粒体形态
收集静置待用的心肌细胞,待心肌细胞自然沉淀后移去上清液,加入含钙的细胞培养液DMEM,用吸管轻柔吹匀,移至2 mL doff管中,每管中细胞数约为1×105个。将doff管中细胞随机分为四组:DMEM静置组、DMEM电刺激组、布比卡因静置组、布比卡因电刺激组。其中布比卡因浓度为13.3 μmol/mL,处理10 min。电刺激组的doff管中放入电极,在1 Hz,4 ms波宽,幅度为15 V的设置下进行电场刺激,时间为90 s,心肌细胞可在电场刺激下产生良好收缩。非电刺激组只放入电极但并不进行电场刺激。将doff管置于离心机内设置转速为1000 r/min,离心时间10 min。移出上清液,加2.5% 浓度的戊二醛固定,4℃保存过夜。用1/15 mol/L磷酸盐缓冲盐水溶液(phosphate buffered saline, PBS)浸洗三次以上。1% 锇酸固定1 ~ 2 h。1/15 mol/L PBS浸洗两次,每次20 min;丙酮逐级脱水,50%、70%、80%、90%、100%(2次),每次10 ~ 15 min。包埋剂浸透与包埋。聚合及制备超薄切片。用醋酸双氧铀和醋酸铅双重颜色法对切片进行染色;电镜样本制作完成后,用透射电镜对其进行超微结构观察并采集样片。评估线粒体的方法根据Joshi等[5],将损伤程度从0 ~ 5评分。0=正常;1=内质网肿胀,线粒体最小程度肿胀;2=轻度线粒体肿胀;3=中度线粒体肿胀;4=重度线粒体肿胀,细胞膜破坏;5=最重度线粒体肿胀和钙化(图1)。

注:0=正常;1=线粒体最轻程度肿胀;2=轻度线粒体肿胀;3=中度线粒体肿胀;4=重度线粒体肿胀,细胞膜破坏;5=最重度线粒体肿胀和钙化。图1 不同损伤程度的线粒体评分(×15 000)Note. 0=Normal; 1=Minimal mitochondrial swelling; 2=Mild mitochondrial swelling; 3=Moderate mitochondrial swelling; 4=Severe mitochondrial swelling, cell membrane damage; 5=The most severe mitochondrial swelling and calcification.Figure 1 Mitochondrial scores for different degrees of injury(×15 000)
1.2.4 ROS生成量检测
收集静置待用的心肌细胞,装载探针。按1∶1000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。将盛细胞的离心管静置15 min,移走上清液,把稀释好的DCFH-DA倒入离心管中,使细胞悬浮于稀释好的DCFH-DA中,细胞浓度在1×106~ 1×107之间。将离心管放入37℃的细胞培养箱中孵育20 min,每隔3 ~ 5 min将离心管轻柔摇晃混匀,使加入的探针能够与细胞充分接触。然后用37℃的细胞培养液DMEM 清洗细胞三次,充分去除未进入细胞内的DCFH-DA,减少探针干扰。将装载好探针的细胞混匀后用移液器移至2 mL doff管中,分组加药电刺激同上。将doff管里细胞用移液器均匀吹散后分别移到酶标板中,将其放入多功能微孔板检测仪,设置激发波长488 nm,发射波长525 nm,检测ROS生成量。
1.3 统计学方法
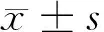
2 结果
新鲜分离心肌细胞模型工作状态良好,电刺激下心肌细胞呈节律性收缩。
2.1 透射电镜下线粒体形态
对约500个线粒体依据Joshi等[5]的评分方法进行线粒体评分(见图1),并对评分结果进行统计学分析得出,DMEM电刺激组与非电刺激组比较,Wilcoxon W统计量为275151.5,Z=-1.94,双侧检验P> 0.05,认为DMEM电刺激组线粒体肿胀程度与非电刺激组相比无明显形态上差异,可见线粒体水肿不明显(见图2A)或轻微的线粒体肿胀(见图2B)。图2C为线粒体肿胀评分。
布比卡因电刺激组与非电刺激组比较,WilcoxonW统计量为133138.0,Z=-5.09,双侧检验P=0.000,认为布比卡因电刺激组线粒体评分明显高于布比卡因非电刺激组,可见局限性轻、中度线粒体肿胀(见图3A)或弥漫性线粒体肿胀,局灶性中、重度肿胀,并可见嵴部分融合(见图3B)。图3C为线粒体肿胀评分。
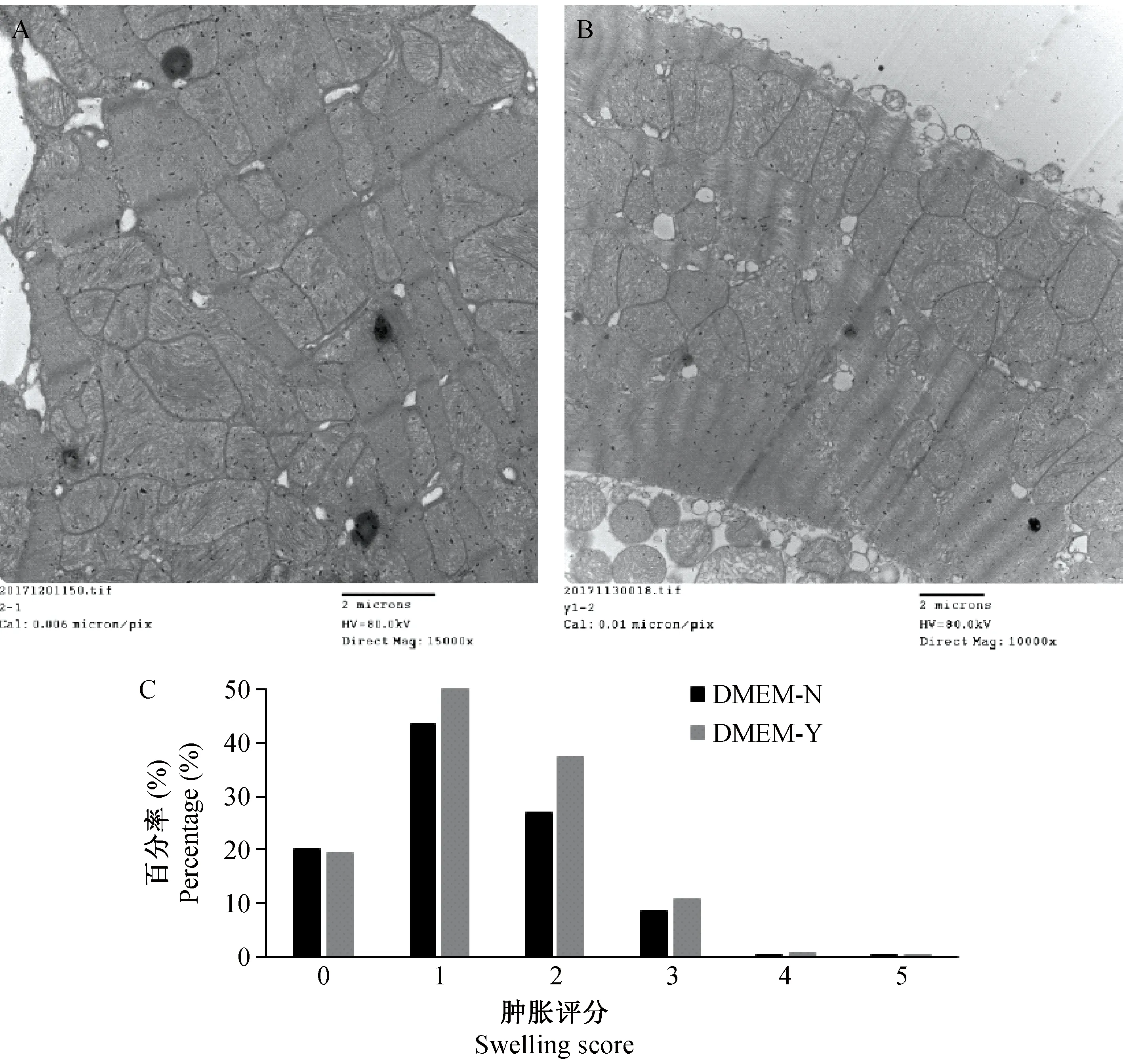
注:A.DMEM非电刺激组;B.DMEM电刺激组(×15 000);C.线粒体肿胀评分。图2 透射电镜下电刺激与非电刺激DMEM组线粒体形态变化及评分Note. A is DMEM without electrical stimulation group. B is DMEM with electrical stimulation group(×15 000). C. Mitochondrial swelling scores.Figure 2 Morphological changes and scores of mitochondria under transmission electron microscope after DMEM electrical stimulation and non-electrical stimulation
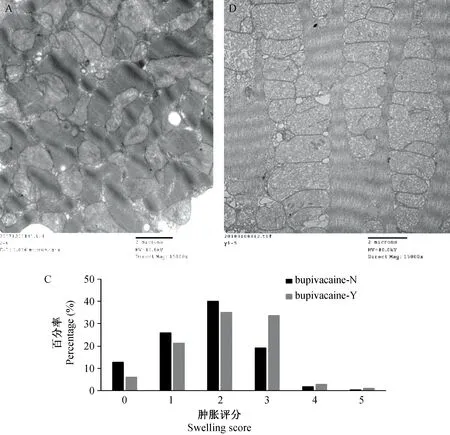
注:A.布比卡因非电刺激组;B.布比卡因电刺激组(×15 000);C.线粒体肿胀评分。图3 透射电镜下电刺激与非电刺激布比卡因组线粒体形态变化及评分Note. A. is bupivacaine without electrical stimulation. B. is bupivacaine plus electrical stimulation. C. Mitochondrial swelling scores.Figure 3 Morphological changes and scores of mitochondria under transmission electron microscope after bupivacaine plus electrical stimulation and non-electrical stimulation
2.2 ROS生成量结果
电刺激DMEM组线粒体内ROS生成量为(3929.67 ± 560.93),非电刺激组线粒体内ROS生成量为(3819.25 ± 494.13),结果差异无显著性(P> 0.05);而电刺激布比卡因组线粒体内ROS生成量为(4697.58 ± 762.3),较未电刺激布比卡因组(4285.75 ± 635.67)明显增高(P< 0.05)(图4)。
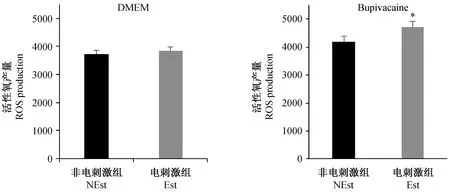
注:DMEM组中,NEst(non-electrical stimulation, 非电刺激组)与ESt(electrical stimulation, 电刺激组)相比,P > 0.05;布比卡因组中,NEst与ESt相比,P < 0.05。图4 电刺激与非电刺激下ROS生成量的比较Note. NEst in the DMEM group, compared with Est, P > 0.05. NEst in the bupivacaine group, compared with ESt, P < 0.05.Figure 4 Comparison of ROS production under electrical stimulation and non-electrical stimulation
3 讨论
本研究结果显示,新鲜分离的心肌细胞工作状态良好,电刺激下心肌细胞呈节律性收缩;保存在DMEM中的心肌细胞电刺激并不会对其线粒体形态及ROS生成量产生影响,而电刺激布比卡因中毒的心肌细胞其线粒体肿胀程度及ROS生成量均较未电刺激组高。这表明,电刺激心肌细胞使之恢复节律性搏动能更好地模拟临床布比卡因中毒时心肌线粒体损伤。
线粒体是真核细胞中重要的细胞器,它不但可以通过氧化磷酸化为细胞提供能量,而且在维持胞质钙稳态、渗透调节、pH控制以及细胞凋亡的调控中也起重要作用,同时还是细胞内ROS最主要产生场所,也是ROS攻击的敏感目标。
生理状态下,绝大部分的ROS是细胞内线粒体代谢产生的,其在生物体内发挥着重要的作用[6]。而ROS的大量生成则会对人体产生有害的病理改变,如可触发细胞内的氧化应激反应(oxidative stress,OS),直接作用于人体的蛋白质、脂类和DNA,干扰DNA复制,使蛋白质丧失正常的催化和降解功能,并对其造成氧化损伤(oxidative damage)。任何细胞内ROS水平的改变,都有可能导致细胞内部活性的变化。
本实验组前期证明,布比卡因主要抑制心肌细胞的收缩功能。其机制可能是布比卡因抑制心肌细胞线粒体能量代谢,阻滞心肌细胞钠、钾、钙通道,引起心肌细胞内钙水平的改变,干扰心肌兴奋—收缩偶联。观察心肌细胞收缩功能改变时需要节律性搏动的心肌细胞。然而,目前很多的药物对心肌细胞影响的研究都在使用未分化的H9c2细胞[7]。H9c2细胞系最初是从BDIX大鼠心脏的心室部分分离出来。在受精后的第13天,将心室细胞分离,通过选择性连续传代,根据不同分离组分的不同粘附动力学将培养皿中不同的组分分离[8]。在这一阶段,细胞仍未完全分化为成熟心肌细胞,但几种心肌细胞特异性标记物的出现表明了其接下来的分化方向。这一胚胎细胞系的一个重要特征是,它能够在低浓度的血清培养基中由单核偶联细胞分化成肌管,并以平行的方式获得细长的形状和定位[9]。在分化过程中,细胞主要获得骨骼肌表型,因为有特定类型的细胞分化标记物如myogenin和MyoD等可检测到[10]。此外,Menard等[10]证明,将全反式维甲酸(all-trans retinoic acid, RA)添加到1% 的血清培养基中,主要是诱导细胞呈现成人心肌表型,表现出来的特征为L型钙通道alpha-1亚基的过表达。最重要的是,H9c2细胞在分化时不存在收缩活性。所以,使用未分化的H9c2细胞进行研究,便引起了与原发性心肌细胞相比的结果不一致的问题,这在心脏毒性研究中尤其重要,因为剂量反应可以被细胞分化状态改变,而且细胞不能收缩做功,不能模拟心肌细胞的正常工作状态[11]。另外,自Powell等[12]于1976年首次建立了心肌细胞的分离方法后,新鲜分离的心肌细胞被普遍地应用于心肌细胞力学、兴奋-收缩偶联、钙离子浓度变化、药物干预等实验研究中[13]。判断分离细胞活性的最可靠标准是,光镜下见细胞呈长杆状、横纹清晰、四角锐利且无明显搏动[14]。新鲜分离下的心肌细胞在KB液中于室温下静置1 h,待心肌细胞稳定后,可用于原代细胞培养也可直接用于实验研究[15]。但是成熟心肌细胞分离下来的细胞很容易被污染,培养成功率低,仅适合于需要长周期给药的实验研究。
本研究通过电极刺激心肌细胞,使之恢复节律性的搏动,并从线粒体形态及ROS生成量两个方面表明节律性搏动的心肌细胞能更好的模拟布比卡因的心肌毒性,适用于给药周期短的心肌细胞代谢类实验研究。
参考文献
[1] Tomita A, Satani M, Suzuki K, et al. A case of cardiac arrest following intra-articular administration of levobupivacaine during total knee arthroplasty[J]. Masui, 2016, 65(2): 179-183.
[2] Nelson M, Reens A, Reda L, et al. Profound prolonged bradycardia and hypotension after interscalene brachial plexus block with bupivacaine[J]. J Emerg Med, 2018, 54(3): e41-e43.
[3] Hiller N, Mirtschink P, Merkel C, et al. Myocardial accumulation of bupivacaine and ropivacaine is associated with reversible effects on mitochondria and reduced myocardial function[J]. Anesth Analg, 2013, 116(1):83-92.
[4] Gorelik J, Yang LQ, Zhang Y, et al. A novel Z-groove index characterizing myocardial surface structure[J]. Cardiovasc Res, 2006, 72(3): 422-429.
[5] Joshi MS, Crouser ED, Julian MW, et al. Digital imaging analysis for the study of endotoxin-induced mitochondrial ultrastructure injury[J]. Anal Cell Pathol, 2000, 21(12): 41-48.
[6] Holzerová E, Prokisch H. Mitochondria: Much ado about nothing? How dangerous is reactive oxygen species production? [J]. Int J Biochem Cell Biol, 2015, 63: 16-20.
[7] Wang M, Lu L, Liu Y, et al. FTY720 attenuates hypoxia-reoxygenation-induced apoptosis in cardiomyocytes[J]. Exp Mol Pathol, 2014, 97(2): 218-224.
[8] Kimes BW, Brandt BL. Properties of a clonal muscle cell line from rat heart[J]. Exp Cell Res, 1976, 98(2): 367-381.
[9] Sardão VA, Oliveira PJ, Holy J, et al. Vital imaging of H9c2 myoblasts exposed to tert-butylhydroperoxide-characterization of morphological features of cell death[J]. BMC Cell Biol, 2007, 8: 11.
[10] Ménard C, Pupier S, Mornet D, et al. Modulation of L-type calcium channel expression during retinoic acid-induced differentiation of H9C2 cardiac cells[J]. J Biol Chem, 1999, 274(41): 29063-29070.
[11] Branco AF, Pereira SL, Moreira AC, et al. Isoproterenol cytotoxicity is dependent on the differentiation state of the cardiomyoblast H9c2 cell line[J]. Cardiovasc Toxicol, 2011, 11(3): 191-203.
[12] Powell T, Twist VW. A rapid technique for the isolation and purification of adult cardiac muscle cells having respiratory control and a tolerance to clcium[J]. Biochem Biophys Res Commun, 1976, 72(1): 327-333.
[13] Louch WE, Sheehan KA, Wolska BM. Methods in cardiomyocyte isolation, culture, and gene transfer[J]. J Mol Cell Cardiol, 2011, 51(3): 288-298.
[14] Piper HM, Probst I, Schwartz P, et al. Culturing of calcium stable adult cardiac mocytes[J].J Mol Cell Cardiol, 1982, 14(7): 397-412.
[15] 王影,孙红,范乐明,等. 成年大鼠心肌细胞的分离和培养技术[J]. 徐州医学院学报, 2005, 25(5): 393-396.
Wang Y, Sun H, Fan LM, et al. Isolation and culture of adult rat cardiac myocytes [J]. Acta Acad Med Xuzhou, 2005, 25(5): 393-396.

