尼罗红示踪纳米制剂在荷瘤裸鼠体内活体成像的应用
张凤梅,李可欣,余忠姝,张景勍,潘永全,韩文莉*
(1. 重庆医科大学实验动物中心,重庆 400016; 2. 重庆医科大学药学院重庆药物高校工程研究中心,重庆 400016)
尼罗红 [9-(二乙胺基)-5H-苯并[A]吩恶嗪-5-酮, Nile red, NR] 是一种脂溶性的荧光染料,与脂类物质(包括甘油酯、磷脂以及各种脂肪酸)相结合后具有荧光效应,在适合的波长(450 ~ 580 nm)激发下可显示强烈的桔红色荧光(550 ~ 750 nm),最初应用于半定量技术[1],目前被广泛应用于细菌、真菌、微藻、酵母和浮游植物等细胞中的脂类定量分析[2-5]。
近年来,纳米制剂在药物制剂领域为开发具有特定的靶向性药物做出了较大的贡献,成为人们关注的热点[6-7]。纳米制剂包括脂质体、胶束、微球、纳米粒和纳米囊等[8]。纳米制剂具有通过改善药物生物利用度、提高药物稳定性和抗癌药物的靶向性停留来提高治疗指数的特点[9-10],还可增加疏水性药物的溶解度并减少对正常组织的不良反应[11-12]。为了追踪给药后纳米制剂在细胞、组织、器官及生物体内的分布,需要对纳米制剂进行适当的标记,通过相应的成像技术进行对比和分析[13]。
活体成像技术是利用活体生物发光或荧光成像直接监测活细胞在动物体内的生物学行为及跟踪分子信号的一种新兴的前沿技术[14],目前已广泛应用于医学、生物学及药物开发等研究领域[15-16]。活体成像技术弥补了传统实验技术难以在活体观察药物动态转移过程的不足,对实时分析药物在荷瘤小鼠体内的靶向性具有重要的参考价值和指导意义[17]。
本研究拟将尼罗红包裹入纳米乳中,采用小动物活体成像技术研究纳米制剂的肿瘤靶向性及其在体内的组织分布情况,以期为尼罗红新的应用研究提供实验依据和前期基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性BALB/c裸鼠,4周龄,体重 (14.95 ± 0.64) g,购自北京华阜康生物科技股份有限公司【SCXK (京) 2014-0004】。实验动物饲养及操作严格按照 SPF级标准要求在重庆医科大学实验动物中心进行【SYXK (渝) 2017-0023】。实验经重庆医科大学医学研究伦理委员会批准。
1.1.2 药品与试剂
尼罗红 (Nile red, NR, 购自上海麦克林生化科技有限公司);尼罗红混悬液 (NR suspension, NRS, 自制, 20170910);尼罗红油包水纳米乳 [NR nano-emulsion, NRNE(O), 自制, 20170908][18];胎牛血清 (Gibco);RPMI-1640培养液 (HyClone);Cell Counting Kit-8(日本同仁化学研究所)。
1.1.3 仪器
FA1004 A电子天平(上海精天电子仪器有限公司,中国);Thermo 311 CO2培养箱(Thermo Scientific,美国);荧光分光光度计(岛津公司,日本);LB983 NC320型活体成像系统(Berthold Technologies GmbH & Co. KG,德国)。
1.1.4 细胞
人小细胞肺癌细胞株 NCI-H1688,由陆军军医大学野战外科研究所胸外科馈赠。H1688 细胞置于含 10% 胎牛血清的RPMI-1640培养液中,37℃、饱和湿度、5% CO2培养箱中培养。
1.2 方法
1.2.1 H1688肺癌小鼠模型
人小细胞肺癌NCI-H1688细胞常规细胞培养,取对数生长期细胞用培养液调整浓度至5×107个/ mL,在裸鼠右侧腋窝皮下注射0.1 mL细胞悬液。每天观察裸鼠的状态,用游标卡尺测量肿瘤大小,记录数据。
1.2.2 尼罗红荧光光谱特性
用荧光分光光度计考察尼罗红的荧光光谱。
1.2.3 NRNE(O)的细胞毒性试验
通过CCK-8分析方法评价NRNE(O)对于NCI-H1688的毒性[19]。
1.2.4 活体成像实验
取皮下接种H1688细胞的裸鼠6只(肿瘤体积约为150 mm3),随机分为NRS组和NRNE(O)组,每组3只,按0.5 mol /只剂量分别灌胃NRS和NRNE(O)。分别在给药前、给药后1、3、5、12、24 h置于活体成像仪中进行拍摄并统计荧光强度(counter per second,CPS,即单位时间内电荷耦合元件(charge-coupled device, CCD)捕获到的光子数)拍摄模式为荧光模式,激发波长为550 nm,发射波长为620 nm,曝光时间为0.1 s。
1.3 统计学方法
应用Indigo 2.0软件对荧光值进行分析,利用SPSS 19.0软件对裸鼠体重、肿瘤体积及荧光值进行统计学分析。
2 结果
2.1 尼罗红的荧光光谱
如图1 所示,尼罗红具有良好的荧光光学特性,550 nm为最大激发波长,620 nm为最大发射波长。

图1 尼罗红的荧光光谱Figure 1 Fluorescence spectrum of Nile red
2.2 H1688肺癌小鼠模型的建立
裸鼠体重及肿瘤体积变化趋势见图2。接种H1688细胞后,裸鼠体重较稳定表明裸鼠状态较好,其肿瘤生长速度由快到慢。
2.3 NRNE(O)的细胞毒性
采用CCK-8法,考察了NRNE(O)对H1688细胞的毒性。由图3可以看出,当NRNE(O)浓度约为500 μmol/L时, 细胞的24 h存活率均高于85%。这说明NRNE(O)具有较低的细胞毒性和良好的生物相容性。
2.4 荷瘤裸鼠活体成像
各实验组不同时间点的成像结果如图4所示, NRNE(O) 组肿瘤部位的荧光强度在5个时间点均明显强于NRS组(图4红色标记部分为肿瘤),NRNE(O) 组小鼠在给药后3 h和5 h的荧光值均显著高于NRS组(P< 0.01)。NRNE(O) 组于3 h在肿瘤部位的蓄积量最大,5 h后逐渐减少。而NRS组在肿瘤部位的几乎无蓄积。随着肿瘤体积的增加,其荧光强度也逐渐增强,表明尼罗红可作为纳米乳的示踪剂(如图4D所示)。
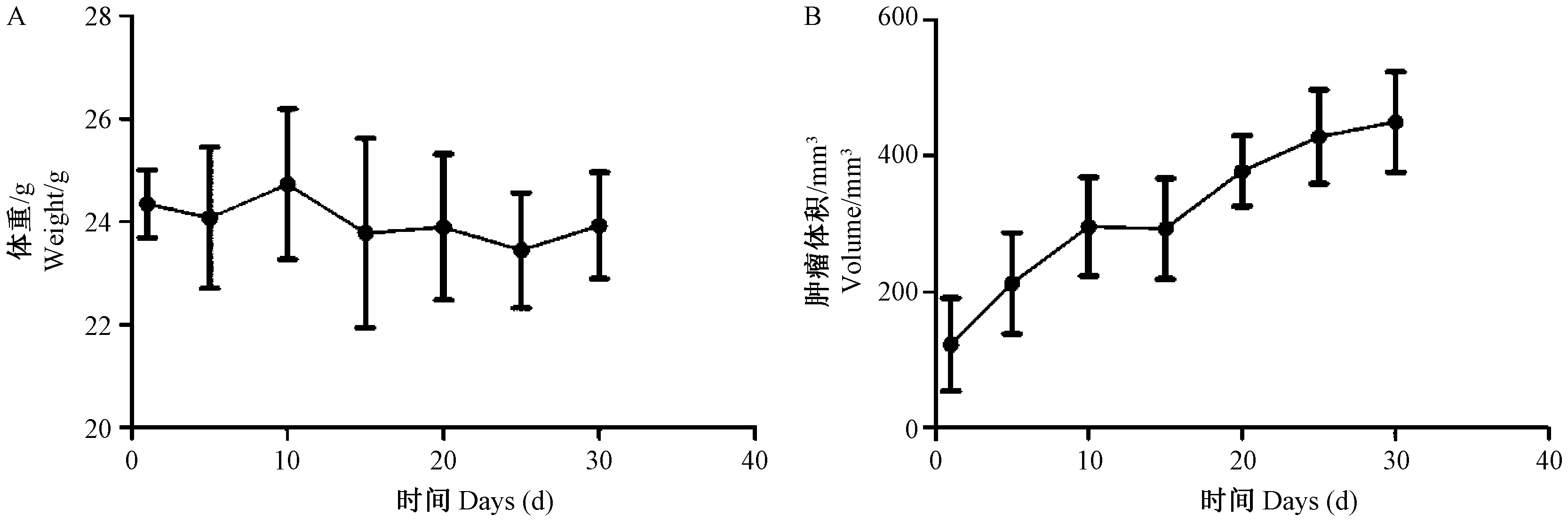
图2 小鼠的体重及肿瘤生长情况Figure 2 Changes in body weight (A) and tumor volume (B) of the H1688-bearing nude mice

图3 不同浓度的NRNE(O)对H1688细胞存活率的影响Figure 3 Effects of different concentrations of NRNE(O) on the viability of lung cancer H1688 cells

注:A. NRS;B. NRNE(O);C. 荧光强度 NRS and NRNE(O);D. 肿瘤体积与光强度的线性关系;**P< 0.01 vs NRS。图4 不同时间点尼罗红原料药与纳米制剂在荷瘤裸鼠体内的动态分布Note. A, NRS. B, NRNE(O). C, Fluorescence intensity of NRS and NRNE(O). D, Correlation between tumor volume and fluorescence intensity.**P< 0.01 vs NRS.Figure 4 Dynamic distribution of NRS and NRNE(O) in the H1688-bearing nude mice at different time points
3 讨论
小动物活体成像主要采用生物发光与荧光两种技术,对疾病动物模型微小病灶的检测灵敏度极高[20]。该技术能够进行无创、实时、动态的动物活体观察,从而对同一实验对象进行不同时间点的观察,减少实验动物个体间差异。与传统的实验方法相比,可大大减少动物的用量,符合替代、减少、优化的“3R”原则[21],同时也为确定药物在体内是否具有靶向性,提供了新的技术手段。在体内红光的穿透性比蓝绿光的穿透性强,所以近红外荧光为成像观察的最佳选择。本研究就是利用了荧光染料尼罗红近红外成像的特性,得到了荷瘤鼠体内的纳米乳清晰、实时的荧光分布图。
本课题组前期将尼罗红导入纳米乳中,采用激光共聚焦观察纳米乳进入A549活细胞的情况。结果显示,纳米乳在10 min内迅速进入细胞,主要集中在细胞质,少数分布在胞核内[18]。细胞实验证实:尼罗红可作为一种纳米制剂的示踪剂应用于细胞成像实验中。尼罗红测定细胞中三酰甘油的含量时,在一定范围内(0 ~ 800 μg/mL),其荧光值与尼罗红成浓度依赖关系,当尼罗红浓度再增大时,其荧光值呈下降趋势[22]。本实验中采用前期制备方法将终浓度为2 mg/mL的尼罗红包裹于纳米乳中[18],通过小动物活体成像技术快速稳定地指示纳米乳的分布状况,下一步将对尼罗红适用于活体成像的浓度范围及其浓度与荧光强度的关系进行研究。
本研究利用尼罗红的荧光特性结合小动物活体成像技术,成功地将尼罗红作为纳米乳的示踪剂应用到考察其在荷瘤鼠体内的肿瘤靶向性和组织分布中。从荷瘤裸鼠活体成像图看出,NRS组的药物在肿瘤部位几乎没有蓄积,NRNE(O)组的药物在肿瘤部位有蓄积,表明该纳米乳给药系统显著提高了其肿瘤靶向性。本研究拓展了尼罗红的应用范围,也证实尼罗红可作为示踪剂与活体成像技术结合,为纳米制剂在小动物活体内成像提供了重要的研究手段。
参考文献
[1] Huang GH, Chen G, Chen F. Rapid screening method for lipid production in alga based on Nile red fluorescence [J]. Biomass Bioenerg, 2009, 33(10): 1386-1392.
[2] Kimura K, Yamaoka M, Kamisaka Y. Rapid estimation of lipids in oleaginous fungi and yeasts using Nile red fluorescence [J]. J Microbiol Methods, 2004, 56(3): 331-338.
[3] Bertozzini E, Galluzzi L, Penna A, et al. Application of the standard addition method for the absolute quantification of neutral lipids in microalgae using Nile red [J]. J Microbiol Methods, 2011, 87(1): 17-23.
[4] 胡小文, 马帅, 弓淑芬, 等. 荧光光谱法检测微藻中油脂[J]. 中国油脂, 2011, 36(4): 70-74.
Hu XW, Ma Shuai, Gong SF, et al. Determination of microalgae lipids by fluorescent spectrometry [J]. Chin Oils Fats, 2011, 36(4): 70-74.
[5] 王海英, 符茹, 黄宝祥. 基于尼罗红荧光染色的小球藻脂质快速检测方法研究 [J]. 中国油脂, 2012, 37(3): 78-81.
Wang HY, Fu R, Huang BX. Rapid determination of lipid in Chlorella based on Nile red fluorescence [J]. Chin Oils Fats, 2012, 37(3): 78-81.
[6] Su J, Chen F, Cryns VL, et al. Catechol polymers for pH-responsive, targeted drug delivery to cancer cells [J]. J Am Chem Soc, 2011, 133(31): 11850-11853.
[7] 高会乐, 蒋新国. 新型药物递释系统的研究进展 [J]. 药学学报, 2017, 52(2): 181-188.
Gao HL, Jiang XG. The progress of novel drug delivery systems [J]. Acta Pharm Sin, 2016, 51: 272-280.
[8] Song G, Suzuki OT, Santos CM, et al. Gulp1 is associated with the pharmacokinetics of PEGylated liposomal doxorubicin (PLD) in inbred mouse strains [J]. Nanomedicine, 2016, 12(7): 2007-2017.
[9] 李大伟, 武玉敏, 刘正平,等. 肺部吸入纳米制剂治疗肺癌的研究进展 [J]. 中国药房, 2016, 27(31): 4460-4462.
Li DW, Wu YM, Liu ZP, et al. Research progress of lung inhalation nano-agents for treating lung cancer [J]. Chin Pharm, 2016, 27(31): 4460-4462.
[10] 孔晓龙, 郭梅红, 范颖, 等. 纳米靶向制剂的研究进展 [J]. 广西医科大学学报, 2015, 32(4): 682-685.
Kong XL, Guo MH, Fan Y, et al. Research progress of targeting nanodrug delivery system [J]. J Guangxi Med Univ, 2015, 32(4):682-685.
[11] 刘源, 周建平, 王伟. 聚乙二醇修饰靶向纳米制剂的研究进展 [J]. 中国药科大学学报, 2017, 48(3): 268 -275.
Liu Y, Zhou JP, Wang W. Advances in PEGylated targeted nano-preparation [J]. J Chin Pharm Univ, 2017, 48(3): 268 -275.
[12] 史一杰, 程刚. 纳米制剂生物安全性评价研究进展 [J]. 沈阳药科大学学报, 2010, 27(12): 987-992.
Shi YJ, Cheng G. Review on the research of biological safety evaluation for nanopreparations [J]. J Shenyang Pharm Univ, 2010, 27(12): 987-992.
[13] 胡秀丽, 王瑞, 岳军, 等. 叶酸高分子纳米胶束在小鼠体内的靶向分布 [J]. 中国科学:化学, 2012, 42(8): 1172-1178.
Hu XL, Wang R, Yue J, et al. Folic acid mediated tumor targeting effect observed by fluorescent imaging [J]. Sci Sin (Chim), 2012, 42(8): 1172-1178.
[14] Ntziachristos V, Ripoll J, Wang LV, et al. Looking and listening to light: the evolution of whole-body photonic imaging [J]. Nat Biotechnol, 2005, 23(3): 313-320.
[15] 邰文, 孙敏敏, 刘楠, 等. 应用动物活体生物发光技术观察紫杉醇混合胶束的抑瘤效果[J].药学学报, 2010, 45(4): 530-534.
Tai W, Sun MM, Liu N, et al. Study on the anti-tumor effect of paclitaxel mixed micelle by using in vivo optical imaging technique [J]. Acta Pharm Sin, 2010, 45: 530-534.
[16] 沈锦秋, 甘勇, 甘莉, 等. 氟比洛芬酯眼用纳米乳-离子敏感型原位凝胶的研究 [J]. 药学学报, 2010, 45(1): 120-125.
Shen JQ, Gan Y, Gan L, et al. Ion-sensitive nanoemulsion-insitugel system for ophthalmic delivery of flurbiprofen axetil [J]. Acta Pharm Sin, 2010, 45: 120-125.
[17] 张胜华, 程昕, 钟根深, 等. 活体成像分析异硫氰酸荧光素标记Rituximab 在荷淋巴瘤裸鼠体内的生物分布 [J]. 中华医学杂志, 2010, 90(33): 2367-2370.
Zhang SH, Cheng X, Zhong GS, et al.Invivoimaging analysis of biodistribution of FITC-labeled Rituximab in lymphoma-bearing nude mice [J]. Natl Med J Chin, 2010, 90(33): 2367-2370.
[18] Liu S, Chen D, Yuan Y, et al. Efficient intracellular delivery makes cancer cells sensitive to nanoemulsive chemodrugs [J]. Oncotarget, 2017, 8(39): 65042-65055.
[19] Münch C, Harper JW. Mitochondrial unfolded protein response controls matrix pre-RNA processing and translation [J]. Nature, 2016, 534(7069): 710-713.
[20] 付奎, 杨晓峰, 汪海龙, 等. 活体荧光成像评估Ag85A和Ag85BDNA疫苗对小鼠膀胱癌移植瘤的疗效 [J]. 中国肿瘤生物学杂志, 2009, 16(6): 588-594.
Fu K, Yang XF, Wang HL, et al. In vivo fluorescence image analysis system in assessing efficacies of pVAX1-Ag 85A and pVAX1-Ag 85B DNA vaccines in treatment of bladder cancer cell implanted tumors in mice [J]. Chin J Cancer Biother, 2009, 16(6): 588-594.
[21] 闫明霞, 刘蕾, 荚德水, 等. 人肺癌裸小鼠模型活体成像的动态观察 [J]. 肿瘤, 2008, 28(10): 833-836.
Yan MX, Liu L, Jia DS, et al. Dynamic observation of in vivo biofluorescence imaging in nude mouse model with human lung carcinoma [J]. Tumor, 2008, 28(10): 833-836.
[22] Gao Y, Chen G, Weselake RJ. A rapid Nile red fluorescence-based method for triacylglycerol content in microspore-derived cell suspension cultures of brassica napus [J]. Lipids, 2014, 49(11): 1161-1168.

