广西巴马小型猪CTSK基因CDS区克隆与生物信息学分析
黄叶,瞿秋红,奉玲丽,江雨航,朱思燃,张广杰,张其伟,綦文晶,郭亚芬,兰干球
(广西大学动物科学技术学院, 南宁 530001)
组织蛋白酶K(cathepsin K,CTSK)是一种溶酶体半胱氨酸蛋白酶,属于木瓜蛋白酶超家族成员,发现存在于溶酶体的细胞内,是蛋白酶中一个细胞外基质降解的酶类[1]。在有关猪方面的研究发现,CTSK基因由8个外显子和7个内含子组成,位于猪的4号染色体上。组织蛋白酶类活性受多种调控机制影响,如基因表达调控、蛋白酶激活,以及西司他丁类相关的蛋白酶抑制剂也能抑制其正常功能[2]。组织蛋白酶类功能涉及组织重塑、血管发生、一些激素和转录因子加工及某些免疫反应[3-4]。近年来,有关CTSK基因的研究在关于人方面的报道增多,组织蛋白酶K是破骨细胞中特征性高表达的溶酶体酶,已经确定为引起人常染色体隐性疾病,骨质疏松症骨骼肌功能障碍的纤维骨质增生症的缺陷酶[5],同时在骨基质的降解和改建中发挥关键作用[6]。
据目前对此基因的研究现状而言,有关人方面的研究发现组织蛋白酶K与人类多种恶性疾病相关,尤其是肿瘤的发生、发展、侵袭和转移密切相关等[1],诸如已经报道的食管鳞状细胞癌[7]、乳腺癌[8]、皮肤纤维瘤[9]以及隆凸性皮肤纤维肉瘤和肺癌[10]等。此外,组织蛋白酶K与人类其他疾病也密切相关,例如骨质疏松症[11]、过敏性肺炎[12]和肥胖[13]等。有研究表明CTSK与牙周炎、种植体周围炎、牙齿移动、口腔颌面部肿瘤、牙根吸收及根尖周病等口腔颌面部疾病有关[14]。目前,在NCBI(National Center for Biotechnology Information)上已经公布有牛、家犬、斑马鱼、原鸡、人、食蟹猴、猕猴、小家鼠、穴兔、褐家鼠等动物CTSK基因的CDS区,目前已经有一些关于CTSK基因有关人方面的其他研究,通过构建CTSK基因的SiRNAs表达质粒,抑制CTSK基因表达来延缓软骨细胞的去分化过程并促进其成软骨能力[15]。但是还没有关于广西地方猪种CTSK基因 CDS区克隆的报道。广西巴马小型猪具有体型小、遗传性能稳定、相关的生物学特征明确等特征,是一种很好的实验动物等。因此,开展广西巴马小型猪的研究对相关疾病模型的建立以及进一步的基因研究具有重要意义。
1 材料与方法
1.1 材料
1.1.1 实验动物
实验材料来源于广西大学小型猪繁育场内的广西巴马小型猪繁育封闭群【SCXK(桂)2018-0003】,小猪配合饲料喂养,来源于广西南宁市哆莱美生物饲料科技有限公司,每日2次,自由饮水。屠宰后取其皮下脂肪组织,样品采集后迅速放入液氮中防止其降解,运至实验室分类整理并与-80℃冻存备用。实验经广西大学伦理委员会审批(GXLL2018-006)。
1.1.2 主要试剂
Trizol试剂、pMD18-T载体、胶回收试剂盒均购自TaKaRa公司;反转录试剂盒、Taq PCR Master Mix 均购自Vazyme公司;大肠杆菌DH5α感受态细胞购自全式金生物技术有限公司。
1.2 实验方法
1.2.1 引物设计与合成
根据NCBI上公布的预测普通猪CTSK基因序列(GenBank 登陆号: XM_005663466.3),序列长度3669 bp,利用Oligo 7.0和Primer Premier 6.0软件设计特异性引物序列,预期扩增长度1104 bp,包含993 bp的全长编码区,引物序列为:CTSK-F:5’-GGCTCAAGGTTGTACTACTGCTG-3’;CTSK-R:3’ -TCACATCTTGGGGAAGCTGG-5’。引物由生工生物工程(上海股份有限公司)合成。
1.2.2 总RNA提取和cDNA合成
利用Trizol法提取广西巴马小型猪皮下脂肪总RNA,用微量紫外分光光度计测定RNA浓度和纯度,用反转录试剂盒合成cDNA。反转录步骤:①Total RNA 2 μL,Oligo T23(50 μmol/L)1 μL,RNase-free ddH2O 5 μL,65℃加热5 min,冰上静置2 min; ②上一步混合物8 μL,2×RT Mix 10 μL,HiScriptⅡ Enzyme Mix 2 μL,55℃ 45 min,85℃ 5 min。-20℃保存备用。
1.2.3 PCR扩增
PCR扩增体系15 μL:cDNA模板1 μL,上下游引物各1 μL,2× Taq PCR Master Mix 7.5 μL,RNase-free ddH2O 4.5 μL。PCR的程序设置:94℃预变性5 min,94℃变性30 s,62℃退火30 s,72℃延伸25 s,循环35次,最后72℃延伸7 min。取7.5 μL PCR扩增产物,用1.5%的琼脂糖凝胶进行电泳检测,观察扩增产物是否含有993 bp大小的目的条带。
1.2.4CTSK基因克隆及测序
使用胶回收试剂盒对目的片段进行回收和纯化,将获得的目的产物与pMD-18T载体放在4℃冰箱的条件下进行过夜连接,连接体系为pMD-18T Vector 1.0 μL,回收和纯化的目的片段4.0 μL,Solution I 5.0 μL。将连接所得产物转入感受态细胞DH5a中,再加入500 μL的LB培养液中,放入摇床200 r/min 37℃培养1 h,之后取适量菌液均匀涂布于含有氨苄青霉素的LA固体培养基,于37℃培养16 h;分区域挑选几个单克隆菌落接种于添加氨苄的LB液体培养基,振荡培养6 ~ 8 h,将菌液按照1.2.3 PCR扩增的实验步骤进行,凝胶电泳鉴定后的阳性菌液送生工生物工程(上海)有限公司进行测序。
2 结果
2.1 结果
2.1.1 模板制备
实验材料选用广西巴马小型猪皮下脂肪,提取其总RNA如图1,其中28S:18S≥1,5S条带没有或是很暗,说明在提取过程中,RNA的降解程度很少,可以用于后续实验。采用RT-PCR的方法克隆CTSK基因的CDS区,然后用1.5%的琼脂糖凝胶电泳检测提取的广西巴马小型猪皮下脂肪CDS区,图2中显示单一条带,无拖尾现象,说明CTSK基因CDS区序列的完整性和纯度较高,可用作PCR反应模板。
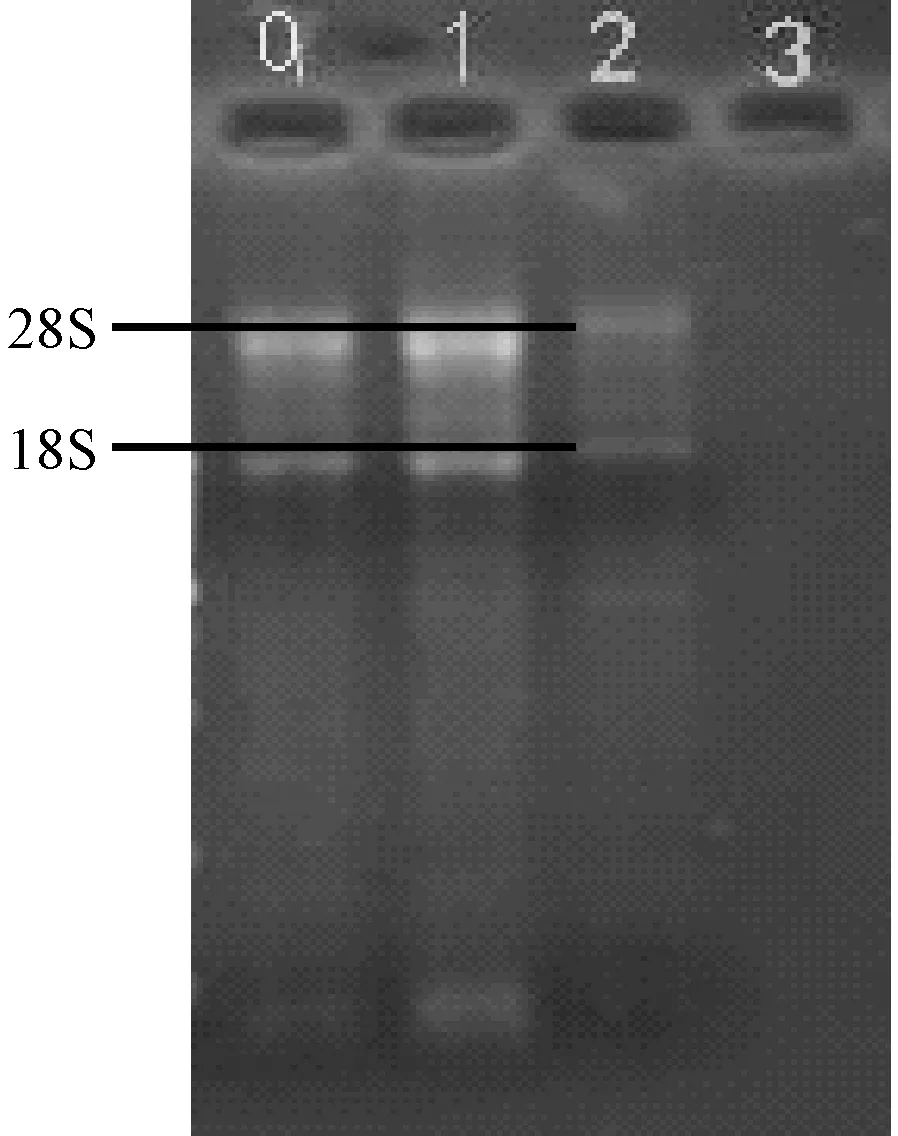
注:0,1,2为三头猪的RNA;3为阴性对照。图1 广西巴马小型猪皮下脂肪的RNA电泳Note. 0,1,2. RNA of three pigs. 3. Negative control.Figure 1 RNA electrophoresis results of subcutaneous fat in the Guangxi Bama mini-pig

注:M:DSTM 2000 Marker;1:阴性对照;2,3,4 CTSK基因PCR产物。图2 CTSK基因CDS区的PCR扩增片段Note. M. DSTM 2000 marker. 1. Negative control. 2,3,4. PCR products of CTSK gene.Figure 2 PCR amplified fragments of CTSK gene CDS region
2.1.2CTSK基因CDS区的菌液PCR扩增和测序结果分析
1.5%琼脂糖凝胶电泳检测PCR产物,结果如图3,在1000 bp附近可见明亮的特异性条带,片段长度与预期长度(993 bp)一致以及测序结果与NCBI上普通猪(NM_214302.1)的CDS区是一致的,据此初步推测获得了CTSK基因的CDS区。
2.2 生物信息学分析
2.2.1 广西巴马小型猪CTSK基因的CDS区同源性比较及系统进化树构建
利用Lasergene 软件的MegAlign程序对广西巴马小型猪及其他物种CTSK基因CDS区进行同源性比较,比较结果如图4所示。结果显示,该序列与GenBank报道的普通猪(Susscrofa, NM_214302.1)、犬(Canislupusfamiliaris, NM_001031631)、人(Homosapiens, AF159854)、食蟹猴(Macacafascicularis,NM_001319395.1)、猕猴(Macacamulatta, NM_001194326)、小鼠(Musmusculus, NM_007707)、穴兔(Oryctolaguscuniculus, NM_001082641.1)、褐家鼠(Rattusnorvegicus, NM_031560.2)的同源性分别为100%、93.9%、94.2%、94.2%、94.2%、86.2%、92.2%、87.1%。根据上述物种CTSK基因的CDS区碱基同源性构建物种系统进化树,见图5,结果表明,普通猪与广西巴马小型猪的遗传距离最近,最远是小家鼠和褐家鼠。
2.2.2 广西巴马小型猪CTSK氨基酸组成分析
利用ExPASy数据库中的软件Protaram在线分析广西巴马小型猪CTSK基因的氨基酸序列,推测出广西巴马小型猪蛋白分子量为37 069.15Da,氨基酸种类20种,等电点为8.81。氨基酸种类的含量相对比较均匀,其中赖氨酸、甘氨酸、亮氨酸的含量相对高一些,都达到了8%以上。其次丙氨酸、天冬酰胺、谷氨酸、甘氨酸、亮氨酸、赖氨酸、丝氨酸、酪氨酸、缬氨酸的含量达到了5%以上。
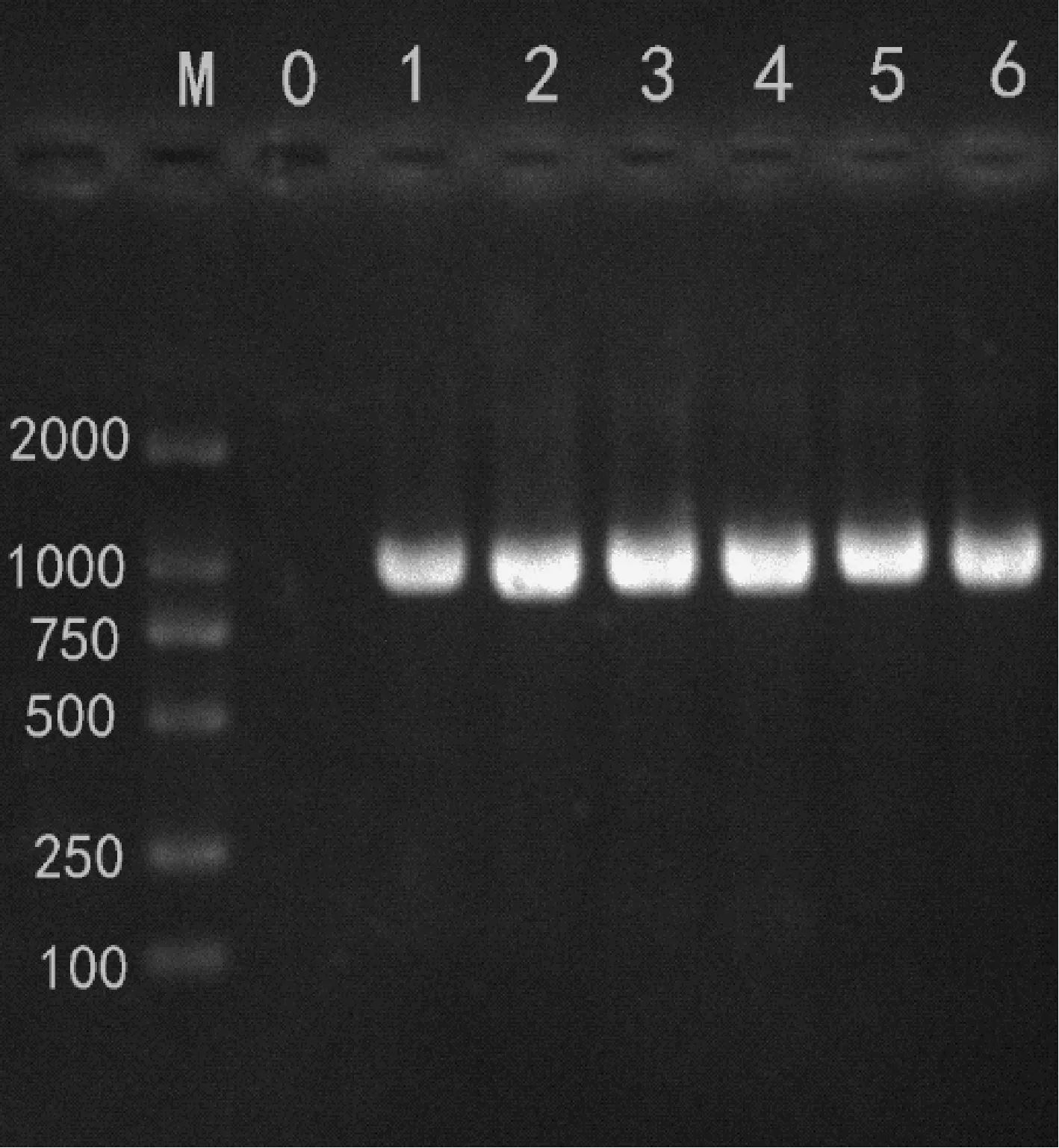
注:M.DSTM 2000 Marker;0.阴性对照;1,2,3,4,5,6. CTSK基因cDNA的菌液PCR产物。图3 CTSK基因CDS区的菌液PCR扩增片段Note. M. DSTM 2000 marker. 0. Negative control. 1,2,3,4,5,6. Bacterial PCR products of CTSK gene cDNA.Figure 3 Bacterial PCR amplified fragments ofCTSK gene CDS region

图4 不同动物CTSK基因CDS区同源性比较Figure 4 Comparision of homology between CTSK gene CDS regions in different animals
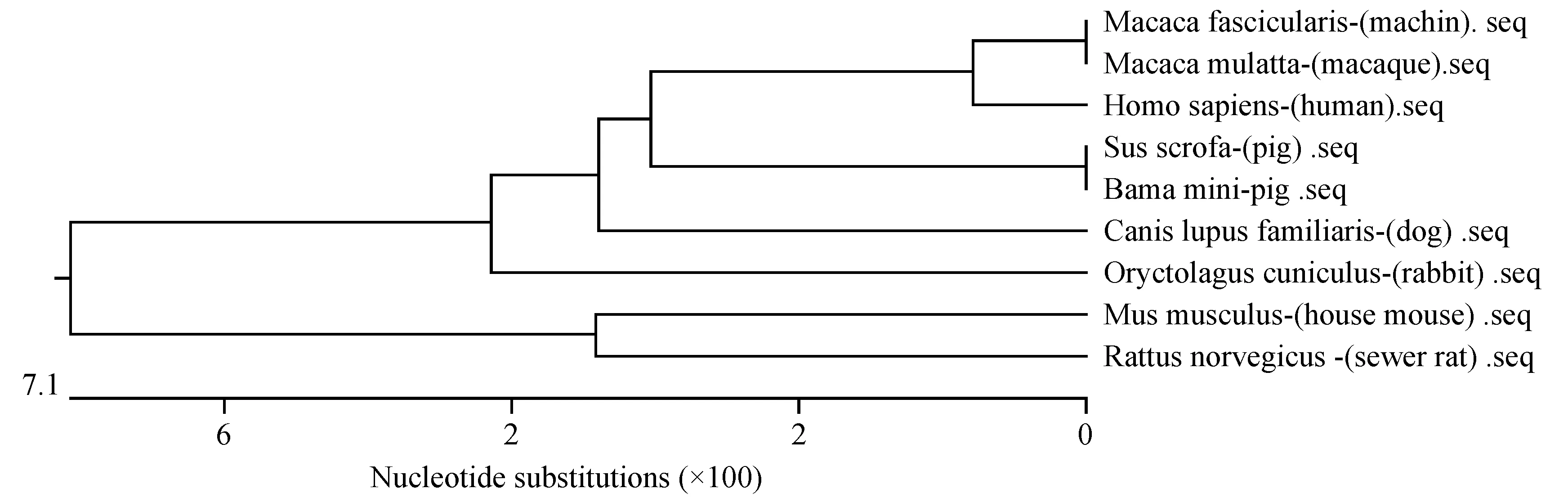
图5 CTSK基因CDS区在不同物种中的系统进化树Figure 5 Phylogenetic tree of CTSK gene CDS region in different species
2.2.3 蛋白质信号肽分析和跨膜结构预测
蛋白质信号肽预测结果如图6显示,在氨基酸序列的17-330位置,CTSK基因是存在一条信号肽,跨膜结构预测结果如图7,该蛋白分布在膜内(inside)的概率为0,分布在膜外(inside)的概率为1,表明CTSK基因不存在跨膜结构,所有的氨基酸都在膜外起作用。
2.2.4 广西巴马小型猪CTSK蛋白的亲疏水性分析
借助在线分析软件[Expasy Protscale]预测CTSK的亲疏水性,如图8所示。其中正值表示疏水,值越大疏水性越强;而负值表示亲水,值越小亲水性越强。从图8中可以看出,在-0.5以下的区域有很多氨基酸,即是亲水性区域,表明CTSK蛋白具有较强的亲水性,这与Expasy Protaram预测得到的总平均疏水指数(GRAVY=-0.545)结果一致。
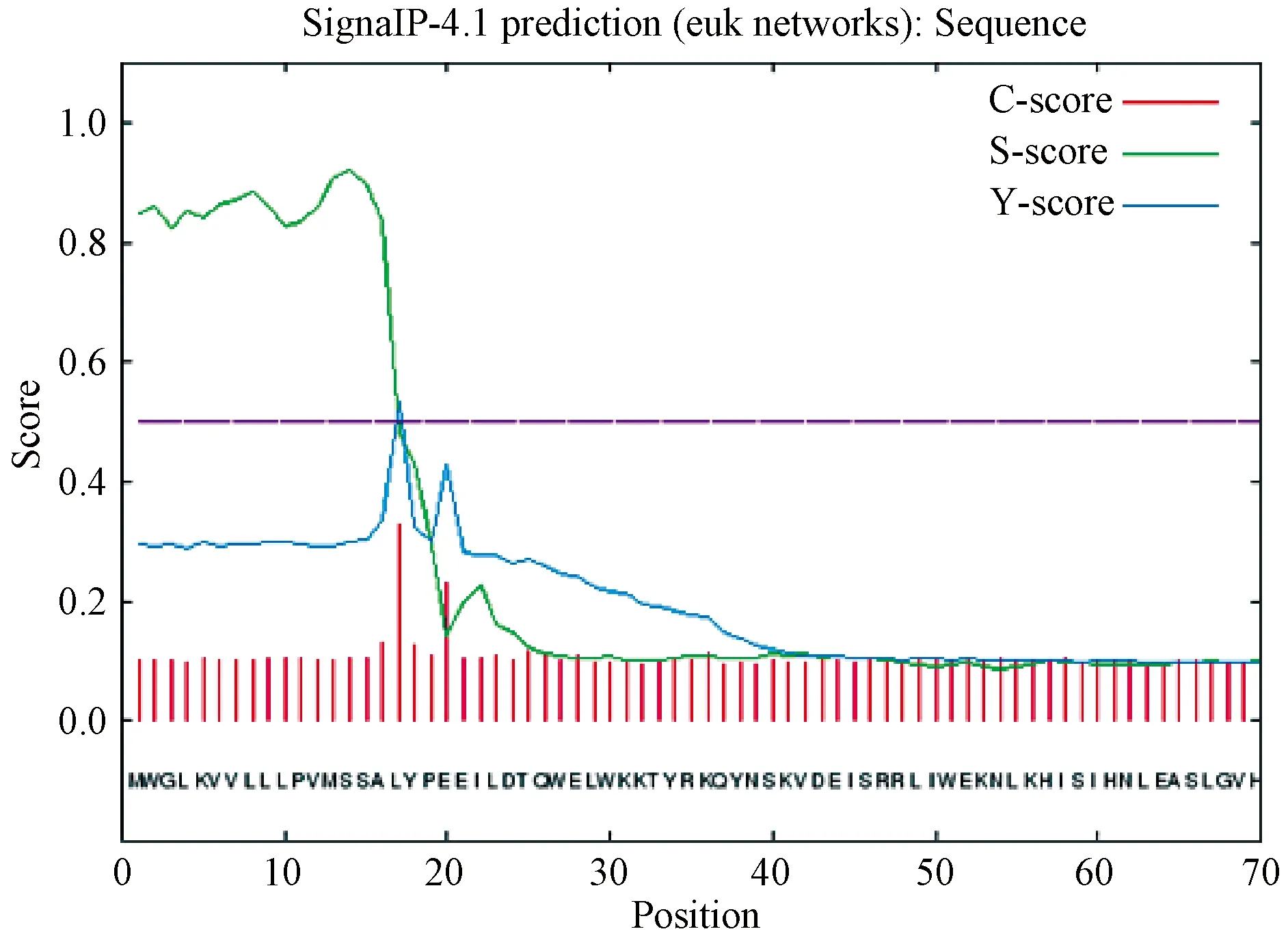
图6 广西巴马小型猪CTSK蛋白的信号肽预测Figure 6 Signal peptide prediction of CTSK protein in Guangxi Bama mini-pig
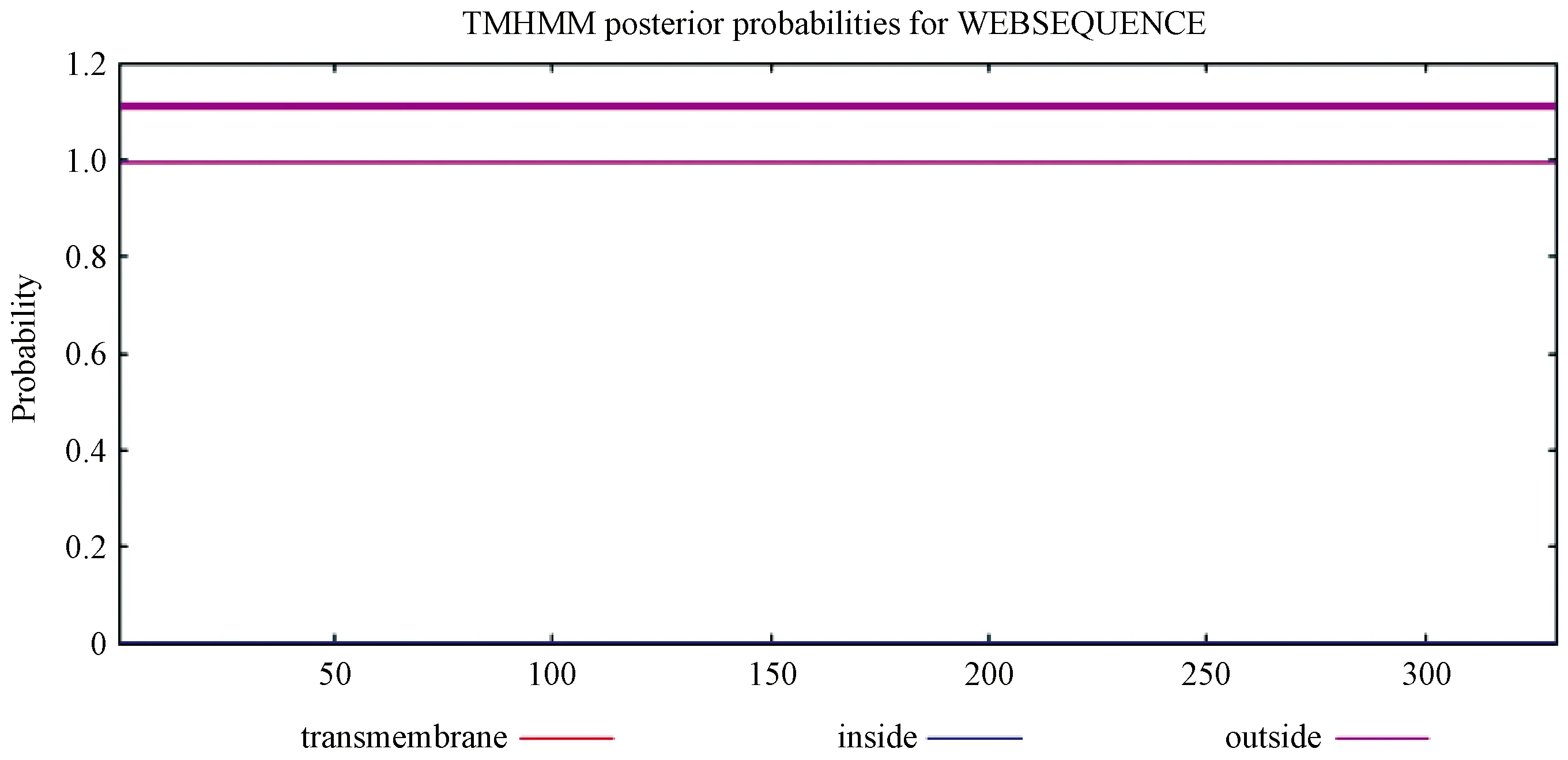
图7 广西巴马小型猪 CTSK蛋白的跨膜结构Figure 7 The transmenbrance structure of CTSK protein in Bama mini-pig
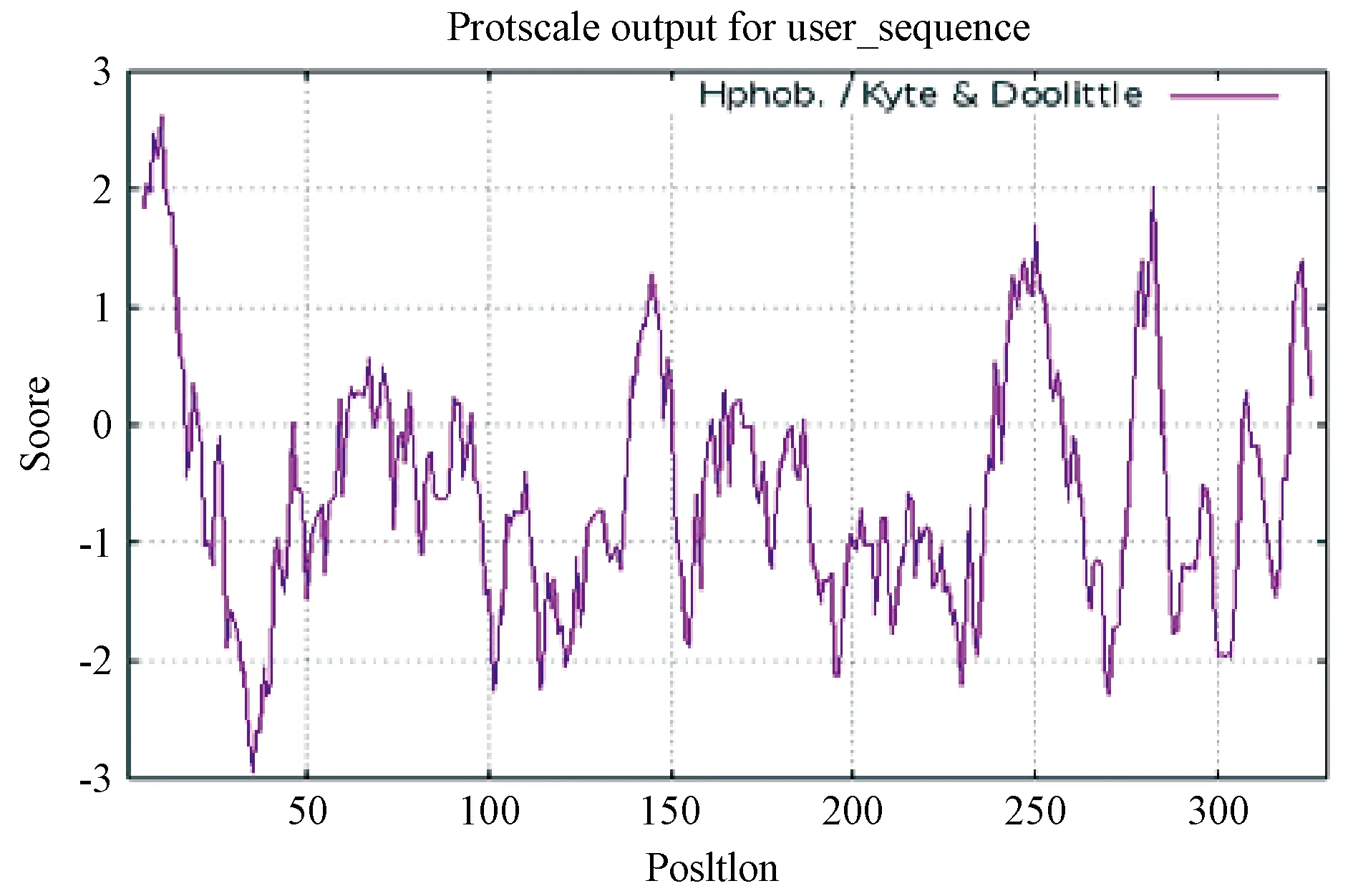
图8 广西巴马小型猪CTSK蛋白的疏水性分析Figure 8 Analysis of the hydrophobicity of CTSK protein in Guangxi Bama mini-pig
2.2.5 广西巴马小型猪CTSK蛋白的二级结构预测
利用[NPS@在线蛋白分析系统(MLRC方法)]对广西巴马小型猪CTSK蛋白的二级结构进行预测(图9),从预测结果可知,广西巴马小型猪CTSK蛋白中α-螺旋(h表示)占35.15%,β-折叠(t表示)占6.97%,氨基酸残基构成的延伸链(e表示)占16.36%,无规卷曲(c表示)占41.52%。
2.2.6 广西巴马小型猪CTSK蛋白的高级结构预测
利用蛋白三级结构分析平台SWISS-MODEL在线分析预测得到巴马猪CTSK蛋白可能存在的三级结构,如图10所示。

图9 广西巴马小型猪CTSK蛋白的二级结构预测Figure 9 Secondary structure prediction of CTSK protein in Guangxi Bama mini-pig

图10 广西巴马小型猪CTSK蛋白的三级结构Figure 10 Tertiary structure of CTSK protein in Guangxi Bama mini-pig
2.2.7 CTSK蛋白修饰结构的预测和亚细胞定位分析
利用NetNGlyc 1.0在线软件分析,糖基化位点的预测结果显示,CTSK蛋白在第104、214位氨基酸处分别存在1个N糖基化位点如图11。利用PSORT П中k-NN计算程序预测广西巴马小型猪CTSK蛋白亚细胞可能分布情况,结果表明,33.3%分布于内质网;22.2%分布于细胞核;11.1%分布于线粒体;11.1%分布于细胞外,包括细胞壁;11.1%分布于细胞质:11.1%分布于液泡。
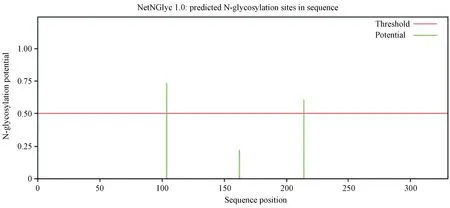
图11 广西巴马小型猪CTSK蛋白的N糖基化位点分析Figure 11 N-glycosylation sites analysis of CTSK protein in Guangxi Bama mini-pig
3 讨论
到目前为止,CTSK基因在人、食蟹猴、猕猴、小家鼠、穴兔、以及褐家鼠等多个物种上均编码329个氨基酸,家犬上编码330个氨基酸,各物种间编码的氨基酸数目差别不大,说明遗传距离较近,同时表明CTSK基因在不同物种间具有很高的保守性[16]。CTSK蛋白具有信号肽,主要在细胞外起作用,这与亚细胞定位预测结果是一致的。广西巴马小型猪CTSK蛋白不存在跨膜结构域,可能与其本身就是外分泌型蛋白酶有关。本实验对广西巴马小型猪相关生物信息学分析结果如CDS区长、理化性质、蛋白质结构、亚细胞定位、修饰结构等都是通过测序和在线软件进行鉴定和预测。实验选择广西巴马小型猪皮下脂肪组织为实验材料样品,原因如下:文献中有报道CTSK基因是脂肪沉积的候选基因,CTSK基因在脂肪组织中的表达量与脂肪沉积水平成正相关[17]。其次,根据NCBI上公布的CTSK基因在各组织和器官中的表达量,在脂肪组织中的表达量较高。
魏巍等[1]发现CTSK基因不仅参与机体正常生理调节,而且在多种疾病如实体瘤、关节炎、椎间盘退行性变等中均异常表达。张艳等[18]也成功的构建了CTSK基因的慢病毒质粒载体。CTSK作为去分化是软骨基质降解的关键降解酶,可减少软骨基质形成,而通过RNA干预技术降低了CTSK表达能增加Ⅱ型胶原及蛋白聚糖表达,获得最佳的软骨细胞表型[18]。有研究提出,П型胶原N端肽可通过激活经典蛋白激酶C(PKC)信号转导通路及p38丝裂原活化蛋白激酶(MAPK)信号转导通路提高CTSK表达[19]。李菲等[20]发现β-胶原降解产物、CTSK在骨质疏松诊断中有一定的价值,其水平与骨密度有相关性,骨质疏松患者的CTSK表达量高于正常人。唐特[21]在慢性肾脏病中的检测中发现,CTSK有助于判断慢性肾脏病患者并发骨质疏松的可能性及严重性;袁琳等[22]所研究的组织蛋白酶K(CTSK)、胱抑素C(CysC)、与冠状动脉粥样硬化性心脏病发病、冠状动脉狭窄程度以及冠心病危险因素之间的关系,结果表明CTSK、CysC可能与冠心病的发病独立性相关,其血清水平可反映冠心病患者冠状动脉病变狭窄程度,可作为诊断及判断预后的新的生物标记物。研究发现CTSK的上调似乎与口腔鳞状细胞癌中淋巴扩散的高发生率和较差的存活率有关,CTSK因此可以作为口腔鳞状细胞癌的预测性生物标志物[23]。
目前在已经报道的文献中发现CTSK基因在心、肺、骨骼肌、结肠、小肠、卵巢、胚盘等多种组织和成骨细胞、成纤维细胞以及骨髓来源的树突状细胞等多种细胞中均有表达[19]。CTSK基因多态性的生产性状研究主要集中在猪的背部脂肪厚度和瘦肉率以及平均日增重和饲料转化率方面[17]。同时也有文献报道,CTSK基因可通过损害TLR9信号传导影响病原体DNA的先天性免疫应答[24],在实验性肥胖小鼠的脂肪组织和具有肥胖表型的人中观察到CTSK基因的表达增加,显示了CTSK基因在脂肪细胞分化中的作用[25-26],CTSK基因被选作为猪脂肪沉积的候选基因。目前已经利用广西巴马小型猪已经建立糖尿病模型[27]、动脉粥样硬化模型[28]。由此推测,由CTSK基因所引发的各种疾病,可以利用广西巴马小型猪制作疾病模型,以及根据CTSK基因的表达量作为诊断某些疾病的一个指标。
本实验成功克隆出了CTSK基因的CDS区,其CDS区长993 bp,编码330个氨基酸,与NCBI上公布的普通猪CTSK基因序列中的CDS区是一致的,没有发生基因突变,具有一定的进化保守性。CTSK蛋白具有高度的亲水性,不存在跨膜结构,存在一条信号肽,该蛋白主要在细胞外起作用。本研究中广西巴马小型猪CTSK基因CDS区的获得可以为日后构建真核表达载体,进而表达获得重组CTSK蛋白,研究CTSK基因在各组织中的生物学功能奠定了前期理论基础,构建有关CTSK基因作用的相关疾病模型,提供一个研究的方向。
参考文献
[1] 魏巍, 孙文靖, 于旸,等. 人组织蛋白酶K基因研究进展 [J]. 国际遗传学杂志, 2012, 35(2): 82-85.
Wei W, Sun WJ, Yu Y, et al. Advance in human cathepsin K gene [J]. Int J Genet, 2012, 35(2): 82-85.
[2] Abrahamson M, Alvarez-Fernandez M, Nathanson CM. Cystatins [J]. Biochem Soc Symp, 2003, (70): 179-199.
[3] Jedeszko C, Sloane BF. Cysteine cathepsins in human cancer [J]. Biol Chem, 2004, 385(11): 1017-1027.
[4] Gocheva V, Zeng W, Ke D, et al. Distinct roles for cysteine cathepsin genes in multistage tumorigenesis [J]. Genes Dev, 2006, 20(5): 543-556.
[5] Hou WS, Brömme D, Zhao Y, et al. Characterization of novel cathepsin K mutations in the pro and mature polypeptide regions causing pycnodysostosis [J]. J Clin Invest, 1999, 103(5):731-738.
[6] Costa AG, Cusano NE, Silva BC, et al. Cathepsin K: its skeletal actions and role as a therapeutic target in osteoporosis [J]. Nat Rev Rheumatol, 2011, 7(8): 447-456.
[7] Szumilo J, Burdan F, Zinkiewicz K, et al. Expression of syndecan-1 and cathepsins D and K in advanced esophageal squamous cell carcinoma [J]. Folia Histochem Cytobiol, 2009, 47(4): 571-578.
[8] Kleer CG, Bloushtainqimron N, Chen YH, et al. Epithelial and stromal cathepsin K and CXCL14 expression in breast tumor progression [J]. Clinl Cancer Res, 2008, 14(17): 5357-5367.
[9] Yan X, Takahara M, Xie L, et al. Cathepsin K expression: a useful marker for the differential diagnosis of dermatofibroma and dermatofibrosarcoma protuberans [J]. Histopathology, 2010, 57(3): 486-488.
[10] Bühling F, Waldburg N, Gerber A, et al. Cathepsin K expression in human lung [J]. Adv Exp Med Biol, 2000, 477(477): 281-286.
[11] Troen BR. The regulation of cathepsin k gene expression [J]. Ann N Y Acad Sci, 2006, 1068(1): 165-172.
[12] Reghellin D, Poletti V, Tomassett S, et al. Cathepsin-K is a sensitive immunohistochemical marker for detection of micro-granulomas in hypersensitivity pneumonitis [J]. Sarcoidosis Vasc Diffuse Lung Dis, 2010, 27(1):57-63.
[13] 尹晓, 陈述林, 刘志芬,等. 肥胖症患者脂肪组织中组织蛋白酶K的表达及其功能初探[J]. 中国糖尿病杂志, 2008, 16(5):265-266.
Yin X, Chen SL, Liu ZF, et al. Investigation of the expression and the function of cathepsin K(CTSK) gene in obesity subjects [J]. Chin J Diabetes, 2008, 16(5): 265-266.
[14] 移丽珍, 温宣, 薛洋. 组织蛋白酶K与口腔颌面部疾病 [J]. 口腔医学, 2015, 35(10): 881-884.
Yi LZ, Wen X, Xue Y. Cathepsin K and stomatognathic diseases [J]. Stomatology, 2015, 35(10): 881-884.
[15] 张艳, 金蓉, 刘伟. Cathepsin K基因siRNA的筛选及其质粒载体的构建 [J]. 组织工程与重建外科杂志, 2009, 5(5): 256-259.
Zhang Y, Jin R, Liu W. Experimental study on siRNA screening of cathepsin K gene and construction of its plasmid vector [J]. J Tissue Eng Reconstr Surg, 2009, 5(5): 256-259.
[16] 谢婉, 刘明君, 何剑雄,等. 陆川猪黑皮质激素受体4基因克隆及序列分析 [J]. 中国畜牧兽医, 2018, 45(2): 320-329.
Xie W, Liu MJ, He JX, et al. Cloning and sequence analysis of MC4R gene in Luchuan pig [J]. Chin Anim HusbandryVet Med, 2018, 45(2): 320-329.
[17] Fontanesi L, Scotti E, Buttazzoni L, et al. A single nucleotide polymorphism in the porcine cathepsin K (CTSK) gene is associated with back fat thickness and production traits in Italian Duroc pigs [J]. Mol Biol Rep, 2010, 37(1): 491-495.
[18] 张艳, 柴岗, 刘伟,等. CathePsin K基因慢病毒质粒载体的构建 [J]. 组织工程与重建外科杂志, 2005, 1(3): 165-166.
Zhang Y, Chai G, Liu W, et al. Construction of cathepsin K lentivirus plasmid [J]. J Tissue Eng Reconstr Surg, 2005, 1(3): 165-166.
[19] Yang X, Tao C, Shi S, et al. Clinical and animal research findings in pycnodysostosis and gene mutations of cathepsin K from 1996 to 2011 [J]. Orphanet J Rare Dis, 2011, 6(1): 20.
[20] 李菲, 李自军. 血清β-crosslaps、Cathe K水平变化在骨质疏松症诊断中的应用价值 [J]. 天津医科大学学报, 2017, 23(6): 534-536.
Li F, Li ZJ. Application value of serum 13-crosslaps, Cathe K level in diagnosis of osteoporosis [J]. J Tianjin Med Univ, 2017, 23(6): 534-536.
[21] 唐特. 组织蛋白酶K在慢性肾脏病中的检测意义 [J]. 医学理论与实践, 2017, 30(11): 1582-1584
Tang T. The significance of detection of cathepsins K in chronic kidney disease [J]. J Med Theory Pract, 2017, 30(11): 1582-1584.
[22] 袁琳, 类延娜, 李玉子,等. 组织蛋白酶K、胱抑素C与冠心病及其危险因素的相关性 [J]. 中国老年学杂志, 2015, 35(23): 6725-6727.
Yuang L, Rei YN, Li Z, et al. Association of cathepsin K and cystatin C with coronary heart disease and its risk factors [J]. Chin J Geerontol, 2015, 35(23):6725-6727.
[23] Leusink FK, Koudounarakis E, Frank MH, et al. Cathepsin K associates with lymph node metastasis and poor prognosis in oral squamous cell carcinoma [J]. BMC Cancer, 2018, 18(1): 385.
[24] Asagiri M, Hirai T, Kunigami T, et al. Cathepsin K-dependent Toll-like receptor 9 signaling revealed in experimental arthritis[J]. Science, 2008, 319(5863): 624-627.
[25] Chiellini C, Costa M, Novelli SE, et al. Identification of cathepsin K as a novel marker of adiposity in white adipose tissue [J]. J Cell Physiol, 2003, 195(2):309-321.
[26] Xiao Y, Junfeng H, Tianhong L, et al. Cathepsin K in adipocyte differentiation and its potential role in the pathogenesis of obesity. [J]. J Clin Endocrinol Metab, 2006, 91(11):4520-4527.
[27] 吴延军, 夏攀洁, 严雪瑜,等. 高脂高糖饲料联合低剂量链脲佐菌素(STZ)诱导广西巴马小型猪2型糖尿病动物模型的建立 [J]. 基因组学与应用生物学, 2017(6): 2393-2398.
Wu YJ, Xia PJ, Yan XY, et al. Combination of high fat/high carbohydrates diet and low-dose streptozotocin-(STZ) induced a model for type 2 diabetes in Guangxi Bama mini-pig [J]. Genom Appl Biol, 2017(6): 2393-2398.
[28] 李艳君, 宋少锐, 郭亚芬,等. 广西巴马小型猪动脉粥样硬化模型的制作 [J]. 中国畜牧兽医, 2015, 42(7): 1770-1776.
Li YJ,Song SR,Guo YF, et al. Preparation of atherosclerosis model using Guangxi Bama mini-pig [J]. Chin Animal Husband Vet Med, 2015, 42(7): 1770-1776.

