5-(4-羟基-3-甲氧基苯亚甲基)罗丹宁对大鼠脑缺血再灌注损伤的保护作用及机制研究
刘自然,霍东升,贾建新,杨占君
(包头医学院解剖教研室,内蒙古 包头 014000)
现代生活中,脑血管疾病具有高发病率,高致残率,高死亡率的特点,严重危害人类的健康[1]。急性缺血性脑血管病治疗的关键是早期疏通阻塞血管, 目前证实的有效治疗是静脉注射重组组织型纤溶酶原激活剂溶栓[2]。但该治疗方法仅仅对于那些缺血时间在6 h内的病人有效,治疗获益有时间依赖性,其治疗效果仍有较大的提升空间[3]。脑缺血区再灌注血流会引起脑组织细胞的损伤和功能障碍,因此,防治脑缺血再灌注损伤就显得极为重要。
罗丹宁衍生物具有广泛的药理活性。通过对杂环的修饰,可有抗凋亡,抗菌,抗病毒,抗炎,抗氧化等作用[4]。前期课题组已证实,5-(4-羟基-3-甲氧基苯亚甲基)罗丹宁(RD-1)具有良好的抗帕金森病作用[5]。本研究通过线栓法制备脑缺血再灌注损伤大鼠模型,对模型大鼠神经功能缺损症状评分用Longa5分法,检测脑梗死体积用TTC染色法,检测SOD,GSH-Px活性,MDA含量,以及Bcl-2,Bax,caspase-3蛋白的表达水平,以探讨罗丹宁对脑缺血再灌注损伤的保护作用机制。
1 材料和方法
1.1 实验动物
清洁级SD雄性大鼠(240~260 g)144只,购于河北医科大学解剖教研室,生产许可证号[SCXK(冀)2016-1-003],使用许可证号[SYXK(冀)2016-24],合格证号:1202176。本研究经内蒙古科技大学包头医学院实验动物伦理委员会批准(包院字20181120),并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
RD-1(北京友谊众生生物科技有限公司),尼莫地平(江苏康缘药业股份有限公司,每片60 mg,批号170401),TTC(2,3,5-氯化三苯基四氮唑)(Sigma公司,美国,批号T8160),超氧化物歧化酶(SOD)(南京建成生物工程研究所,批号A001),谷胱甘肽氧化物酶(GSH-Px)(南京建成生物工程研究所,批号A005),丙二醛(MDA)(南京建成生物工程研究所,批号A003),Bcl-2抗体(碧云天生物科技有限公司,批号AA112-2),Bax抗体(碧云天生物科技有限公司,批号AB026-2),Caspase-3抗体(碧云天生物科技有限公司,批号AC030-2),β-actin抗体(碧云天生物科技有限公司,批号AA128-2),兔抗鼠IgG(北京诺博莱德科技有限公司,批号NRPA24-10)。
TDL-40B型离心机(上海安亨科学仪器厂),Max-M5型酶标仪(美国Molecular Devices公司),恒温水浴锅(天津泰斯特净化设备有限公司),分光光度计(美国Beckman Coulter公司),Mini Protean 3 cell电泳仪(电泳)(美国Bio-Rad公司),DYCZ-24DN电泳系统(转膜)(上海医疗仪器厂)。
1.3 实验方法
1.3.1 模型制备、实验分组及给药
大鼠适应性饲养一周后,术前12 h禁食,不禁水,参照Longa法[6]制成大鼠大脑中动脉缺血模型。大鼠麻醉后,仰卧位固定于手术台上,颈部剪毛,碘伏消毒,右侧颈部旁正中线一做纵行切口,依次切开皮肤、皮下组织和颈阔肌,分离右侧颈总动脉,以及颈内动脉,及颈外动脉,结扎颈总动脉近心端,从颈外动脉或颈总动脉插入栓线,经颈内动脉进入大脑中动脉,栓线插入深度约为20 mm。缺血2 h后,轻轻提拉所留线头至略有阻力,实现大脑中动脉再灌注,造模完成。
大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型制作成功后,随机分为5组,假手术组(Sham group)为1组,共6组,每组6只。分别为:模型组(MCAO group):灌胃给予0.5%羧甲基纤维素钠(CMC-Na)溶液;阳性对照组:灌胃给予尼莫地平(Nimodipine)(10 mg/kg);RD-1低剂量组(RD-1-L group):灌胃给予RD-1 5 mg/kg;RD-1中剂量组(RD-1-M):灌胃给予RD-1 10 mg/kg;RD-1高剂量组(RD-1-H group):灌胃给予RD-1 20 mg/kg;假手术组(Sham):灌胃给予0.5%羧甲基纤维素钠溶液。各组大鼠连续给药14 d。
1.3.2 神经行为学评分及脑梗死体积测定
恢复血液再灌注24小时以后,参照Longa 5级4分制评分原则:①0分,正常,无神经系统异常的体征。②1分,不能完全伸展病变对侧上肢。③2分,行走时向对侧旋转。④3分,行走时向对侧倾倒。⑤4分,无自发活动伴意识降低。得1~4分者为成功模型。术中意外死亡、再灌注24 h内死亡、蛛网膜下腔出血的大鼠被剔除并随机补充。
模型成功的大鼠断头取脑,置于-20℃冰箱冰冻约10 min,然后将脑组织间隔2 mm冠状切5刀,切成6个大脑连续的冠状切面。然后将大脑切片置于5 mL含1%TTC的PBS溶液中,在37℃恒温箱内避光孵育,约30 min,间隔10 min将大脑切片翻动一次。取出脑片放入4%多聚甲酵中固定后拍照保存,应用Image Pro Plus 6.0图像分析软件处理并作统计,计算每张脑片的梗死面积并根据脑片厚度计算相对梗死体积。
1.3.3 脑组织氧化因子检测
取各组大鼠大脑缺血侧大脑皮层组织,以 1 g∶9 mL 的比例加入冰生理盐水,制成 10%的脑匀浆液。置于 4℃离心机 2500 r/min 离心 15 min,取上清液。按各个试剂盒说明书中的操作说明进行检测脑组织SOD,GSH-Px活性及MDA含量。
1.3.4 蛋白免疫印迹法(Western blot)检测相关凋亡蛋白的表达
取大鼠脑组织加入蛋白酶抑制剂和RIPA裂解液,低温下制备脑组织匀浆,4℃离心后取上清,用BCA法测总蛋白浓度,以20 μg总蛋白上样,10%分离胶电泳后转膜至硝酸纤维素膜上,经5%脱脂牛奶封闭,漂洗等步骤后,一抗Bcl-2(1∶1000)、Bax(1∶1000)、caspase-3(1∶1000)室温孵育2 h,辣根过氧化物酶标记二抗(1∶2000)室温孵育1 h,化学发光试剂显色后,曝光拍照,利用Image J进行图像灰度值处理。
1.4 统计学方法

2 结果
2.1 罗丹宁对大鼠神经行为学评分及脑梗死体积比的影响
术后对各组大鼠用药后1、3、7和14 d进行评分。初时(1~3 d)明显观察到术后模型成功的大鼠有健侧前肢屈曲和肢体肌无力,自由运动时不能直线行走,向健侧转圈,严重者会向患侧倾倒。假手术大鼠未显示出神经损伤的迹象。 随着时间的延长,各组大鼠均恢复,但与假手术组比较,模型组术后各时段神经功能缺损评分仍显着增高,且损伤较重。(P<0.05)。各给药组大鼠与模型组大鼠评分差异无统计学意义。 第14天,RD-1低、中、高剂量组大鼠的评分显著低于模型组(P<0.05),阳性药物尼莫地平也对模型组神经损伤的恢复作用有显著影响。(P<0.05)。与假手术组比较,模型组脑梗死体积明显增加(P<0.05)。 与模型组比较,经RD-1治疗14天后,脑梗死体积明显减小,缺血性损伤得到缓解。通过对MCAO模型大鼠神经功能评分和脑梗死体积测定的综合判断,发现持续给予RD-1 14 d可显著改善脑缺血再灌注损伤,减少神经功能缺损评分,减少脑梗死体积,起到很好的神经保护作用。(图1、图2)
2.2 RD-1对大鼠脑组织抗氧化作用大的影响
模型组脑组织中SOD和GSH-PX活性降低,MDA含量升高。 与假手术组比较,有显著性差异(P<0.05),与模型组比较,除脑组织GSH-Px含量RD-1中剂量组无显著性变化外(P>0.05), 其它各组大鼠脑组织中SOD和GSH-PX活性均显著升高,但MDA含量明显降低(P<0.05),提示RD-1可降低大鼠脑组织氧化应激水平。(图3)

注:图中四组bar依次代表各组大鼠用药后1、3、7和14 d评分情况,与假手术组组比较,*P <0.05,与模型组组比较,#P <0.05。图1 RD-1对MCAO模型大鼠神经功能评分的影响Note. The four groups of bars in the figure represent the scores of rats in each group at 1, 3, 7 and 14 days after treatment. Compared with Sham group, *P<0.05. Compared with MCAO group, #P<0.05.Figure 1 Effect of RD-1 on neurological function scores in MCAO model rats

注:A:假手术组,B:模型组,C:低剂量组,D:中剂量组,E:高剂量组,F:尼莫地平组。与假手术组比较,*P <0.05。与模型组比较,#P <0.05。图2 RD-1对MCAO模型大鼠脑梗死体积比的影响Note. A:Sham group,B:MCAO group,C:RD-1-L group,D:RD-1-M group,E:RD-1-H,F:Nimodipine group. Compared with Sham group,*P <0.05.Compared with MCAO group,#P <0.05.Figure 2 Effect of RD-1 on the volume ratio of cerebral infarction in MCAO model rats
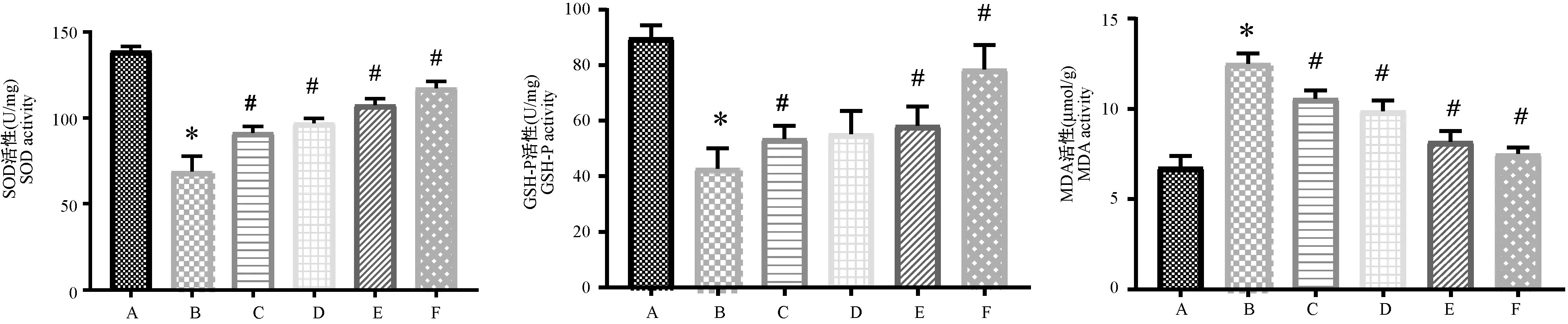
注:A:假手术组,B:模型组,C:低剂量组,D:中剂量组,E:高剂量组,F:尼莫地平组。与假手术组组比较,*P <0.05。与模型组组比较,#P <0.05。图3 RD-1对MCAO模型大鼠脑组织抗氧化作用的影响Note. A:Sham group,B:MCAO group,C:RD-1-L group,D:RD-1-M group,E:RD-1-H,F:Nimodipine group.Compared with Sham group,*P <0.05.Compared with MCAO group,#P <0.05.Figure 3 Effect of RD-1 on the antioxidation in brain tissue in MCAO model rats
2.3 RD-1对大鼠脑组织神经元凋亡相关蛋白表达水平的影响
Western blot结果显示,与假手术组比较,MCAO组Bcl-2表达显著降低,Bax和caspase-3表达显著增高(P<0.05)。 与MCAO组相比,尼莫地平组和RD-1低,中,高剂量组Bcl-2水平显著升高,Bax和caspase-3水平显著降低(P<0.05),提示RD-1可通过影响细胞中Bcl-2,Bax和caspase-3的水平影响细胞凋亡。进而达到脑缺血再灌注后神经元保护的目的。
3 讨论
在本研究中,通过线栓建立大鼠大脑中动脉闭塞模型,并在缺血2 h后再灌注。连续给药14 d后,进行一系列行为学测试和梗塞体积计算以评估RD-1抗脑缺血再灌注损伤作用的药效学效应。建立脑缺血再灌注损伤动物模型是进行缺血性脑病实验的基础,栓线制备大鼠脑缺血再灌注模型[7]。因其损伤小,操作简便,缺血部位恒定,可准确控制缺血和再灌注时间等特点得到国内外广泛的应用[8-13],评分从功能角度反映脑缺血的病理损伤,梗死体积评价了脑缺血造成的组织损伤,目前应用较多的大鼠神经损伤严重程度评分标准可以对大鼠进行全面综合的评价,分数越高表明损伤越严重。与假手术组比较,模型组神经评分和脑梗死体积明显增加。RD-1药物组与模型组相比,神经评分和脑梗死体积明显减少,提示RD-1能改善模型大鼠的神经功能缺损症状,降低脑梗死体积比。表明RD-1对大鼠脑缺血再灌注损伤具有一定的保护作用。

注:A:假手术组,B:模型组,C:低剂量组,D:中剂量组,E:高剂量组,F:尼莫地平组。与假手术组组比较,*P <0.05。与模型组组比较,#P <0.05。图4 RD-1对MCAO模型大鼠神经元细胞凋亡的影响(±s,n=6)Note. A:Sham group,B:MCAO group,C:RD-1-L group,D:RD-1-M group,E:RD-1-H,F:Nimodipine group.Compared with Sham group,*P <0.05.Compared with MCAO group,#P <0.05.Figure 4 Effect of RD-1 on neuronal apoptosis in MCAO model rats
脑缺血再灌注可产生大量的氧自由基。 神经组织本身缺乏抗氧化物质,富含对氧自由基敏感的多不饱和脂肪酸。 因此,脑细胞最容易受到氧自由基的攻击[14]。SOD广泛存在于各种生物体中,是清除氧自由基中最重要的抗氧化酶; GSH-Px催化过氧化氢分解形成水和氧化的GSH,为维持其正常的结构和功能,从而防止细胞氧化损伤。 MDA是脂质过氧化的最终产物,可间接反映细胞受到自由基攻击的严重程度[15]。本研究中,RD-1各剂量组大鼠脑组织SOD和GSH-Px活性显著升高,MDA含量显著降低,说明RD-1具有降低氧化应激水平的作用。
脑缺血再灌注损伤过程中,神经细胞以凋亡为主要死亡方式,Bcl-2家族发挥了极为关键的调控作用,可以减低凋亡水平,相反,促凋亡蛋白Bax通过破坏线粒体膜的完整性,并激活caspase级联反应,诱导凋亡[16]。本研究结果显示,与假手术组相比,模型组Bcl-2蛋白表达明显降低,Bax和caspase-3蛋白表达明显升高,RD-1给药后,各个剂量组均能明显降低Bax和caspase-3蛋白表达水平,并升高Bcl-2蛋白的表达,提示RD-1有抑制神经细胞凋亡的作用。
综上所述,5-(4-羟基-3-甲氧基苯亚甲基)罗丹宁(RD-1)对脑缺血再灌注损伤具有良好的神经保护作用,其作用机制涉及减轻线粒体损伤,清除氧自由基,抑制神经元凋亡;抑制细胞外钙离子内流和细胞内钙离子释放来防止细胞内钙离子超载所致的平滑肌收缩作用,降低兴奋性氨基酸毒性作用[17];抑制神经元兴奋性,降低能量的消耗,促进神经功能恢复。从而达到改善受损动物的神经功能障碍。

