蛋白和肽类物质跨血脑屏障转运研究进展
解一舟,李玉珍,朱 慧,李宏强
(北京建生药业有限公司,北京 100039)
近几十年来,随着人类平均寿命的增加及生活习惯、生活环境改变等因素,人类神经系统疾病的患病率正在逐年升高[1],根据国内流行病学统计分析,我国颅内肿瘤的患病率为32/10万人,平均年发病率为66/10万人,并呈逐年上升的趋势[2-3]。从理论上讲,药物要首先应能通过血脑屏障(blood-brain barrier, BBB)并在中枢神经系统(central nervous system, CNS)中达到一定的血药浓度,才能发挥一定的作用。在Kastin证明促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)等肽类物质可完整穿越BBB之前,学术界普遍认为肽类物质不能穿越BBB,随着BBB研究的不断深入,越来越多的可跨BBB转运的肽类物质被报道[4]。一些具有脂溶性、一定分子量及特定电荷的小分子物质能够直接从血液扩散穿越BBB进入CNS,极大部分的大分子物质,如重组蛋白等均难以通过扩散的途径穿越BBB[5]。目前已知的跨BBB转运的机制主要包括以下几种:(1)水溶性小分子及其他生命活动所必需的的营养类物质,如氨基酸、葡萄糖等,通过血管内皮细胞血管腔面与基底侧上的转运受体穿越BBB;(2)多肽或蛋白类物质可以通过吸附介导转运、受体介导转运或载体介导转运等途径实现跨BBB转运;(3)小分子量脂溶性物质可经被动扩散途径跨BBB转运进入脑内[4]。尽管经过了数十年的研究,如何使药物高效地穿越BBB依然是治疗CNS疾病的药物研发的难点。由于BBB结构的复杂性,通常需要建立体外模型来开展诸如药物跨BBB转运等研究,文中也会介绍主流的模型及装置,如Transwell装置、NV生物反应器等,同时也比较了它们的优缺点及应用,便于根据不同研究目的选择合适的模型或装置。
肽(peptide)是α-氨基酸以肽键连接在一起而形成的化合物,通常指的是100个氨基酸以下的大分子物质,多肽通常也是蛋白质水解的中间产物。在哺乳动物体中,肽类物质主要由外周脏器或CNS产生,如胰岛素(insulin)、胰高血糖素(glucagon)可调节血糖浓度,神经肽作为CNS的递质在大脑的不同部位发挥着不同的生理作用,如痛觉、睡眠、情绪、学习、摄食、痛觉等均有调节作用,另外,神经系统本身的分化和发育也受神经肽的调节。
1 已发现的可通过BBB的多肽或蛋白类物质
1.1 神经营养因子
神经营养因子(neurotrophin, NT)对CNS的创伤性、退化性和缺血性疾病均具有治疗潜力,如NGF、NT-3、NT-4/5及脑源性神经营养因子(brain derived neurotrophic factor, BDNF)均可被选择性地输送至脑内[5],而另外某些神经营养因子却不能跨BBB转运,如人类胶质细胞衍生神经营养因子(human glia-derived neurotrophic factors)等[6]。
1.2 神经营养肽
上表皮生长因子(epidermal growth factor, EGF)[7]神经生长因子(nerve growth factor, NGF)、的胰岛素样生长因子(insulin-like growth factor, IGF)[8]等神经营养多肽(neurotrophic peptides)可通过饱和运输系统穿越BBB,碱性成纤维母细胞生长因子(basic fibroblast growth factor)可能通过吸附胞吞的作用跨BBB转运[9]。EGF是通过结合一个170 kD的酪氨酸特异性蛋白激酶(tyrosine-specific protein kinase)来向脑内运输的[10]。
1.3 细胞因子
细胞因子(cytokine)具有调节固有免疫和适应性免疫、细胞生长以及损伤组织修复等多种功能。白血病抑制因子(leukemia inhibitory factor)通过饱和转运系统或原位脑灌注跨BBB转运至脑内[11],可以改变NT-3的表达、减少少突细胞的死亡,也可用于改善卢伽雷病的症状[12]。
1.4 作用于摄食行为的多肽
一般情况下,瘦素(leptin, LP)会被完全转移至大脑中,此类多肽是LP作用的主要受体。其在下丘脑的核团上高度表达,而这些核团具有调节摄食与体重的功能,在一些外周组织如心、肺、淋巴结中也有表达。短受体在多种外周器官中选择性地表达[13]。这类多肽在体内表达最广泛,其他多肽如胰肽(pancreatic polypeptide)、促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRF)是通过饱和转运系统转运[14],甘丙肽样肽(galanin-like peptide)[15]、食欲肽A(orexin-A)[16]等都是通过非饱和途径转运的。
1.5 阿片肽
阿片肽是免疫系统中重要的调节因子,它几乎作用于所有的免疫活性细胞,对不同亚类的细胞作用却不尽相同,阿片肽可能是应激引起免疫调节的介质。阿片肽、甲硫脑啡肽都是通过肽传输系统-1(peptide transport system-1)转运的[17],也可以通过改变化合物的理化性质来实现跨BBB转运[18]。
1.6 激素或其他蛋白
CRF是通过饱和转运系统来影响垂体及下丘脑产生脑内啡的[19],在大脑中存在一个胰岛素(insulin)的饱和转运系统,受体相关蛋白(receptor-associated protein)也可以透过BBB转运至脑组织。抗原结合片段(fragment of antibody binding,FAB)、单克隆抗体(monoclonal antibody,MAb)、IgG、白蛋白(albumin)、P-糖蛋白(P-glycoprotein)、脑啡肽、糖肽等蛋白也可通过改变BBB通透性或化合物的理化性质来实现跨BBB转运[20]。
2 多肽类物质的转移机制
外周注射入血的多肽类物质透过BBB的机制主要是不饱和的跨膜扩散,如δ-促睡眠肽(delta-sleep-inducing peptide,DSIP)及其类似物、类固醇类等药物,跨BBB转运能力主要取决于药物的脂溶性[5]。随着研究的不断深入,越来越多的实验数据证明,较脂溶性,氢键键能对多肽类物质透过BBB的影响更大[21],同一种多肽,氢键构象的改变可引起氢键键能的改变[22],所以亲水性较强的DSPI也能跨BBB转运。某些多肽如亮氨酸脑啡肽、精氨酸加压素、黄体生成素释放激素等还可以通过饱和转运系统来透过BBB,这种机制被称为肽转运系统[23],在BBB中,区域差异(大脑的不同区域)也会影响到的肽或蛋白质向脑内的传输[24]。大多数亲水性多肽的扩散能力是有限的,然而,选择性饱和转运系统通常能够更高效的运输一些亲水性多肽[14],转运机制又可细分为吸附介导转运、受体介导转运、载体介导转运等多种形式,吸附介导转运中的胞吞作用的强弱与多肽的带正电部分和带负电的细胞膜表面之间的静电作用大小有关[25]。吸附介导转运易受到聚L-赖氨酸、丹酰尸胺、鱼精蛋白[26]等的抑制。受体介导转运具有更高的亲和力及底物特异性,但是传输能力较吸附介导转运低[13]。载体介导转运运输能力的强弱与具有交叉抑制活性的结构性配体有关[14]。此外,依附于蛋白上的IGF及其聚合物也会影响多肽跨BBB转运的能力[6]。大脑内不同区域的酶活力是不尽相同的,这就为我们提供了一种通过调节进入大脑不同区域物质的量来调节多肽类物质穿越BBB的方法[27]。通常情况下,可能只有很少量的肽类物质可以跨BBB转运至CNS内,但足以引起一定的生理反应。
3 改变大分子肽类药物跨BBB能力的途径
多肽或蛋白类药物在CNS疾病的治疗中具有一定的意义,经常会因BBB的屏障作用难以在脑内达到有效血药浓度而影响药物的疗效。因此,提高药物穿越BBB的能力显得尤为重要。
3.1 渗透性BBB开放
最直接的方法就是对BBB进行可逆性的开放[28],最常用的方法是在颈动脉注射如甘露醇、阿拉伯糖等高渗溶液(即渗透性休克),能使伊文思蓝跨BBB转运并对脑组织进行染色,1988年Neuwelt等通过渗透性开放BBB的实验证明了FAB或MAb均可以通过此方法进入脑组织,但同时,这种非特异性的方法也会让一些有害物质进入到脑内[20]。
3.2 改变药物的理化性质
多肽类物质跨BBB转运的能力与多肽的亲脂性、分子大小、氢键键能等有关。一般来说,亲脂性越强,穿透能力也越强,氢键键能越低,穿透能力越强,因此,可以通过改变多肽的物理化学性质来提高多肽类药物通过BBB的能力。一系列实验证明降低氢键键能可以提高P-糖蛋白(P-glycoprotein)的跨BBB转运量[29],糖基化的方法可提高阿片肽跨BBB转运的量以期增加药效[30]、脑啡肽、糖肽、阿片肽等通过聚乙二醇化[18]的方法可提高其跨BBB转运的能力,神经生长因子(nerve growth factor, NGF)和IgG糖基化后的跨BBB能力均有明显提高[21],胰岛素(insulin)、白蛋白(albumin)、IgG经聚酰胺修饰后跨BBB的转运能力会大大增强[31],脂质体、免疫脂质体的应用也是这一想法的延伸。另外,脑毛细血管内皮带有负电荷,因此可以使多肽带正电荷以提高其跨BBB能力,总之,在改变多肽的物理化学性质的同时要保留或增强其疗效,需要进行更加深入的研究。
3.3 借助药物转运载体
将多肽与特殊的载体结合,可以提高其跨BBB转运的能力。最近十几年,陆续有文献报道,用腺相关病毒,逆转录病毒,单纯疱疹病毒以及牛痘病毒等作为载体CNS疾病,如神经退行性疾病、肿瘤及中风[32],在此过程中用甘露醇打开BBB通道以增加转运的量[33],病毒载体与神经营养蛋白相结合可以促进背根神经轴突到脊髓等细胞定位再生,如NT-3可借助腺病毒作为载体提高转运能力[34]。转铁蛋白、低密度脂蛋白、胰岛素等及其受体、抗体也可以作为多肽类药物跨BBB的转运载体[26, 35],此外,如阳离子化的人血清白蛋白 (human serum albumin)[36]、转铁蛋白的单克隆抗体OX26[37]都可以作为良好的脑药物转运载体,最新的研究发现细胞穿透肽(cell penetrating peptides, CPP)、蛋白质转导域(protein transduction domain, PTD)能促进细胞对其所携带的各种物质的摄取[38],因此将多肽类药物制成纳米颗粒并且通过与CPP或PTD的结合达到跨BBB转运的目的成为了一个研究热点。
4 血脑屏障体外模型及体外装置
BBB的结构十分复杂,因此其通透性的研究常常借助体外模型来实现。通过查阅文献,可以将体外模型大致划分为静态模型和动态模型两种类型,这两种类型又可以细分为不同的类型。
4.1 静态模型
静态模型根据所培养细胞种类的不同,大致可分为单层模型及共培养模型[39],因其不能模拟在体内环境下血液流动产生的切应力,故其更适用于研究信号通路、转运动力学、高分子筛以及结合亲和力的测量、细胞与细胞间、细胞与内环境间的相互作用等的研究,其突出的优点为操作简单。
4.1.1 单层模型
将单一类型的内皮细胞[40]如脑微血管细胞(brain microvascular endothelial cells, BMEC),培养于Transwell膜上所构建的BBB模型,基本可模拟BBB功能,牛、猪等大型动物细胞比大鼠更适合建立体外BBB模型[41]。单层模型根据培养细胞来源的不同主要有脑微血管碎段模型[41]、MDCK细胞模型[42]、永生化细胞模型[43]、原代BMEC模型等。单层模型的关键是要对细胞进行纯化,常见的纯化方法有筛网过滤、差速贴壁及摇床振摇[44]、免疫磁珠纯化、Percoll离心纯化等[45]。
4.1.2 共培养模型
为避免单独培养的细胞丧失BBB的活性,加入其他细胞尤其是星形胶质细胞能更好地模拟在体环境[46]。下面以三种共培养模型举例:(1)微血管内皮细胞+星形胶质细胞共培养模型,其表现型较单层模型更接近于体内生理状态[47],因此能较好地模拟在体环境,是目前应用最广泛的模型。(2)脑微血管内皮细胞+星形胶质细胞+周细胞共培养模型,由于加入了周细胞,较前一种模型可更好地模拟在体状态,通过测量上皮电阻(trans-epithelial electric resistance, TEER)、荧光素钠通透性、碱性磷酸酶及γ-谷氨酰转肽酶的表达等来评价屏障功能[48]。(3)原代培养脑微血管内皮细胞+周细胞模型,此模型缺少星形胶质细胞的功能支持,较少使用,可用于研究两种细胞间的相互作用。此外,BMEC还可以与神经元或其他细胞共培养制备BBB模型,如由BMEC与胶质细胞、海马神经元共培养制备而成的静态三维模型可用于药物筛选。
4.2 动态模型
在体内正常生理状态下,血流流动产生切应力,能够影响内皮细胞的屏障功能,降低单层脑微血管内皮细胞对药物的渗透率。下面介绍三种常见的能够模拟切应力的BBB体外模型:(1)锥板装置模型,利用圆锥旋转来产生一定的切应力[49],切应力受角速度和锥角大小的影响。(2)体外BBB动力学模型,模型中的中空纤维膜可产生一定的切应力,同时模型中也可以共培养其他类型的细胞,用输气管系统实现气体交换来维持微环境的稳定,可用于研究各种CNS疾病的病理生理学,如脑缺血再灌注损伤和癫痫等的改变[50]。(3)三维动力学模型,该模型用变速泵输入液体产生切应力,切应力的产生装置由两个互相垂直的中空纤维管组成,多孔膜内外两侧接种细胞并放置多个Ag/AgCl电极[51],输气管实现O2和CO2交换。其为转运迁移实验的首选,也可应用于神经血管的研究、BBB内信号传导的研究[52]。
除以上所介绍的模型外,很多学者基于细胞层面进行BBB体外模型装置的研发,以期在体外条件下再现BBB的结构、功能和特性,常见BBB体外模型优缺点及其应用详见表1。
5 总结
外周与大脑的大部分交流要依赖BBB。随着神经科学、遗传工程技术、多肽蛋白分子三维结构预测及多肽蛋白分子相互作用研究的不断深入,将会有更多的治疗CNS疾病的多肽或蛋白类物质将被发现并开发成可用于临床的药物。每年有上千种具有生物活性的多肽类物质从动物或细菌中被提取出来,天然多肽又可以通过基因工程、酶工程、糖基化、纳米化等方法进行修饰或克隆,从而获得更多的应用,因此,为增强多肽类药物跨BBB转运的能力,对药物进行必要的化学修饰将成为一个研发的热点,相信在不久的将来,将会有更多的多肽类神经系统药物及给药、释药系统被开发出来并用于临床实践。
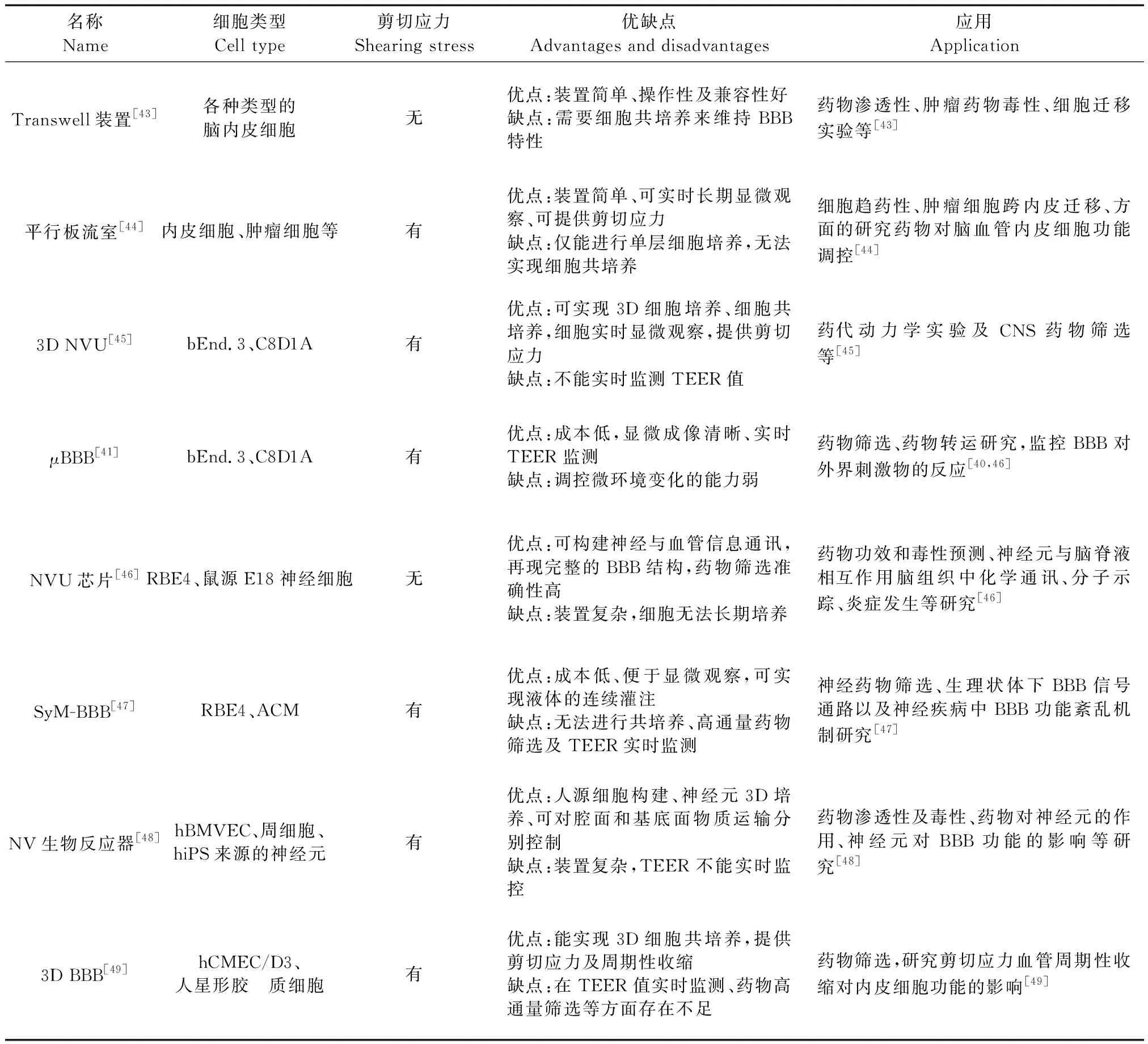
表1 BBB体外模型装置优缺点及其应用[53]Table 1 Advantages and disadvantages of BBB models in vitro and their application

