哺乳动物线粒体DNA的转录过程及其机制
李素芬,王唯斯,杨娜,梅雯,孙美涛,熊伟
1.大理大学 基础医学院,云南 大理671000;2.楚雄州人民医院病理科,云南 楚雄675000;3.杭州医学院 基础医学与法医学院,浙江 杭州310000
人类线粒体基因组的转录机制一直是现代医学的前沿问题。人类线粒体DNA(mitochondri⁃al DNA,mtDNA)的转录过程分为起始、延伸和终止3个阶段,需要许多顺式作用元件和反式作用因子的共同参与[1]。目前,已经基本确认了哺乳动物mtDNA 转录装置的重要组成部分,主要包括线粒体转录因子A(mitochondrial transcription factor A,TFAM)、线粒体转录因子B2(mitochondrial transcrip⁃tion factor B2,TFB2M)、线粒体RNA 聚合酶(mito⁃chondrial RNA polymerase,mtRNAP)、线粒体转录延伸因子(mitochondrial transcription elongation fac⁃tor,TEFM)及线粒体转录终止因子(mitochondrial transcription termination factors,MTERFs)[2]。在mtDNA 转录过程中,除了必要的转录装置成分调控转录外,一些核转录调节因子也可以通过结合mtDNA 来调控转录。本文总结了mtDNA 转录的基本过程和转录因子在mtDNA 转录起始、延伸和终止过程中的作用,以及调控转录的其他因素。
1 mtDNA的结构
mtDNA 是一个环状的DNA,其长度约为16.5 kb,共编码37个基因(图1A)[3],其中D-loop 区为非编码区。重链(heavy strand,H)和轻链(light strand,L)是根据2 条链的G+T 含量不同和变性氯化铯密度梯度而划分的,H 链编码2种rRNA、14种tRNA和12种蛋白质(ND6 除外),L 链编码8种tRNA和ND6 蛋白(图1B)[4-5]。人mtDNA的转录由2个启动子指导,即轻链启动子(light strand pro⁃moter,LSP)和重链启动子(heavy strand promoter,HSP),分别位于相对的mtDNA 链中。
2 mtDNA的转录起始
线粒体转录起始过程是由mtRNAP、TFAM和TFB2M 共同参与进行的。其中mtRNAP 是研究最广泛的线粒体转录相关酶,包含1230个氨基酸残基,是线粒体RNA 转录装置的核心。人类细胞中的mtRNAP只有在辅助因子TFAM和TFB2M的参与下,才能与启动子作用启动转录。TFAM 由2个HMG box 结构域和1个C端尾结构组成,有显著的诱导线粒体DNA 形成U 形转弯的能力,对线粒体与其他转录因子的相互作用至关重要。TFB2M是一个促进mtRNAP 启动线粒体RNA 转录的关键因子,其活性远远高于TFB1M[6]。
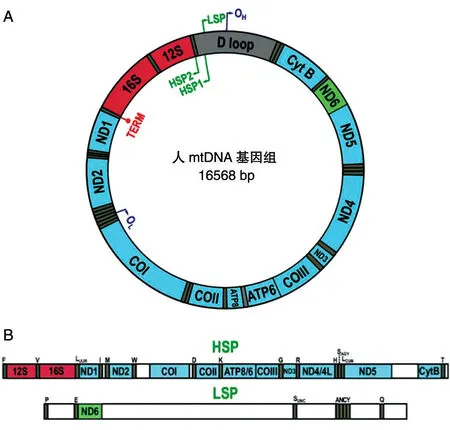
图1 mtDNA的结构及其转录产物
TFAM 作为转录起始阶段的关键因子,能够被mtRNAP 有效识别,通过与转录起始位点上游的特异性结合激活转录,TFB2M 增强了mtRNAP识别转录起始点的能力[7]。TFAM、TFB2M和mtRNAP 三者之间相互作用,TFAM与轻链转录起始点上游弯曲的DNA 结合,其C端激活区与TFB2M 结合,TFB2M 把TFAM和位于启动子处的mtRNAP 连 接在一起[8]。由 于TFAM和mtRNAP 形成的起始复合物不能在没有TFB2M的情况下转录,TFB2M 作为TFAM和mtRNAP的纽带,可以促进DNA 双链开放,结合启动子,以及诱导mtRNAP的构象变化,稳定启动子复合物,从而提高转录起始效率[1]。
3 mtDNA的转录延伸
转录起始激活后,TEFM 参与转录延伸过程,在体内和体外提高线粒体基因转录延伸的效率和转录活性[2,9]。已有研究表明,保守序列块Ⅱ(conserved sequence blockⅡ,CSBⅡ)是存在于人mtDNA 中的非常重要的转录调节序列,含有富含G的基序序列,在转录终止过程中起关键作用[3]。当mtRNAP 通过CSBⅡ转录时,可以与TEFM 结合形成一种发夹结构G-四链体(G-quadruplex),从而触发转录终止。TEFM 是调控mtDNA 复制和转录转换的关键分子开关。当无TEFM 时,G-四链体的形成使mtRNAP 可在轻链原点附近停止,产生小的RNA片段,作为复制引物,这时mtDNA 开始复制;当有TEFM 时,阻止发夹结构G-四链体的形成,mtRNA 通过CSBⅡ继续转录。
在mtRNAP 介导的转录延伸过程中,mtRNAP和模板DNA 及转录产物RNA 紧密结合,形成一个非常稳定的延伸三维复合物(elongation complex,EC)[10]。研究发现,在没有TEFM的情况下,EC 不稳定,解离与合成非常迅速,但效率低下;TEFM存在时,EC 会继续延长。进一步的研究表明,TEFM 能够决定mtRNAP 产生长的转录本[2]。通过RNA 干扰敲低TEFM后,H 链和L 链启动子远端线粒体转录物的水平降低,并伴随着哺乳动物细胞的氧化呼吸链缺陷[5]。Jiang 等在小鼠中敲除TEFM,证实了TEFM 对线粒体转录延伸和RNA 加工的过程至关重要[11]。
4 mtDNA的转录终止
MTERF 由核基因编码,以单体形式弯曲DNA从而与mtDNA 特异性结合。人MTERF1 是在人线粒体中发现的MTERF 家族第一个转录因子,在线粒体转录中起终止作用。在体外,磷酸化的MTERF1 结合特异的mtDNA 能达到最大的转录终止活性,且不需要其他蛋白因子协助终止[12]。
目前已基本明确,转录终止区域(transcrip⁃tion termination region,TERM)为16S rRNA基因与tRNALeu(UUR)基因分界处一段28bp的序列,MTERF1与该区域特异性结合,引起HSP1 启动的转录终止。已有研究证明,MTERF1在体外还可以高效终止HSP2 启动的转录,以促进rRNAs的合成[13]。MTERF1 控制了从HSP2 到16S rRNA的转录,产生mtDNA 转录环,有助于促进转录因子循环利用和转录反复进行,提高转录速度,使上游rRNA基因的转录水平较下游基因高15~60倍,同时也更容易重新起始转录[13]。MTERF1 特异性识别鸟嘌呤残基进行转录终止,当机体发生线粒体肌病脑病伴乳酸中毒血症及卒中样发作综合征(mitochondrial encephalomyopathy,lactic acidosis,and stroke-like episodes,MELAS)等线粒体疾病时,这种作用会被阻遏[14]。研究发现,MTERF1 中间的结合位点A3243G 突变可以减低MTERF1与DNA的亲和力,从而达到降低转录终止的作用。然而,小鼠体内基因敲除实验表明,MTERF1 能结合双向终止位点,可以完全终止轻链的转录,但重链的转录终止可能还需要MTERF1 以外的蛋白质参与,其具体发生机制目前尚未清楚[6]。
5 mtDNA的转录调控
除了mtDNA 转录机制装置中的核心元件外,细胞核中的某些因子也被导入线粒体与mtDNA结合并直接调控其转录[15-16]。早期研究发现,甲状腺激素可以与D-loop 区和12S rRNA基因结合,并在线粒体定位[17]。此外,研究证实,线粒体cAMP反应元件结合蛋白(cAMP response ele⁃ment binding protein,CREB)与线粒体D-loop 区的DNA 结合,促进mtDNA基因表达[18-20]。与线粒体D-loop 区结合调控转录的还有细胞信号转导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)[21]、组蛋白乙酰转移酶MOF[22]、活化T细胞核因子1(nuclear factor of ac⁃tivated T-cells,cytoplasmic 1,NFATc1)[23]、DNA 甲基转移酶(DNA methyltransferase 1,Dnmt1)[24],其中Dnmt1 可以降低mtDNA 转录水平。后来研究证明肌细胞增强因子2D(myocyte enhancer fac⁃tor 2D,MEF2D)可以与线粒体ND6 结合并在体内调控转录[25]。最近,多重染色质免疫沉淀实验与深度测序联合,揭示了c-Jun、JunD和CEBP-β在体内与mtDNA 结合及其在体内的线粒体定位[26],其中c-Jun和CEBP-β与线粒体的ND4 结合,c-Jun 还和JunD与线粒体的ND3 结合。除了通过直接结合mtDNA 调节转录,核转录调节因子可以通过调节线粒体转录因子来调控转录。研究发现,核呼吸因子(nuclear respiratory factor,NRF)NRF1和NRF2 可以控制TFB2M和mtRNAP 从而调控转录[27-28]。过氧化物酶体增殖物激活受体γ共激活因 子1(peroxisome proliferator-activated receptor γ coactivator-1,PGC1)家族的PGC1α、PGC1β和PRC 依次调节NRF1[29-30]、NRF2[31-32]和转录阻遏蛋白Ying-Yang 1(YY1)[33],从而影响线粒体基因表达。其中PGC1α可以通过在mtDNA D-loop 区与TFAM 形成复合体来增加线粒体基因在高能量需求期间的表达[34]。此外,线粒体核糖体蛋白L12(mitochondrial ribosomal protein L12,MRPL12)通过控制mtRNAP 稳定性调节线粒体转录过程[35],其表达与线粒体转录物的稳态水平相关[36-37]。有研究证明,线粒体转录也受线粒体ATP 浓度变化的影响,高浓度的ATP 抑制体外mtRNAP的活性,正常浓度的ATP 激活转录,极低浓度的ATP 阻止转录起始[38]。此外,还有研究发现mtDNA 甲基化可以导致TFAM的翻译后修饰、线粒体类核缩小、限制mtRNAP和TFB2M的作用[39]。已有研究并没有全面描述线粒体转录的调控机制,因此,需要对线粒体转录调控机制进行更加深入地探索。人类mtDNA 调控元件的结合位点参见文献[40]。
6 结语
随着对哺乳动物线粒体功能研究的日益重视,获得了很多线粒体转录因子的结构信息和调控线粒体转录的机制。这些研究使人们对线粒体转录过程及其机制有了更深入的认识,但仍然有很多调节机制和某些调控的细节并不十分清楚,有待进一步探索。目前,新一代测序技术取得了最新进展,为深入研究线粒体DNA 生物学提供了便利,从而加深对转录机制的认识,并有可能为未来的线粒体基因靶向治疗等提供基础研究数据。

