多柔比星通过Stat3-Oct-4/CD44途径诱导三阴性乳腺癌4T1细胞干性的产生*
钟瑾怡, 成丛丛, 徐金媛, 李雪松, 张 升, 张宝刚, 王丽华, 史立宏, 4△
(潍坊医学院 1药学院, 2附属医院分子肿瘤学实验室, 3病理学教研室, 4山东省应用药理学重点实验室, 山东 潍坊 261053)
雌激素受体、孕激素受体及人表皮生长因子受体均为阴性的三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌中最难治愈的类型,具有较高的复发率和死亡率[1]。目前化疗仍是治疗乳腺癌的主要方法,但是肿瘤细胞极易产生耐药性往往导致乳腺癌预后不佳。对化疗耐药的肿瘤细胞同时具有肿瘤干细胞(cancer stem cells,CSCs)的特征,而乳腺癌干细胞(breast cancer stem cells,BCSCs)是导致乳腺癌发生、复发、耐药及转移的根源。
据报道,CD44是一组广泛分布的跨膜糖蛋白黏附因子,在肿瘤的成瘤、侵袭和转移中起促进作用,与肿瘤的转移和组织分期有紧密的联系,是公认的乳腺癌干细胞标志物;同样为干细胞标志物的CD133,是一种单域糖蛋白,在结肠癌、肺癌和胃癌等许多肿瘤干细胞中均有表达。研究发现,CD133与Oct-4在许多肿瘤中有密切关系[2]。Oct-4是诱导干细胞的一个关键的转录因子,与维持肿瘤干细胞自我更新能力和分化潜能有关,可通过Stat3等通路发挥其生物学作用。Stat3的激活使非CSCs动力学转向CSCs[3-4],可调节Oct-4和SOX2等下游基因以及在肿瘤发生发展中起重要作用的其它信号分子。黄传钱等[5]发现,Oct-4和CD44可对肠癌干细胞特性具有一定的调控作用;但是有关Stat3-Oct-4/CD44通路在化疗药物诱发的乳腺癌细胞干性转化中的作用尚未见报道。
因此,在这项研究中,我们选用具有高度致瘤性和侵袭性的小鼠三阴性乳腺癌细胞系4T1作为模型系统,探讨了Stat3-Oct-4/CD44信号通路在多柔比星(doxorubicin, DOX)诱导的4T1细胞中肿瘤干细胞富集和发展中的作用与机制,从而为三阴性乳腺癌的治疗提供新的理论依据。
材 料 和 方 法
1 试剂
将DOX(Sigma)溶解于10 mmol/L储备液的无菌水中;WP1066(Selleckchem)在50 mmol/L和5 g/L储备液的DMSO(Solarbio)中溶解;CD133和CD44抗体(Proteintech);10%FBS、1%青霉素/链霉素、RIPA 裂解液和PMSF(Solarbio);RPMI-1640培养基(HyClone);聚偏二氟乙烯膜(Millipore);PE-CD44抗体(BD Biosciences)。
2 细胞系和培养
小鼠乳腺癌4T1细胞和人乳腺癌MDA-MB-468细胞购自ATCC,在含10%FBS和1%青霉素/链霉素的RPMI-1640培养基中,于37 ℃、5%CO2恒温培养箱培养。
3 方法
3.1成球分析 肿瘤成球实验在低黏附的培养皿(Corning)进行。将细胞以每孔8 000个细胞的密度接种,培养液中加入B27(Gibco)、N-2(Gibco)、EGF(PeproTech)20 μg/L、IGF(PeproTech)20 μg/L、10 μg/L bFGF(PeproTech)和5 mg/L肝素(Solarbio),培养7 d后,在400×的倒置显微镜下观察。
3.2免疫荧光染色 分别将爬满4T1-DOX和4T1细胞的盖玻片固定在4%多聚甲醛10 min。用1×PBS缓冲液中洗涤3次,然后使用山羊血清封闭1 h。细胞与抗CD133抗体在4 ℃孵育过夜。在PBS中洗涤后,将细胞在37 ℃下在 II 抗中孵育1 h。用PBS洗涤细胞,用DAPI染色10 min,再洗涤3次,然后用封固介质覆盖。200倍视野下观察免疫荧光染色并照相。
3.3Western blot分析 提取实验细胞蛋白。细胞用RIPA 与PMSF混合液裂解,然后在4 ℃、12 000 r/min 离心15 min。收集上清液,用BCA法测定蛋白质浓度。通过SDS-PAGE分离蛋白质并转移至聚偏二氟乙烯膜。然后孵育 I 抗4 ℃、12 h,然后与辣根过氧化物酶标记的 II 抗37 ℃下反应1 h。使用增强的化学发光试剂ECL发光并在暗室曝光胶片。
3.4流式细胞术 将4T1-DOX细胞和4T1细胞消化、PBS洗涤并以1010/L的浓度重悬于PBS中。将细胞悬浮液与PE-CD44抗体孵育30 min,并用PBS洗涤样品。并进行流式细胞术(FACSCalibur)检测;将同种型匹配的小鼠免疫球蛋白作为对照。
4 统计学分析
数据以均数±标准差(mean±SD)表示,采用GraphPad软件进行统计分析,并用t检验进行评估。以P<0.05为差异有统计学意义。
结 果
1 低浓度多柔比星诱导4T1细胞产生耐药性
4T1细胞分别与不同浓度(0、0.05、0.1和0.5 μmol/L)的多柔比星孵育24 h后观察细胞形态变化,结果显示,0.05 μmol/L多柔比星可使细胞体积略有增大; 而浓度为0.1 μmol/L时,4T1细胞体积显著增大,且大部分细胞存活;当浓度增加到0.5 μmol/L时,几乎所有的细胞都被破坏,观察到许多坏死细胞,见图1。因此,我们以0.1 μmol/L多柔比星为最适浓度用于后续实验。
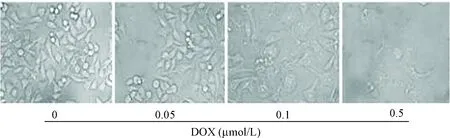
Figure 1.The cell morphological changes after continuous stimulation with different concentrations of doxorubicin (DOX; ×400).
图1不同浓度的多柔比星持续刺激后4T1细胞的形态观察
2 多柔比星诱导的4T1细胞表现出干细胞样特征
我们通过成球实验来评估4T1-DOX细胞的成球能力,在多种细胞因子的作用下,4T1-DOX细胞形成球体的数量明显增多,且体积较4T1细胞显著增大;同时我们用人乳腺癌MDA-MB-468-DOX细胞进行成球实验,发现实验结果与4T1细胞相一致,MDA-MB-468-DOX细胞形成球体的体积较MDA-MB-468显著增大,见图2A。这一结果表明4T1细胞经过多柔比星长期诱导产生耐药性后表现出干细胞样特征。同时,我们检测特异性CSCs标志物CD44和CD133在4T1细胞和4T1-DOX细胞表面的表达,流式细胞术分析检测发现4T1-DOX细胞中CD44的表达远高于4T1细胞,见图1B。免疫荧光检测发现4T1-DOX细胞中CD133的表达水平较4T1细胞显著增高,见图1C。4T1-DOX细胞中CD44和CD133的高表达进一步表明连续的多柔比星刺激诱导了BCSCs在4T1细胞中的富集。
3 4T1-DOX细胞中p-Stat3与Oct-4的表达增加
为了研究Stat3是否参与多柔比星诱导的肿瘤干细胞富集,我们测试了Stat3的表达和活化。Wes-tern blot结果显示,尽管4T1-DOX细胞与4T1细胞之间总Stat3表达水平没有显著变化,但是在4T1-DOX细胞中磷酸化的Stat3明显升高(P<0.05);同时多能转录因子Oct-4在4T1-DOX细胞中的表达较4T1细胞明显增高(P<0.05),见图3。这一结果提示多柔比星可能通过Stat3-Oct-4途径参与了4T1细胞中多柔比星诱导肿瘤干细胞形成的调控。
4 抑制Stat3的活化后Oct-4与CD44的表达降低
为了进一步验证上述结论,我们应用Stat3活化的抑制剂WP1066来进一步观察Stat3在多柔比星诱导4T1细胞干性转化中的作用,结果显示,WP1066(1.25 μmol/L)能够显著抑制Stat3的磷酸化,p-Stat3蛋白水平明显减少(P<0.05);随着Stat3的激活被抑制,Oct-4在4T1-DOX细胞的表达量也相应降低(P<0.05),见图4A。流式细胞术检测结果显示,WP1066处理后,4T1-DOX细胞中的CD44+细胞数显著减少(P<0.05),见图4B;同时,成球实验结果提示,WP1066抑制Stat3的活性后,4T1-DOX细胞的球体体积也随之减小(P<0.05),见图2A。这些结果表明抑制Stat3的活性后,干性相关转录因子Oct-4的表达随之发生下调,同时干性标志分子CD44的表达也明显下降,提示Stat3在多柔比星诱导的4T1细胞CSCs富集中发挥关键作用。
讨 论
Bonnet等[6]的工作最早确认了肿瘤干细胞的存在,随后肿瘤干细胞在肿瘤发生发展以及肿瘤的治疗抵抗等方面的作用广泛展开。肿瘤干细胞具有极强的增殖分化能力,对化疗药物具有较强的耐药性,成为肿瘤转移和复发的根源,只有针对肿瘤干细胞进行特定治疗,才能从根本上治愈癌症。因此,寻求高特异性的肿瘤干细胞的治疗靶点从而设计高效的靶向药物成为癌症治愈的关键。
本研究表明低浓度的多柔比星(0.1 μmol/L)持续刺激诱导4T1-DOX细胞的体积增大,成球能力增强,提示三阴性乳腺癌细胞中具有肿瘤干细胞样特性的细胞;同时,干细胞标志物CD44与CD133在4T1-DOX细胞中表达增高,进一步证明了低浓度的多柔比星诱导促进了4T1细胞中BCSCs的富集。Zhao等[7]发现肝细胞癌预后不佳与肿瘤干细胞标志物CD44和CD133在细胞中呈高表达有关,这与我们的实验结果一致。
Stat3是一类与酪氨酸磷酸化传导途径相关的功能性蛋白,在细胞增殖、分化、凋亡与免疫逃逸中发挥重要作用;参与乳腺癌肿瘤转移、复发及血管的形成,是球囊形成和CSC过程的关键介质。Lin等[8]实验结果显示,在鼻咽癌中沉默Stat3,可降低CD44的表达,由此可见CD44与Stat3呈正相关。Oct-4通过促进CSCs自我更新在诱导CSCs中发挥重要作用,在许多实体瘤中都高表达[2]。Wang等[9]发现,在宫颈癌干细胞中,Stat3过表达的细胞成球体积比敲除Stat3的球体体积增大;同时,Oct-4在Stat3过表达的细胞中呈现高表达,而在敲除Stat3的细胞中表达减少;表明Stat3可调控Oct-4影响宫颈癌干细胞的形成。有研究提示激活的Stat3在头颈部鳞状癌中的表达高于正常黏膜,同时CD44和Oct-4 的表达也增高,提示Stat3与CD44和Oct-4均呈正相关[10];我们的结果也显示4T1-DOX细胞中p-Stat3、Oct-4及CD44的表达量显著提高,这与文献报道相一致,说明4T1-DOX细胞中Stat3的激活,使下游因子Oct-4和CD44的表达增加,细胞干性增强,促进了BCSCs的富集。
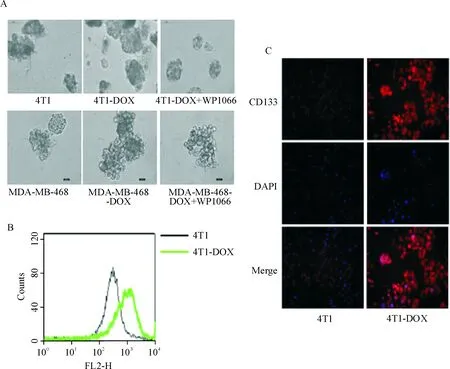
Figure 2.Stem cell-like characteristics induced by doxorubicin (DOX) in the 4T1 cells. A: sphere formation test for 4T1 cells, 4T1-DOX cells, 4T1-DOX cells treated with WP1066, MDA-MB-468 cells, MDA-MB-468-DOX cells and MDA-MB-468-DOX cells treated with WP1066 (×400); B: flow cytometry analysis for CD44 expression in the 4T1 cells and 4T1-DOX cells; C: immunofluorescence staining showed increased expression of CD133 (red) in the 4T1-DOX cells, counterstained with DAPI (blue; ×200).
图2多柔比星(0.1μmol/L)持续诱导下细胞成球能力及CD133和CD44的表达
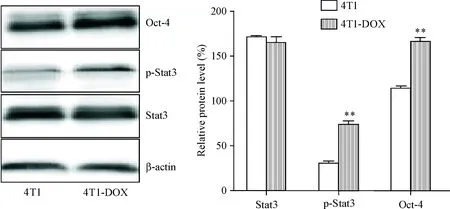
Figure 3.Western blot analysis for determining the protein levels of Oct-4, p-Stat3 and Stat3 in the 4T1 cells and 4T1-DOX cells. Mean±SD.n=3.**P<0.01vs4T1 group.
图3Oct-4、p-Stat3和Stat3的蛋白水平在4T1细胞和4T1-DOX细胞的比较
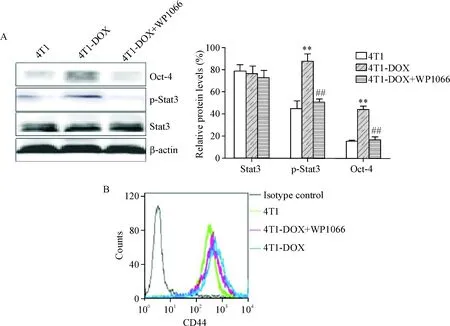
Figure 4.WP1066 inhibited Stat3 activation and the protein levels of Oct-4, p-Stat3, Stat3 and CD44. Mean±SD.n=3.**P<0.01vs4T1 group;##P<0.01 4T1-DOX group.
图4WP1066抑制剂对Oct-4、p-Stat3、Stat3蛋白水平和CD44表达水平的影响
为了进一步明确Stat3对Oct-4和CD44的调控作用,我们用Stat3的抑制剂WP1066抑制Stat3的活性,结果显示WP1066显著抑制了Stat3的磷酸化,4T1-DOX细胞在WP1066作用下Oct-4和CD44的表达量也明显降低。这些结果说明多柔比星是通过Stat3-Oct-4/CD44途径促进了三阴性乳腺癌干性产生。
综上所述,多柔比星诱导三阴性乳腺癌4T1细胞产生BCSCs富集,这是通过激活Stat3从而介导Oct-4、CD44和CD133的高表达进而表现了干细胞的特征。这为我们针对Stat3-Oct-4通路设计三阴性乳腺癌的靶向治疗药物提供了理论依据。

