吡咯烷螺二吲哚对非小细胞肺癌A549细胞活力及凋亡的影响*
马金珠, 颜 亮, 昝嘉伟, 徐 蕾, 王 毅, 张根葆△
(1安徽省多糖药物工程技术研究中心, 2安徽师范大学生命科学学院, 安徽 芜湖 241002; 3南京大学化工学院, 江苏 南京 210023)
非小细胞肺癌占肺癌总发病率的85%,因其预后差[1]和死亡率高占据肿瘤死亡率的第二位[2],仅次于肝癌。非小细胞癌的病理机制极为复杂,目前还缺乏有效的靶位药对其进行有效治疗,5年存活率低于15%[3]。因此,对非小细胞肺癌的发病机理进行研究,并开发出新的靶向治疗药物对于非小细胞肺癌的治疗至关重要。
化学合成药物是进行药物创新的重要方式之一。该方法先通过对先导物结构所提供的信息进行合成,再对其结构进行优化或合成相关类似物,因而可能发现新的低毒性有效的药物候选物[4]。在过去的几年中,螺旋吲哚类衍生物以构造一个手性季碳中心的合成方法取得了重要的进展,如通过不对称的分子内赫克反应,高选择性地合成了螺-吡咯-3, 3′-吲哚衍生物[5]。 此外,通过吲哚与氨基酸脂和靛红的级联反应[6]也可以高效得到螺旋吲哚衍生物。到目前为止,多数研究主要集中在螺旋吲哚类衍生物在合成方法及效率等方面,而对于螺旋吲哚衍生物的生物学活性尤其是抗肿瘤活性的研究还很少。 鉴于对螺旋吲哚衍生物在抗肿瘤药物的筛选领域研究的重要性,本研究观察了新合成的吡咯烷螺二吲哚(proline-spirooxindole,PSx)对非小细胞肺癌A549细胞凋亡的影响,初步探讨螺旋吲哚类衍生物的潜在抗肿瘤活性。
材 料 和 方 法
1 材料
人非小细胞肺癌细胞株A549购自中国科学院上海细胞研究所细胞库。吡咯烷螺二吲哚为南京大学化工学院合成,结构式见图1A;胎牛血清购自Gibco;CCK-8试剂盒购自凯基生物科技公司;Anne-xin V/PI双染凋亡检测试剂盒购自BD;DAPI染料购自广州锐博生物科技公司;鼠源抗p53、多ADP核糖聚合酶[poly(ADP-ribose) polymerase,PARP]和mTOR抗体购自Cell Signaling Technology;抗GAPDH抗体和兔抗鼠 II 抗购自Santa Cruz。
2 方法
2.1细胞培养 人非小细胞肺癌细胞株A549用含10%胎牛血清和抗生素(1×105U/L 青霉素和100 mg/L链霉素)的DMEM完全培养基,在37 ℃、5%的CO2的环境下培养,取对数生长期的细胞用于后续实验。
2.2Western blot检测细胞信号蛋白 经药物处理24 h后,收集各组细胞裂解物。4 ℃、12 000×g离心5 min,取上清。BCA法测定每个样品的蛋白浓度,加入5×蛋白上样缓冲液,煮沸5 min,冷却后,按照定量浓度,每孔上样量为40 μg进行上样。经SDS-PAGE(10%)分离后,将蛋白全部转移至PVDF膜上。将膜放入用TBST配制的5% 脱脂奶封闭液中,室温封闭1 h。然后加入按照1 ∶1 000稀释的 I 抗,4 ℃孵育过夜。再用TBST清洗6次,每次5 min。加入稀释好的 II 抗,室温孵育1 h,TBST清洗6次,每次5 min。清洗好的膜放入暗盒上,正面朝上,加入显影液,检测蛋白。
2.3CCK-8法检测细胞活力 将人非小细胞肺癌细胞株A549按照每孔1×104的密度接种于96孔板中,用不同浓度(25、50和100 mg/L)的吡咯烷螺二吲哚处理细胞24 h后,每孔加入10 μL CCK-8试剂(2.5 g/L),继续培养2 h,用酶标仪在450 nm波长下测定每孔的吸光度(A)值。
2.4流式细胞术检测细胞凋亡 用预冷的PBS缓冲液清洗A549细胞2次,1 000 r/min离心收集细胞,用100 μL 1×Binding Buffer重悬细胞,然后分别加入5 μL Annexin V-FITC 和5 μL PI,室温避光孵育20 min,再加入1×Binding Buffer 400 μL。流式细胞仪检测,根据阴性对照组进行设门及调节电压,随后分析细胞凋亡率,每次计数1×104个细胞。
3 统计学处理
采用SPSS 19.0软件进行数据处理和统计分析。所有数据以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 PSx抑制A549细胞活力
使用不同浓度的PSx预处理A549细胞24 h,CCK-8法检测细胞活力,实验结果显示,随着PSx浓度的增加,A549细胞活力被显著抑制,并呈现剂量依赖性(P<0.01),见图1B。为了观察PSx对A549 细胞形态的影响,使用倒置显微镜观察并采集细胞图像,结果显示,相比于DMSO对照组,随着PSx浓度的增加,A549细胞出现不同程度的脱落和减少,见图2。这些结果表明PSx对A549细胞活力具有显著抑制作用。
2 PSx诱导A549细胞凋亡
使用25、50和100 mg/L PSx处理A549细胞24 h,Annexin V/PI双染细胞,使用流式细胞术检测A549细胞的凋亡率,实验结果显示,随着PSx浓度的增加,A549的细胞的存活率被显著抑制,并呈现剂量依赖性,而细胞凋亡率也显著上升(P<0.05或P<0.01),表明PSx可以诱导A549细胞凋亡,见图3。此外,使用25、50和100 mg/L PSx处理A549细胞24 h后,使用核酸染料DAPI 对A549细胞进行染色,结果显示,在340 nm激发波长下,PSx处理的A549细胞有典型的核固缩的细胞凋亡形态,见图4。

Figure 1.The chemical structure (A) of proline-spirooxindole (PSx) and its effect on the viability of A549 cells (B). Mean±SD.n=5.**P<0.01vsDMSO group.
图1PSx的化学结构及对A549细胞活力的影响
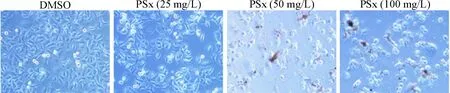
Figure 2.The effect of proline-spirooxindole (PSx) on the morphological changes of A549 cells (×200).
图2PSx对A549细胞形态的影响
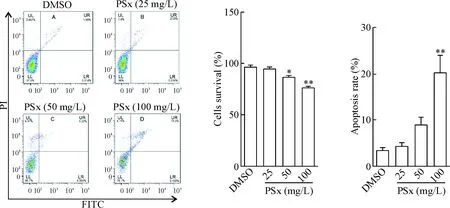
Figure 3.The effect of proline-spirooxindole (PSx) on the apoptosis of A549 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsDMSO group.
图3PSx对A549细胞凋亡的影响

Figure 4.The effect of proline-spirooxindole (PSx) on the morphological changes of the nuclei of A549 cells (×200).
图4PSx对A549细胞核形态的影响
3 PSx对凋亡相关蛋白的影响
为了验证PSx对细胞相关凋亡蛋白表达的影响,使用25、50和100 mg/L PSx处理A549细胞24 h,Western blot法检测了A549 细胞抑癌蛋白p53和DNA修复酶PARP的表达水平,结果显示,PSx可以显著上调p53的表达,下调PARP并上调PARP切割产物的蛋白水平(P<0.01)。此外,使用25、50、100 mg/L PSx处理A549细胞24 h,检测mTOR信号蛋白的磷酸化水平,结果显示,PSx可以剂量依赖性地抑制mTOR的磷酸化水平(P<0.05),见图5。
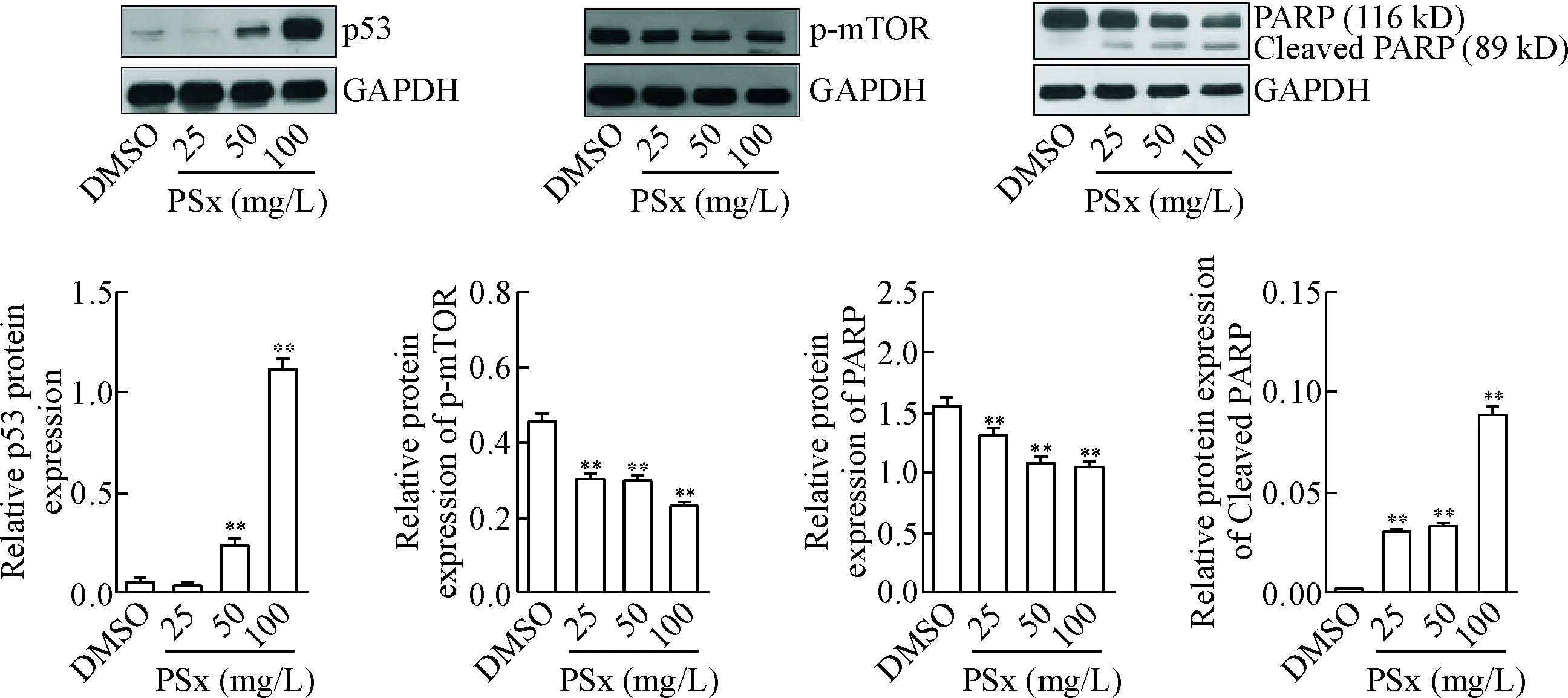
Figure 5. The effect of PSx on the apoptotis-related proteins in the A549 cells. Mean±SD.n=3.**P<0.01vsDMSO group.
图5PSx对A549细胞凋亡相关蛋白的影响
讨 论
研究表明,螺旋吲哚类化合物具有多种生物学活性,如吡咯烷基吲哚类化合物可以抑制人类前列腺癌细胞的增殖[7-8];吲哚螺环-吡咯嘧啶类化合物通过抑制AKT的表达,能减缓肿瘤细胞在体内的生长[9];此外,一些吲哚螺环化合物可以作为法呢酰基转移酶(farnesyltransferase,FTIs)抑制剂,有显著抗肿瘤作用[10],因此螺旋吲哚类衍生物具有潜在的抗肿瘤活性。在本研究中,我们通过氨基酸脂和靛红的级联反应得到一种新型的螺旋吲哚衍生物,并评估了其对非小细胞癌的抑制作用。结果显示,该化合物可以直接抑制A549细胞生长,改变细胞形态并诱导A549细胞核出现典型的细胞核固缩形态。此外,使用流式细胞术检测了Annexin V/PI双染的A549细胞,可以也观察到PSx对其A549细胞凋亡的诱导作用。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种Ser/Thr蛋白激酶[11-14],作为ATP和氨基酸水平的传感器来平衡细胞内营养物质,对于调控细胞生长至关重要[15-17]。mTOR在Ser2448残基处偶联PI3激酶/Akt信号传导途径磷酸化,并在Ser2481处自磷酸化[18]。mTOR在细胞生长和营养平衡中起关键作用,并可能在肿瘤中异常表达。 因此,mTOR可作为抗肿瘤治疗的潜在靶位[19]。本研究检测了PSx对A549细胞的mTOR Ser2481位点磷酸化水平的影响,结果显示PSx可以有效抑制mTOR的磷酸化,提示mTOR可能是PSx抑制A549细胞活性的作用靶位。此外,本研究观察了PSx对抑癌基因TP53产物p53转录因子的影响。 p53作为DNA损伤的检查点检测细胞损伤情况,其激活可阻滞细胞周期并进行进一步的DNA修复,或修复失败直接促使细胞凋亡[20]。PSx可以显著诱导p53的表达及DNA修复酶发生切割,我们推测PSx加入后会诱导p53的表达,从而激活相关凋亡信号通路,进而导致DNA修复酶发生切割。
综上所述,本研究在体外证实了吡咯烷螺二吲哚具有抗非小细胞肺癌的潜在活性,为该类化合物所具有生物活性的研究提供了实验依据。然而,在本实验中,我们尚未探讨该药物是否会引起细胞内渗透压的改变。因为渗透压的改变对细胞生长和凋亡会产生影响,在后续的研究中我们要排除该药物可能对渗透压的影响,并进一步研究PSx作为抗肿瘤药物的具体作用机制。

