韭山列岛海域虾类群落结构与海洋环境因子的关系
卢衎尔 ,朱文斌 ,梁君 ,李德伟 ,戴乾 ,卢占晖 *,徐开达 *
(1.浙江省海洋水产研究所渔业资源与生态研究室,浙江舟山316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山316021)
韭山列岛是浙江中部沿海的一个著名列岛,因其丰富的海洋渔业资源,于2003年被列为国家级海洋生态自然保护区。韭山列岛位于浙江中部偏北海域,距离宁波象山半岛约19 km,附近海域年表层水温在10.3~28.0℃(平均为16.3℃),年均表层盐度28.30[1]。所在海域北邻舟山渔场,南接大目洋渔场,为诸多经济鱼种的产卵场与索饵场之一[2]。韭山列岛自然保护区是一个受到严格保护的自然生态系统,区内严禁任何生产性活动。由于其保护区的特性及所属的地理位置,该海域可一定程度反映浙江近岸海域的资源状况。
受人为捕捞活动的影响,渔业资源衰退,虾类成为浙江沿岸重要的渔获资源。虾类作为海洋生态系统中不可或缺的一部分,其种类和数量的变化会影响生态系统的动态平衡[3],研究韭山列岛附近海域的虾类资源对保护浙江沿岸虾类组成及结构具有重要意义。此前针对韭山列岛海域的相关研究,仅见关于渔业资源密度的论述[1-2,4-5]。本研究将根据2015—2016年在韭山列岛附近海域开展的4个航次渔业资源调查中虾类的调查资料,对该海域虾类资源进行分析,研究其对环境的适应能力及其与海洋环境的关系,以了解该海域的虾类群落结构及组成情况,从而为进一步建设韭山列岛国家级自然保护区、保护浙江沿岸的虾类资源提供科学支撑及依据。
1 材料与方法
1.1 调查区域
在韭山列岛附近海域设置了16个站位(见图1),调查范围为 29°20′~29°30′N,122°08′~122°18′E,分别于2015年11月(秋),2016年2月(冬)、5月(春)和8月(夏)搭乘单船底拖网渔船对目标海域进行调查。
1.2 调查数据的采集
调查船长38 m,主机功率220 kW,总吨位为150 t;所用调查网具的网口拉紧周长为50 m,囊网网目尺寸25 mm,上纲长30 m,下纲长38 m。根据国家质检总局2007年出台的《海洋调查规范(GB/T12763.6—2007)》[6],每个站位拖网时间标准化为1 h,平均拖速3 km·h-1;对每个站位随机采样1箱(20 kg)。渔获虾类鉴定至种,并对每一虾种进行称重和计算,用每小时的渔获质量(g·h-1)和数量(尾每小时,ind·h-1)表示该站位的相对资源量,分类依据参照《中国海洋生物名录》[7]。在采样的同时,记录海洋环境参数,包括表层水温、底层水温、表层盐度、底层盐度、表层溶解氧、底层溶解氧、表层pH值、底层pH值、表层叶绿素a、底层叶绿素a和水深。

图1 韭山列岛地理范围示意图及采样站位设置(虚线表示韭山列岛国家级自然保护区界限)Fig.1 The illustration of geographical location of Jiushan Islands waters and the sampling sites(dashed lines indicate the boundaries of the Jiushan Islands National Marine Reserve)
1.3 数据分析处理
韭山列岛海域虾类优势种的确定采用相对重要性指数(index of relative importance,IRI),IRI计算公式如下[8]:

式(1)中,N为某一物种尾数占总尾数的百分比,W为该物种的质量百分比,F为该物种的站位出现频率百分比。本研究将IRI大于1 000的虾类定为优势种。
用 数 量 - 生 物 量 比 较 曲 线[9](Abundance biomass comparison curve,简称ABC曲线)来分析该研究海域受干扰情况:在生物群落未受干扰时,生物量优势度曲线位于数量优势度曲线之上;两曲线相交则表示群落已受到干扰,处于不稳定状态;当数量曲线位于生物量曲线之上时,表明群落受到严重干扰[10-12]。同时,利用W统计量(W-statistic)作为 ABC曲线方法的一个统计指标[11],其计算公式为:

式(2)中,S为群落中的物种数,ai和bi分别表示将丰度和生物量从高到低排序后前j个物种的生物量与丰度累积百分比。W值为正时,越大表明受干扰程度越低,反之亦然。
使 用 ArcGIS10.2forDesktop( 版 本10.2.0.3348)绘制站位图、用 Microsoft Excel 2016存储原始数据。数据的分析处理以及制图均在R 3.3.4[13]中完成,图形部分利用R语言自带的绘图包以及外部包“ggplot2”[14]制作完成。
多元统计分析在生态研究中有广泛应用,而排序(ordination)是多元统计分析的常用方法之一。冗余分析(redundancy analysis,RDA)属于约束排序的一种,其主要目的是为了将样方和研究物种尽可能排列在可视化的低维空间,以分析物种的分布与环境因子之间的关系[15]。同时,采用蒙特卡罗置换检验(Monte Carlo permutation test)验证RDA分析中环境因子与优势种的显著性差异[16-17]。本文用 R 语言的外部包“vegan”[18]进行冗余分析。
2 分析结果
2.1 调查海域的虾类组成
在研究海域调查中共发现虾类16种,隶属于8科12属,所有种类均属暖水种和暖温种。其中属、种数最多的为对虾科,共4属5种,占总种数的31.3%;其次为长臂虾科,共计2属4种,占总种数的25.0%;其余若干科的种数均不超过2种(见表1)。
2.2 优势种种类组成
调查海域全年的优势种为日本鼓虾(Alpheus japonicus)、安氏白虾(Exopalaemon annandalei)、葛氏长 臂 虾(Palaemongravieri)、哈 氏 仿 对 虾(Parapenaeopsis hardwickii)、中华管鞭虾(Solenocera crassicornis)和细巧仿对虾(Parapenaeopsis tenella)。
调查海域各月虾类的数量、质量及优势种随季节变化明显(见表2、表3)。11月优势种主要为安氏白虾,平均网获尾数与平均网获质量占比分别为55.77%和34.92%;翌年2月,主要优势种有鲜明鼓虾(Alpheus distinguendus)、葛氏长臂虾、日本鼓虾,出现频率为56.25%,81.25%及81.25%,3种虾类平均网获尾数与平均网获质量分别为44.65%及42.5%;5月,主要优势种为日本鼓虾和细巧仿对虾,日本鼓虾的平均网获尾数占比高达72.79%,平均网获质量占比约为68.47%;8月,主要优势种为哈氏仿对虾、中华管鞭虾以及葛氏长臂虾,三者网获尾数之和占总网获尾数的91.2%,而网获质量则占总网获质量的96.7%。本次调查中,优势种的平均个体质量小于该季节虾类平均个体质量,W%-N%为负值,说明该物种在此季节个体较小。
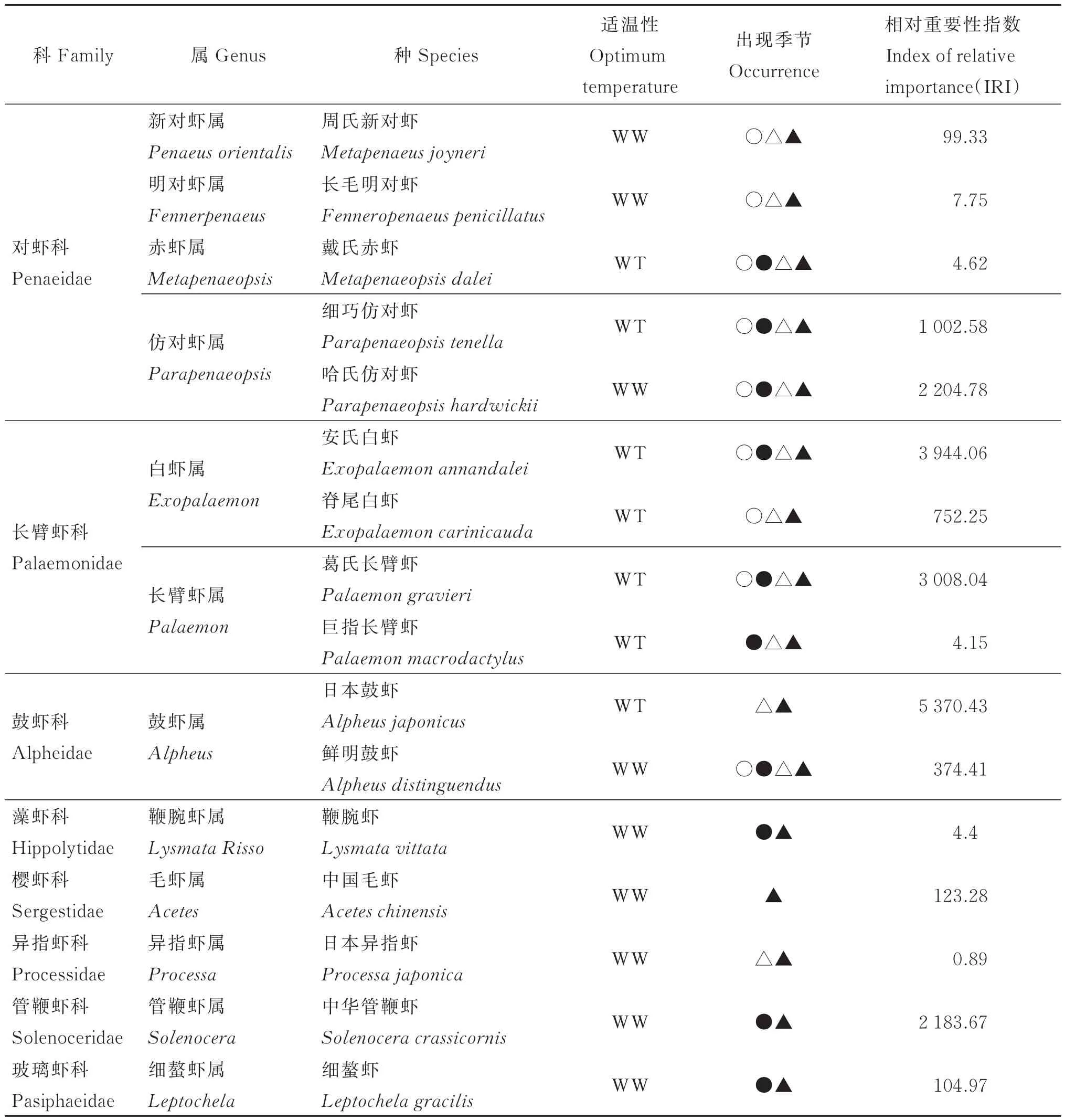
表1 2015—2016年韭山列岛海域渔获虾类组成Table 1 Shrimps composition of Jiushan Islands waters from 2015 to 2016
2.3 相对资源密度变化
韭山列岛附近海域虾类相对资源密度随季节变化而波动:资源密度相对较高的为秋季(2015年11月),春季(2016年5月)次之,冬季(2016年2月)处于较低水平,较其他季节差异明显(见图2)。平均网获质量为883.4~2 882.9 g·h-1,平均网获尾数为556~2 804尾·h-1。平均网获质量与平均网获尾数的变化趋势相同,均呈春、秋季高,夏、冬季低的波动分布。

表2 韭山列岛海域各调查季节虾类数量与质量情况Table 2 Numbers and weights of shrimp species of each season in Jiushan Islands waters
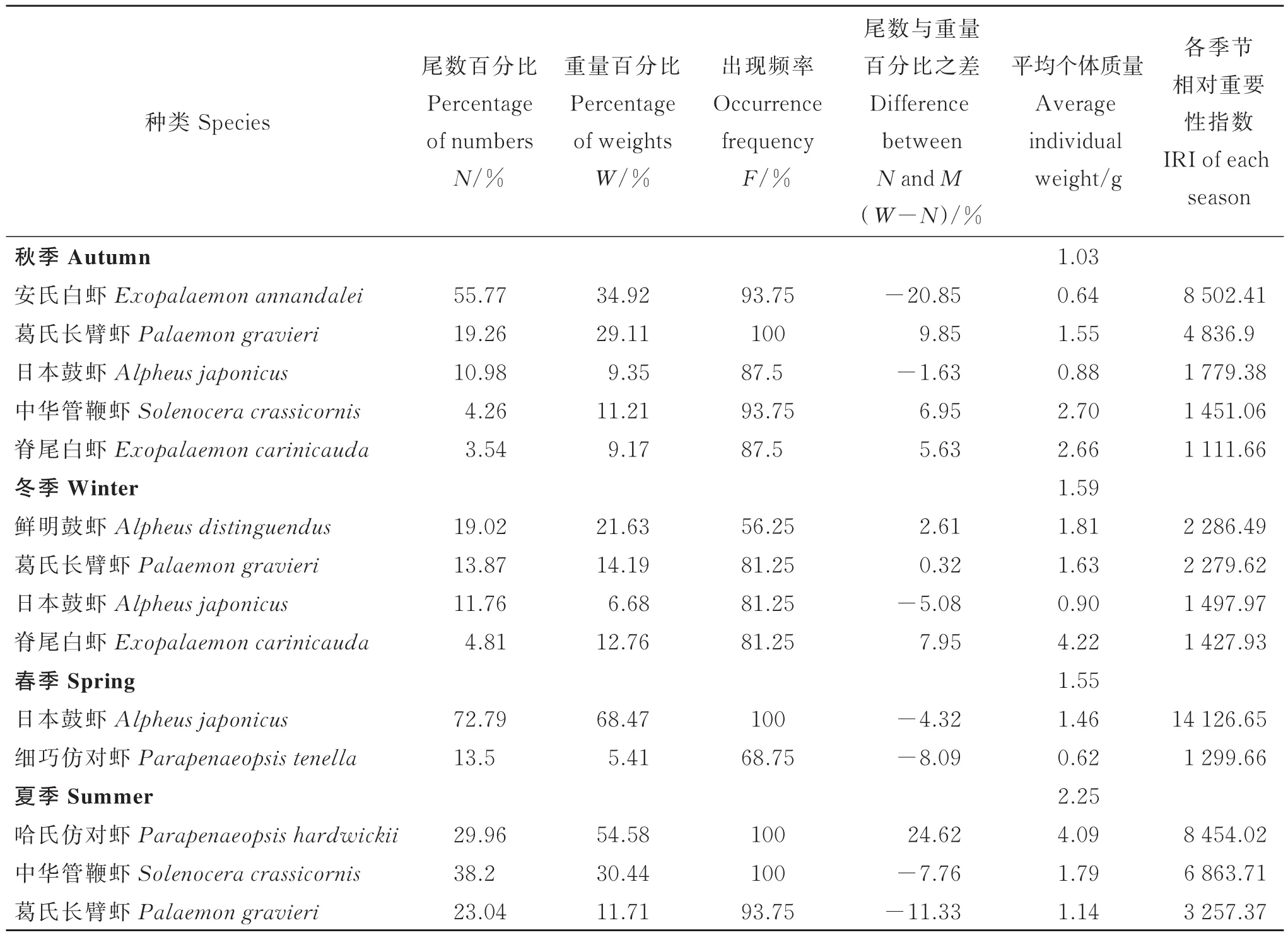
表3 四季优势种虾类情况(IRI>1 000)Table 3 Dominant species of each season(IRI> 1 000)

图2 调查月份相对资源密度(95%置信区间)Fig.2 The change of relative shrimp resource density of each investigated month(95%confidence interval)
2.4 生态位分化
对各调查月份捕获的虾类做趋势对应分析(detrended correspondence analysis,DCA),结果显示各月前4轴中梯度长度最大值均小于3.0,故选用基于线性模型的冗余分析(redundant analysis,RDA)较为合适[19-20]。研究海域各季节虾类优势种组成与海洋环境因子之间的关系可通过RDA排序图解析(见图3)。韭山列岛海域各调查月份的环境数据如表4所示,各环境因子与RDA排序轴之间的关系见表5。
2015年11月(秋)的RDA排序结果表明,环境因子对物种分布的解释量为74.09%,多数虾类分布于第1排序轴下侧。第1排序轴与表层叶绿素a(-0.996 1)、表层溶解氧(-0.927 8)、底层叶绿素a(0.998 0)和底层水温(0.986 3)的相关性最高;而第2排序轴主要反映了其与水深(0.938 9)和底层盐度(-0.932 9)的相关性。
2016年2月(冬)的RDA排序结果显示,环境因子对物种分布的解释量为64.17%。第1排序轴主要反映了与表层水温(0.995 2)、底层pH值(0.995 0)、水深(0.934 3)及表层pH值(0.9710)的相关性,而第2排序轴则主要显示了底层叶绿素a(0.991 9)与底层温度(0.903 9)的变换。

图3 各月份RDA排序图Fig.3 RDA ordination graphs of each month罗马数字对应的物种参照表6(Roman numerals and their corresponding species are in accord with table 6)。d:水深;st:表层温度;ss:表层盐度;sca:表层叶绿素 a;sdo:表层溶解氧;bt:底层温度;bs:底层盐度;bca:底层叶绿素 a;bdo:底层溶解氧。

表4 韭山列岛海域四季海洋环境因子参数(均值±标准误)Table 4 Marine environmental factors of Jiushan Islands waters(mean± SE)
2016年5月(春)的RDA排序图主要显示了环境因子与第1排序轴的相关性,环境因子对物种分布的解释量为72.78%。所有环境因子均与第1排序轴呈较强的相关性,物种主要分布在第1排序轴上方。

表5 韭山列岛海域环境因子与RDA排序轴的相关性Table 5 Correlation between environmental factors and RDA axes in Jiushan Islands waters
而2016年8月(夏)的RDA排序图则显示,第1排序轴主要表现了与表层盐度(0.909 0)、水深(-0.997 8)、表层溶解氧(-0.990 0)、底层盐度(-0.967 4)、底层溶解氧(-0.963 9)及底层叶绿素a(-0.922 2)的相关性;第2排序轴则表现了与表层水温(-0.946 1)的相关性。物种多位于第1排序轴上方。

表6 RDA排序图罗马字母对应的种类及其生态适应性Table 6 The look-up table in RDA ordination graphs between Roman numerals and shrimp species with their optimum temperature and salinity
2.5 干扰程度
调查海域4个季节的ABC曲线如图4所示。秋季、冬季和春季,韭山列岛附近海域虾类群落数量优势度曲线位于生物量优势度曲线之上,而夏季虾类群落的数量优势度曲线与生物量优势度曲线有交叉。夏季ABC曲线中部,生物量优势度曲线位于数量优势度曲线之上。根据ABC曲线计算的各季节W 统计值在-1.772×10-3~-2.47×10-4,均小于0,其中,冬季最低,秋季次之,夏季最高。
3 讨 论
3.1 优势种虾类及相对资源密度变化
调查海域位于亚热带季风气候区,太阳辐射较强,海水温度相对较高[21],因此,暖水种与暖温种虾类占绝对优势。调查期间捕获的16种虾类均为暖水种或暖温种,全年优势种共6种,占总种数的37.5%。其中,暖水性优势种有安氏白虾、葛氏长臂虾、日本鼓虾及细巧仿对虾4种,占优势种的66.7%,暖温性优势种有哈氏仿对虾及中华管鞭,占优势种的33.3%。该结果与谢旭等[22]的研究结果基本一致。
韭山列岛附近海域出现的虾类资源具有明显的季节性,不同季节的虾类资源量受某一虾种的影响极大(见图2、表2和表3),整体呈春、秋季高,冬、夏季低的分布。冬季(2月)资源量极低,可能由冬季水温下降、暖流影响减弱,导致虾群洄游越冬引起[23-24];尽管冬季生物量较低,但虾类种数为全年最高,原因有待进一步研究。春季虾类资源量主要受日本鼓虾的影响,可能是因为日本鼓虾属于定居性种类[25],且繁殖期较长,致使日本鼓虾幼体不断得到补充。夏季为长江汛期[26],径流量大,导致沿岸海域温度、盐度以及营养盐含量及分布发生变化[27],其携带的营养物质为沿岸海域浮游植物的繁殖和生长提供了优越的环境[28],使夏季主要优势种之一的哈氏仿对虾幼虾密集分布在沿岸海域索饵[29-30];而另一主要优势种——中华管鞭虾则处于繁殖盛期[22,31],产卵亲体进入沿岸海域产卵,其幼虾则在沿岸海域索饵成长[32];此时节,低盐性种类,如安氏白虾、脊尾白虾(Exopalaemon carinicauda)及日本鼓虾等,则更有可能选择栖息于盐度更低的近岸海域。由于调查海域所捕获的虾类均属短生命周期的甲壳类生物,生长迅速[32-33],到秋季,幼虾逐渐成长为成体[23];此季节最主要的优势种为安氏白虾,正处于繁殖期[30,34],而另一主要优势种葛氏长臂虾在春、夏季产卵繁殖高峰后幼虾逐渐长大[32],秋季处于生殖次高峰[35],因而秋季资源量相对处于较高水平。

图4 各季节ABC曲线图及W统计值Fig.4 Abundance-biomass comparison curves with W-statistics values of each investigated month注 大点表示优势种所对应的值。Note Bigger dots represent cumulative biomass or abundance values of dominant species.
3.2 虾类群落的RDA排序
直接排序是基于对物种和环境因子组成的数据分析,以研究种群间和种群与环境因子间的关系[15]。本文采用RDA分析,进一步补充说明了优势种虾群资源量随季节分布的关系。其中,各季节的优势种变化如表3所示,各季节RDA结果如图3所示。
秋季的优势种为安氏白虾、葛氏长臂虾、日本鼓虾、中华管鞭虾和脊尾白虾,从尾数与重量百分比来看,主要优势种为安氏白虾与葛氏长臂虾,此结果与瞿潇南等[36]的“秋季的优势种以广温低盐的安氏白虾为主”和宋超等[20]的“安氏白虾主要出现在秋季”的研究结论相符。安氏白虾出现在右侧第1排序轴附近,表明其与底层叶绿素a和底层水温呈正相关。安氏白虾的生长特性很好地解释了这一结果:由于调查海域各站位平均水深为11.68 m,属于安氏白虾的栖息水层(<25 m),主要以底栖小型动、植物为食,且秋季摄食强度较大,因而生长迅速[34],致使此季节渔获率较高。葛氏长臂虾位于第2排序轴左下侧,根据“葛氏长臂虾的分布与盐度呈正相关”的研究结论[20],葛氏长臂虾在某一范围内的分布更集中于盐度相对较高处,符合RDA排序结果。蒙特卡罗置换检验显示,此时节物种的分布主要受底层水温(r2=0.726 2,P=0.001)的影响:由于虾类属于底栖动物种类[20],因而RDA排序图中底层水温对物种分布影响最大的结果是合理的,这也与逢志伟等[25]的结论“单因子分析中底层水温是影响虾类群落结构的主要环境因子”相吻合。
冬季,优势种为鲜明鼓虾、葛氏长臂虾、日本鼓虾及脊尾白虾,以低盐性种类为主,这主要是因为冬季长江径流量冲淡水仍对该研究海区的盐度影响较大。此时,长江冲淡水主要局限于沿岸水域,近岸和表层盐度低,在浅水区呈垂直均匀分布[37]。此时RDA排序图显示,第2排序轴与盐度相关,除葛氏长臂虾(广温广盐性种)外,其余3种广温低盐性虾种均在第2排序轴的下侧。由于该季节盐度变化主要表现为近岸和表层低、外海和底层高[37],且有3种低盐性虾类均栖息于浅水区,因而水深对物种的分布影响最大(r2=0.543 7,P=0.009)。
春季,优势种为日本鼓虾和细巧仿对虾,所有环境因子均与第1排序轴存在较强的相关性。其中,表层叶绿素 a(r2=0.498 7,P=0.01)、表层水温(r2=0.398 9,P=0.039)和表层溶解氧(r2=0.420 4,P=0.035)对物种的分布影响最大。RDA排序图中,2种虾类均位于第1排序轴右侧,表明其与上述3个环境因子的关系密切。这是由于日本鼓虾生活于浅海[30],而另一优势种细巧仿对虾也在春季洄游至沿岸浅海产卵[25,30];由于其幼虾体型较小,较体型较大的成体更有可能栖息于浅水层,因而在栖息、摄食及繁殖等方面与表层环境因子关系更密切;此外,该季节浮游植物细胞丰度在近岸表层出现高值,由近岸向外海、随水深的增加而逐渐降低[38],加之长江口及其邻近海域的叶绿素浓度及浮游植物生物量也处于一年中的峰值[39],从而进一步解释了春季物种分布与表层环境因子相关性高的原因。
夏季,优势种为哈氏仿对虾、中华管鞭虾和葛氏长臂虾。夏季单个环境因子对物种的分布影响均不显著,然而环境因子对物种分布的解释量达89.79%,对11个环境因子的综合分析表明,该季节环境因子对物种的分布具有显著影响(P=0.008)。这主要是由于研究区域范围较小,夏季气温高于水温,且沿岸水温高于外海,近岸浅水区盐度呈垂直均匀分布[37],致使水文环境水平分布较为均匀[40]。夏季高温高盐的台湾暖流与长江冲淡水形成的混合水区为哈氏仿对虾幼虾的索饵、中华管鞭虾亲体的产卵和其幼体的索饵[32]提供了良好的环境,而此季节也是葛氏长臂虾幼虾出现的高峰期[35]。值得注意的是,夏季还出现了部分高温高盐性的日本异指虾(Processa japonica),这可能也与受台湾暖流影响有关。
3.3 用ABC曲线评价虾类群落
数量生物量曲线(ABC曲线)的不同特征主要由不同物种的生物量和数量的比例引起[10],且优势种的体型大小也对优势度曲线和生物量曲线的位置有一定影响[41],ABC曲线的特征可在一定程度上反映群落中物种体型的相对大小。在ABC曲线上,优势种的排序并不一定最靠前(见图4),这主要由于部分虾类虽然数量较多,但调查站位集中(见表2),如2月份细螯虾(Leptochela gracilis)仅分布在其中3个站位,而优势种的计算则与该物种在调查站位的出现频率呈显著正相关(相关性系数0.72,P=1.3×10-4)。
ABC曲线是按照物种排序后的累积数量和累积生物量绘制而成的。除第1排序物种外,其余物种的个体大小可由生物量优势度曲线与数量优势度曲线上相邻两物种所对应的连线的斜率反映。以2016年2月的ABC曲线为例(见图4),第4排序种(日本鼓虾)与前一物种对应的数量优势度曲线上值连成的线段的斜率明显大于对应的生物量优势度曲线段的斜率,此时其丰度及生物量增量分别为11.76%和6.68%,该物种的尾数及生物量分别为1 045尾及943.5 g,可知,第4排序种的个体较小;同理可知,第8排序种(脊尾白虾)的体型较大(见表2)。由此推测,当ABC曲线随着排序物种数量的增加而更趋于平滑时,可由某一物种在数量优势度曲线上对应值和生物量优势度曲线上对应值的切线斜率来判断物种的个体大小。除2016年8月外,其余3个月的数量优势度曲线均位于生物量优势度曲线之上(见图4),进一步说明此3季节的虾类群落体型较小,个体平均质量偏低(见表3)。
尽管不同季节的ABC曲线特征不尽相同,但其W统计值均为负数,根据CLARKE等[11]的划分标准,该海域的虾类群落受干扰程度较大。2016年8月(夏),研究海域的生物量优势度曲线位于数量优势度曲线之上,说明相较而言,此季节虾类群落处于较稳定状态,这可能是由于此时浙江省正值夏季伏休期,从而为虾类的生长提供了有利的环境;而其他3季(秋、冬、春),群落处于明显受干扰状态,这与人为因素(如捕捞)的干扰不无关系[42]。由于人类活动的强大影响,虾类正逐渐向生长迅速的小型化种类演变[43-44],这也补充说明了前文提到的物种体型大小对ABC曲线位置的影响。

