完全胸腔镜单向式肺叶切除术在非小细胞肺癌切除中的优越性
尧林 马小平 成宾
肺癌是临床常见的肺部恶性肿瘤,以非小细胞肺癌为常见类型。近几年该类型肺癌发生率有逐年升高的态势,已经成为世界范围内肿瘤最常见的死因[1]。目前对于Ⅰ、Ⅱ期可切除的非小细胞肺癌,首选手术治疗,术后可辅助以靶向治疗、化疗等综合治疗干预;而选择何种手术方式,尚无统一意见[2-3]。当前,肺叶切除术+淋巴结清扫术是Ⅰ、Ⅱ期非小细胞肺癌主要的外科治疗方法,而既往取胸部切口进行手术,有术后并发症多、创伤严重等缺点。相比之下,完全胸腔镜单向式肺叶切除术作为一种全新的微创外科治疗术式,主要在胸腔镜辅助下进行手术切除,可明显缩小手术所致创伤,且有术后康复快、切口美观等优越性,日益受到心胸外科医师的认可,因而完全胸腔镜单向式肺叶切除+淋巴结清扫术逐渐成为治疗早期非小细胞肺癌的首选手术方式,但能否取代常规开胸肺叶切除术+淋巴结清扫术方案,以及有何优越性,医学界尚无统一定论[4-6]。为此,笔者选取58例Ⅰ/Ⅱ期非小细胞肺癌患者作为研究样本,按手术方案不同展开分组对照试验,从手术指标、疼痛、炎症因子三方面着手研究完全胸腔镜单向式肺叶切除+淋巴结清扫术方案的优越性,现报道如下。
对象与方法
一、研究对象
选择2013年1月—2018年6月在成都市第六人民医院心胸外科手术的肺癌患者。
1.纳入标准:①经纤维支气管镜、胸部CT、全身骨扫描等影像学检查,结合体格检查、临床检查等综合诊断为非小细胞肺癌,且术前影像学分期均为Ⅰ期或Ⅱ期肺癌,术后病理学检查证实为Ⅰ期或Ⅱ期非小细胞肺癌;②术前未接受放化疗;③经血气分析和肺功能检查等提示无明显手术禁忌证;④可耐受单肺通气。
2.排除标准:①临床数据有缺陷,影响研究结果的准确性;②无法耐受手术操作,或者存在禁忌证;③血糖和血压等指标未控制在安全范围内;④同时合并其他部位肿瘤或者免疫系统、血液系统疾病;⑤同时参与其他研究。
根据以上纳入和排除标准,共入组Ⅰ、Ⅱ期非小细胞肺癌患者58例。根据所用手术方案不同,分为对两组,每组29例。对照组:男性19例,女性10例;年龄44~73岁,平均年龄(59.7±7.2)岁;病理类型:鳞癌20例,腺癌9例;临床分期:Ⅰ期22例,Ⅱ期7例。研究组:男性20例,女性9例;年龄45~73岁,平均年龄(59.9±7.0)岁;病理类型:鳞癌21例,腺癌8例;临床分期:Ⅰ期23例,Ⅱ期6例。
本研究经医院伦理学委员会审核通过,患者均签署手术知情同意书。
二、手术方法
1.对照组:采用常规开胸肺叶切除术+淋巴结清扫术,即保持健侧卧位,经双腔气管插管,选择静脉复合全身麻醉,健侧单肺通气。前抬患侧上肢,将其固定在手托架上。切口选择标准胸后外侧切口,选取第4或第5肋间隙进行中上肺叶切除,选择第5或第6肋间隙进入胸进行下叶切除,并按照常规手术方法,先切除未发育完全的叶裂,游离各个动脉分支,使用丝线结扎和缝扎,切断。游离其各个静脉分支,结扎后切断,并闭合各个支气管。移出患肺,常规清扫肺门、纵隔部位淋巴结。
2.研究组:采用完全胸腔镜单向式肺叶切除+淋巴结清扫术,其体位、麻醉方式、通气方式等同对照组。在腋中线的第7~8肋间隙取小切口(直径为1.5 cm左右)作为胸腔镜观察孔,探查其胸腔部位有无黏连、纵隔淋巴结肿大、胸内转移灶等,掌握肿瘤大小、位置、浸润范围。在邻近病变部位(肺上叶手术取腋前线第4肋间、肺中下叶取第5肋间隙)取直径为5~8 cm的辅助小切口作为主操作孔,经肋间隙进入胸腔,并在电视胸腔镜直视下进行探查、分离以及止血操作。在手术中,主操作孔的皮肤、肌肉组织可使用乳突拉钩撑开,或者使用缝线法牵开,以便于器械进出,而肺叶切除期间使用单向式推进,上叶、中叶按从前往后顺序进行,而下叶则按从下到上顺序切除,切除肺叶应置于无菌标本袋内,从主操作孔内取出,预防切口污染。所有患者根据常规方法清扫肺门和纵隔部位淋巴结。
三、观察指标
1.手术指标:记录患者的切口长度、术中出血量、手术时间、术后住院时间,并统计两组患者上述4项指标的平均值。
2.疼痛程度:参考视觉模拟评分法(visual analogue scale,VAS)[7],检测患者术后12、24、48 h的疼痛程度。评分标准:0分为无痛,分值增加表示疼痛加剧;最高10分,表示剧烈疼痛乃至无法忍耐,必须予以镇痛药物干预。对无法忍耐疼痛者应用镇痛药物干预(一般使用盐酸哌替啶),统计其镇痛药物的应用率。
3.炎症因子水平:应用速率散射免疫比浊法检验两组患者术后第1、3、7天的C反应蛋白水平变化。
四、统计学方法

结 果
一、两组患者基线资料比较
两组患者的性别构成、年龄、肿瘤的病理类型和临床分期比较,差异均无统计学意义(P>0.05)。
二、两组患者手术相关指标比较
研究组患者的手术切口长度、手术时间、术后住院时间均短于对照组,术中出血量少于对照组,差异均有统计学意义(P<0.001)(表1)。
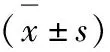
表1 两组患者手术相关指标比较
二、两组患者术后疼痛程度比较
研究组患者的镇痛药物使用率是6.9%(2/29),显著低于对照组的27.6%(8/29),差异有统计学意义(χ2=4.350,P=0.037);研究组术后12、24、48 h的疼痛VAS评分均低于对照组,差异也有统计学意义(P<0.001)(表2)。
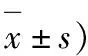
表2 两组患者术后VAS评分比较(分,
三、两组患者术后炎症因子水平比较
研究组术后第1、3、7天的C反应蛋白水平均低于对照组,其比较差异有统计学意义(P<0.05),详见表3。
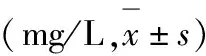
表3 两组患者术后C反应蛋白水平比较
讨 论
据报道,非小细胞肺癌在所有肺癌病例中占比高达80%,且发病率有逐年升高的趋势,已经成为了全球最常见的恶性肿瘤之一,引起了医学界广泛关注[8]。近几年来,医疗工作人员对于非小细胞肺癌的认知不断提高,加上胸外科手术技术提升、微创设备更新,人们关于非小细胞肺癌治疗理念也发生了变化:对于能够切除的病变组织,以手术治疗为主,从传统最大限度切除患侧所有肺组织,发展到当前最大限度切除病变组织的同时,最大限度保留正常的肺组织,从而保障患者手术的安全性,并提升其术后生存质量[9-10]。因此,传统开胸手术(以肺叶切除术、全肺切除术为主)虽能系统摘除人类肉眼可见的肺部肿瘤及纵隔、肺门淋巴结,但因创伤巨大、患者术后疼痛感强烈、并发症发生的风险系数较高等缺陷,违背了现代医学外科手术治疗非小细胞肺癌的理念,导致其临床应用受限[11-12]。
鉴于上,探索微创手术方式十分必要,可克服常规开胸手术的弊端,同时达到手术切除目标。据报道,在20世纪初期一名瑞典医师首次在胸腔手术中置入装置了光源的内镜器械,用以松解胸腔粘连,开创了“胸腔镜手术”先河,从此拉开了胸外科微创手术的序幕[13]。在20世纪末期,胸腔镜下肺叶切除术首次用于肺癌手术治疗中,证明了该手术符合恶性肿瘤治疗原则,在肺癌手术治疗中有可行性[14]。数十年来,伴随胸腔镜手术相关器械不断更新、完善,微创胸外科技术日渐熟练,完全胸腔镜肺叶切除术+淋巴结清扫术在Ⅰ、Ⅱ期非小细胞肺癌治疗中的应用逐渐增多,并成为胸外科科研热点之一。
在2006年版的《美国NCCN肺癌诊疗指南》中,已经将完全胸腔镜肺叶切除术正式纳入了非小细胞肺癌根治性手术中,且在2007年版的《美国NCCN治疗指南》中指出,该术式是可经外科手术切除的、非小细胞肺癌患者合理治疗的选择。相较于传统开胸手术,胸腔镜手术在非小细胞肺癌手术治疗中的优势较多,总结如下:①具有良好的照明效果,可提高术野清晰度、宽阔度,便于手术医师充分观察患者胸腔,从胸顶至膈肌,均在术野范围内,且能充分显露肺门、膈肌周围组织,因而可保证彻底清扫肺门和膈肌部位淋巴结组织,保障手术的根治性;同时,胸腔镜还有局部放大、近距离观察、深部照明作用,而30°镜的倾斜视角变化,又赋予了该手术自由多变的探查角度,医师可清晰辨认脂肪组织、淋巴结四周各种脉管结构,在充分清扫淋巴结的同时,还可避免损伤正常组织,减少机械牵拉,提高手术操作精准性,从而避免不必要损伤,减少术中出血量。本研究结果提示,研究组患者术中出血量少于对照组,即验证了胸腔镜的作用优势。②胸腔镜手术的切口较小,本研究发现,胸腔镜手术患者平均手术切口直径为(6.3±0.2)cm,远小于对照组的(23.6±2.4)cm,直观体现了该手术的小切口特点。胸腔镜手术因切口较小,对背阔肌和前锯肌均无影响,不会牵拉到肩胛骨,从而减小对患者运动系统肌肉、骨骼所致的手术创伤,且进胸快、关胸时间短,可缩短缝合、止血等时间。结果提示研究组患者的手术时间较对照组短。同时,该手术切口较小,可进一步减轻手术创伤,避免胸腔内器官过多暴露于空气中,预防手术感染。本研究中还以术后炎症因子指标变化评价两种手术的优缺点,结果提示两组患者术后第1~3天的C反应蛋白水呈现下降趋势,但研究组术后第1~3天的C反应蛋白水平均低于对照组。C反应蛋白作为急性时相蛋白,在机体感染、损伤时可急剧升高,恶性肿瘤患者的C反应蛋白指标普遍较高,而两组患者经治疗后下降,但研究组C反应蛋白水平较低,可推测如下两点:①胸腔镜手术对患者机体所致创伤较小,康复快;②胸腔镜手术切口较小,发生感染的风险较小。总而言之,胸腔镜手术在降低Ⅰ、Ⅱ期非小细胞肺癌患者机体炎症方面也有突出优势。
另外,胸腔镜手术的“小切口”特点,还符合当代人们对于美容的要求,且有助于减轻患者的术后疼痛感,促进患者早期康复出院。本研究结果提示:研究组术后12、24、48 h的疼痛VAS评分以及镇痛药物使用率均较低,住院时间较短,印证了上述分析。张忠义等[15]对45例患者实行胸腔镜下肺叶切除治疗,结果提示胸腔镜手术组患者术后第1、3、5天的切口疼痛评分均较低,住院时间较短,且血清TNF-α、IL-1β及C反应蛋白水平也低于同时间点的开胸手术组,与本研究结果高度一致,亦可作为证明完全胸腔镜单向式肺叶切除+淋巴结清扫术优越性的循证依据。
综上所述,完全胸腔镜单向式肺叶切除+淋巴结清扫术在Ⅰ、Ⅱ期非小细胞肺癌切除治疗中有诸多优越性,值得借鉴。本研究因观察时间短,观察指标集中于短期效果方面,关于手术长期效果如何,有待未来进行大样本、多中心的临床试验。

