犬副流感病毒D121004株的分离鉴定及其F基因遗传进化分析
李 超,马 帅,徐守振
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 青岛市动物疫病预防控制中心,山东青岛 266100;3. 青岛农业大学动物医学院,山东青岛 266109)
犬副流感病毒感染(Canine parainfluenza virus infection)是由犬副流感病毒(Canine parainfluenza virus,CPIV)引起的,以卡他性鼻炎和急性支气管炎为病理特征的一种犬接触性病毒性传染病,主要表现为喷嚏、咳嗽以及流黏液性鼻涕等急性呼吸道炎症[1]。根据国际病毒分类委员会最新分类标准,CPIV为副黏病毒亚科茹布拉病毒属成员[2]。CPIV首先由Binn从患呼吸道病的犬中分离获得。目前,CPIV感染在世界各国普遍存在,是危害犬业的重要传染病之一[3]。
CPIV基因组主要编码6种蛋白:大蛋白( L)、血凝素神经氨酸酶(HN)、核衣壳蛋白(NP)、融合蛋白(F)、磷蛋白(P) 和基质蛋白(M),其中HN和F 蛋白突出于囊膜形成纤突,分别介导病毒吸附和穿入细胞[4],而F蛋白是产生中和抗体的主要保护性抗原,在病毒免疫中占有重要地位,由其诱导的免疫反应能够阻止病毒感染[5],故分离鉴定CPIV流行毒株,分析F蛋白基因序列的遗传变异情况,对于CPIV感染的综合防控具有重要意义。
1 材料与方法
1.1 试验材料
1.1.1 病料样品 样品来自2015年江苏省射阳县某规模化比格犬养殖场送检的,临床表现呼吸道症状的病死比格犬,经胶体金试纸检测鼻腔拭子为CPIV阳性。无菌采集病死犬脑、肺脏等组织样品,保存备用。
1.1.2 试剂 琼脂糖、氯仿、无水乙醇、EDTA、溴酚兰:购自天津化学试剂三厂;RNA酶抑制剂、Taq DNA聚合酶、dNTP、2 000 bp DNA Marker、PMD19-T载体试剂盒:购自大连宝生物工程有限公司;DMEM、胎牛血清:购自GIBCO公司;反转录酶、EasyPure Viral DNA/RNA提取试剂盒:购自北京全式金生物技术有限公司公司;琼脂糖凝胶回收试剂盒:购自OMEGA公司。
1.1.3 细胞 0.5%鸡红细胞悬液、Marc-145细胞:本实验室制备和保存。
1.1.4 仪器 CO2细胞培养箱、紫外凝胶成像系统、组织匀浆机、B2型生物安全柜、高速冷冻离心机、PCR扩增仪、低速离心机、掌上离心机、37 ℃恒温水浴锅、微波炉、冰箱、超低温冰柜(-80 ℃)、万分位分析天平、核酸电泳扩增仪。
1.2 试验方法
1.2.1 病料处理准备 将无菌采集的病死犬脑和肺脏样品,加入DMEM溶液后充分研磨,再加入1%双抗,制成10%的悬液;将病料研磨液反复冻融3次,5 000 r/min 4 ℃离心20 min,取上清液,过滤除菌后-80 ℃保存备用。
1.2.2 病毒分离 将Marc-145细胞复苏、传代,在细胞传代后约22 h进行病毒分离。分离方式:采用5%比例吸附接种,置37 ℃ 5% CO2培养箱中吸附2 h,弃掉病料上清液,换含2%胎牛血清的维持液,继续培养24 h,观察细胞病变情况,盲传3代;将每代的细胞培养液均保存于-80 ℃。设未接种病料组织研磨液上清的Marc-145细胞作为对照,采用第3代盲传的细胞培养液上清进行病毒鉴定。
1.2.3 鸡红细胞凝集特性试验鉴定 取SPF鸡血液,制备0.5%的新鲜鸡红细胞悬液;将细胞培养物(F3)反复冻融3次后,离心取上清液,参考文献[6],采用微量法,4 ℃条件下,在96孔V型板上对细胞培养物上清进行红细胞凝集试验(HA),测定细胞培养上清对鸡红细胞的血凝特性及病毒血凝效价,同时以正常细胞液作对照。
1.2.4 细胞培养物RT-PCR鉴定 参照文献[3-8]建立的CPIV RT-PCR鉴定方法,由北京六合华大基因科技股份有限公司合成可扩增NP蛋白的基因引物CPIV-1/CPIV-2;取细胞培养上清液,采用EasyPure Viral DNA/RNA提取试剂盒提取病毒RNA,并进行RT-PCR鉴定。同时设阳性对照组(梅里亚犬副流感病毒活疫苗株)及阴性对照组。
1.2.5 F蛋白全基因RT-PCR扩增及测序 参照文献[5]合成CPIV F蛋白全基因扩增引物CPIV-P/CPIV-F(表1),采用RT-PCR方法进行F蛋白全基因扩增,扩增产物连接载体后送至北京六合华大基因科技股份有限公司进行序列测定。

表1 本试验应用的引物序列
1.2.6 F蛋白全基因核苷酸同源性分析 从GeneBank下载CPIV参比序列(表2),采用MegAlign软件,将参比毒株与分离株的F蛋白全基因序列进行核苷酸的同源性分析。
表2 CPIV参比毒株详情
1.2.7 F蛋白全基因遗传进化分析 将参比序列与分离株序列导入MEGA5.1软件,采用最大拟然法绘制遗传发育进化树,进行F蛋白全基因遗传进化分析。
2 结果
2.1 细胞病变观察
病料上清采用单层吸附接种于猴肾Marc-145细胞后,在盲传至第3代时,出现较为明显的细胞病变(CPE),具体表现为细胞边缘不清晰、拉网、聚堆等,而未接种病料上清的Marc-145细胞,培养96 h后仍生长良好,边缘清晰,形状统一(图1)。将第3代细胞培养物上清置于-80 ℃冰箱冻存,做病毒鉴定。
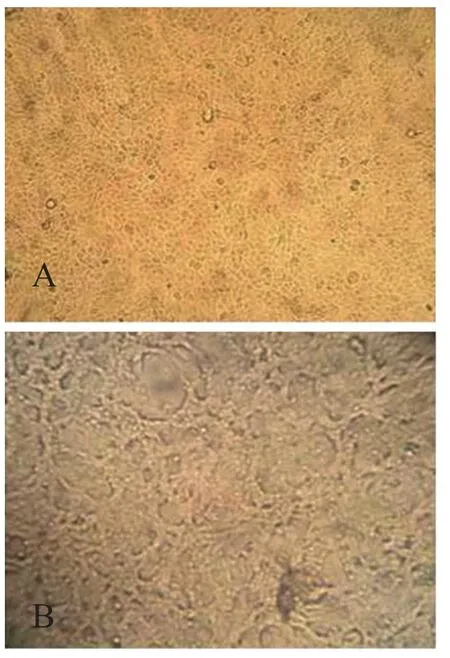
图1 Marc-145细胞的细胞病变效应
2.2 鸡红细胞凝集试验鉴定
鸡红细胞凝集鉴定结果显示:4 ℃条件下,Marc-145细胞培养物液上清可对0.5%的新鲜鸡红细胞悬液产生显著的凝集作用,病毒血凝(HA)效价为26,未接种病料上清液的正常细胞液不产生鸡红细胞凝集现象。
2.3 RT-PCR鉴定
细胞培养物上清液经RT-PCR扩增,取 PCR产物进行凝胶电泳分析,可见细胞培养上清液与阳性对照在约667 bp处出现明亮条带,而阴性对照无明显条带(图2),表明成功分离到1株CPIV,将其命名为CPIV-D121004。

图2 细胞培养上清液RT-PCR鉴定
2.4 F蛋白全基因扩增
对CPIV F蛋白全基因测序引物进行RTPCR扩增,取扩增产物进行凝胶电泳分析,可见在约1 825 bp处出现明亮单一条带(图3),显示成功扩增出CPIV-D121004 株的 F蛋白全基因。
2.5 F基因核苷酸同源性分析

图3 F蛋白全基因PCR扩增结果

图4 CPIV-D121004与参比毒株的F基因核苷酸同源性分析结果
F基因同源性分析结果显示,分离株CPIV-D121004F基 因 与FC毒 株(2007年,登录号EF546392.1)核苷酸同源性最高,为99.5%,与我国的FA毒株(2007年,登录号EF487542.1)核苷酸同源性为99.3%,与韩国的毒(CDV)、犬细小病毒(CPV)、CPIV的多重PCR方法。这些方法的特异性、灵敏性和重复性均较好,为CPIV的分离鉴定及流行病学调查奠定了基础。CPIV具有凝集鸡红细胞的能力,与其他具有血凝性的病毒不同,它需要在4 ℃条件下进行。闫喜军等[10]采用HA/HI试验进行CPIV血清抗体流行病学调查,证明4 ℃条件下可以进行CPIV的快速鉴定试验。CPIV可在Vero、Marc-145等细胞中良好生长,相对于CDV而言,CPIV较容易通过细胞接种分离获得,方便进一步研究。
F蛋白是CPIV的主要保护性抗原,其基因的遗传变异对于CPIV 预防有着重要影响,特别是重要抗原位点的变化可能会导致疫苗免疫保护1168-1毒株(2009年,登录号AF014953)核苷酸同源性为99.0%;与韩国的D277毒株(2008年,登录号KC237065.1)同源性最低,为96.0%。总体来说,该分离毒株的F基因相对保守,与其他参考毒株的核苷酸同源性普遍较高。详细分析结果见图4。
2.6 F基因遗传进化分析
遗传进化分析显示,CPIV-D121004与2007年的FC毒株(登录号EF546392.1)遗传关系最近。两毒株与2007年分离自我国的FA毒株(登录号EF487542.1),与1980年分离自美国的CPIV+(登录号JQ743320.1)、CPIV-(登录号JQ743320.1)毒株,以及与2009年分离自韩国的1168-1毒株(登录号AF014953)共同组成一小分支,在进化树上形成一簇(图5)。
3 讨论

图5 分离毒株与参比毒株F基因序列系统发育进化树
刘腾飞[3]、赵国清等[6]、王凤雪等[7]、康泰等[8]、简子健等[9]先后建立了针对CPIV的特异性RT-PCR检测方法,以及针对犬瘟热病不全面[4]。本试验对CPIV-D121004株F基因与参考毒株进行了同源性分析,并基于F基因绘制了遗传进化树,发现CPIV-D121004的F基因相对保守,与其他参考毒株的核苷酸同源性普遍较高,这与孙明等[4]、闫喜军[5]等研究结果一致。遗传进化分析显示,CPIV-D121004与分离自我国的CPIV-FA毒株(2007年,登录号为EF487542.1)和疫苗毒株CPIV-FC(2007年,登录号为EF546392.1)处于同一个进化分支,说明该分离株未出现大的遗传变异。下一步需要对分离株的免疫原性进行研究,探究其是否具有作为候选疫苗株的潜力。
近年来,随着生物医药的蓬勃发展,比格犬作为实验动物在医药评价中的作用日益显著。CPIV对比格犬的危害程度虽不如CDV和CPV严重,但是该病毒感染犬后,可使机体抵抗力显著降低,出现发热、咳嗽、流涕等临床症状,继而容易导致巴氏杆菌、大肠杆菌等其他病原菌侵入而发生感染[11]。CPIV是秋冬季节诱发比格犬呼吸道症状的主要病原体,但抵抗力不强,在酸碱环境中易被破坏而失活,一般的常见消毒药均可将其杀死,因此当暴发CPIV诱发的犬呼吸道传染病时,应及时做好环境消毒工作,防止细菌继发感染。

