沙门氏菌LAMP可视化检测方法的建立
高志强,汪 琳,张 灿,任 彤,赵相鹏,尹 羿,蒲 静,史雅然,刘凤华
(1.北京检验检疫技术中心,北京 100026;2.中国人民解放军疾病预防控制所,北京 100071;3.北京农学院,北京 102206)
沙门氏菌病是一种常见的人畜共患病,临床上以败血症和急慢性肠炎为特征,但染病动物常常不出现明显临床症状。沙门氏菌主要定殖于动物小肠,可持续性或间断性从粪便排出,从而污染环境。沙门氏菌属包含2个种,即肠道沙门氏菌(S.enterica)和邦戈沙门氏菌(S. bongori)[1],肠道沙门氏菌又包含6个亚种。沙门氏菌病的感染过程、临床表现、病理及流行病学特征与菌株特征和动物种类相关。一般来说,幼龄动物和怀孕动物最易感。多数血清型的菌株能引起多种动物发病。某些血清型的菌株具有宿主特异性,如羊流产沙门氏菌,猪霍乱沙门氏菌,驼都柏林沙门氏菌,鸡白痢和禽伤寒沙门氏菌以及马流产沙门氏菌,这些血清型的菌株或引起动物的败血症,或导致动物的细菌性下痢,有的则引起怀孕动物流产。沙门氏菌还是一种具有重要公共卫生意义的微生物,据美国疾病控制与预防中心(CDC)统计,每年全美约有120万人发生沙门氏菌感染,超过2.3万人住院[2]。通常的感染原因是食用了被沙门氏菌污染的肉、蛋、奶等,也可通过与感染沙门氏菌的鸟、家畜、犬、猫以及两栖和爬行动物接触而发生感染,其中猪霍乱沙门氏菌和都柏林沙门氏菌可引起人的严重疾病。
由于动物的沙门氏菌病从临床表现上很难与其他疫病鉴别,通常需要进行实验室检测,传统的检测方法大多为增菌和选择培养,然后通过生化方法和血清学方法进行鉴定,一般需要4 d以上。替代性检测方法包括免疫磁珠分离方法、定量RTPCR方法、ELISA以及芯片检测方法[3-4],这些方法都不能实现沙门氏菌的快速现场检测。本研究采用基于HNB可视化显色的方法,针对沙门氏菌侵袭因子A基因(invA)建立了LAMP检测技术,通过特异性和灵敏度评价,将其应用于进境动物样本检测。
1 材料与方法
1.1 材料
1.1.1 核酸及被检样品 大肠杆菌top10、鼠伤寒沙门氏菌Sal-BJ01、肠炎沙门氏菌Sal-BJ02、志贺氏菌(BJ01)DNA,以及猪链球菌2型C55606 DNA :本实验室保存;布鲁氏菌试管凝集抗原、炭疽沉淀抗原、鸡白痢及禽伤寒沙门氏菌凝集抗原以及马流产试管凝集抗原:购自中国兽医药品监察所;猴粪拭子样品200份:本实验室保存。
1.1.2 主要试剂和设备 细菌基因组DNA提取试剂盒(DP302):购自天根生化科技有限公司;Bst DNA聚合酶:购自NEB公司;dNTP等:购自TaKaRa公司;羟基萘酚蓝(HNB):购自Fluka公司;毛细管电泳仪QIAxcel:QIAGEN公司产品。
1.2 方法
1.2.1 引物的设计合成 根据已知的沙门氏菌侵袭因子A基因(invA)序列,使用在线软件Primer Explorer version 4(http://primerexplorer.jp/elamp4.0.0/index.html )设计1套LAMP引物。设计的引物经blast分析确认其保守性,委托上海生工进行合成。引物探针名称、序列及靶基因见表1。

表1 引物名称、序列及靶基因
1.2.2 反应体系优化 采用25μL 体系,以5 μL 10-5稀释的沙门氏菌DNA作为模板,基础体系为1×ThermoPol 缓冲液、16U Bst DNA聚合酶,betaine 浓度固定为0.8 mol/L,HNB浓度固定为0.12 mmol/L,dNTPs浓度固定为200 nmol/L,外引物量固定为5 pmol。内引物量从40~120 pmol,以20 pmol量递增;MgSO4浓度从1.0~5.0 mmol/L,以0.5 mmol/L递增;筛选最适合MgSO4浓度和最佳内引物量。反应条件为60 ℃ 1 h。
1.2.3 反应温度优化 为确定最佳反应温度,LAMP 从 60~65℃ ,以 1 ℃ 进行递增,对 5 μL 鼠伤寒沙门氏菌DNA进行检测,以10 min为间隔,观察反应管颜色变化,确定最佳反应温度。
1.2.4 灵敏度试验 对鼠伤寒沙门氏菌Sal-BJ01菌液,通过平板计数测定其浓度,然后使用灭菌生理盐水作10倍倍比稀释,应用优化的反应体系,分别对0.2 mL 10-2~10-7稀释的沙门氏菌DNA进行检测,确定其检测灵敏度。
1.2.5 特异性试验 应用建立的反应体系对大肠杆菌DNA、志贺氏菌DNA、猪链球菌2型C55606DNA、布氏杆菌试管凝集抗原DNA、炭疽沉淀抗原DNA、肠炎沙门氏菌Sal-BJ02 DNA、鸡白痢及禽伤寒沙门氏菌凝集抗原DNA以及马流产试管凝集抗原DNA进行检测,以验证方法的特异性。
1.2.6 重复性试验 分别对0.2 mL 10-3~10-5稀释的沙门氏菌菌液提取DNA,应用建立的LAMP方法进行检测,每个稀释度均进行3次重复,以验证方法的可重复性和稳定性。
1.2.7 进境动物检疫样品检测 对本单位收集的200份猴粪拭子样品进行验证,为保证检出率并去除死菌DNA干扰,首先使用亚硒酸盐培养基(SF)进行增菌后,然后应用建立的LAMP方法与细菌分离鉴定同步进行检测比较。
2 结果
2.1 反应体系优化
经多次重复试验确立最终反应体系:5 μL RNA 模板,1×ThermoPol 缓冲液,4 mol/L betaine 5 μL,0.1 mol/L MgSO40.5 μL,10 mmol/L dNTPs 1 μL,3 mmol/L HNB 1 μL,5 pmol F3 和 B3,40 pmol FIP和 BIP,20 pmol LF和 BF,16U Bst DNA聚合酶。阳性反应管为天蓝色,而阴性反应管为紫罗兰色,显色反应结果与电泳结果一致。
2.2 反应温度试验
反应温度试验结果显示,61 ℃效果最好,因此选择61 ℃作为最佳反应温度。
2.3 灵敏度试验
经平板计数测定,鼠伤寒沙门氏菌Sal-BJ01菌液浓度为3.6×107CFU/mL,应用建立的LAMP反应体系可以检出0.2 mL稀释至3.6×101CFU/mL菌液所提取的DNA(图1)。对LAMP产物进行电泳,可见特异性梯状条带(图2)。结果表明,该方法的检测灵敏度为3.6×101CFU/mL。

图1 LAMP 灵敏度试验眼观检测结果
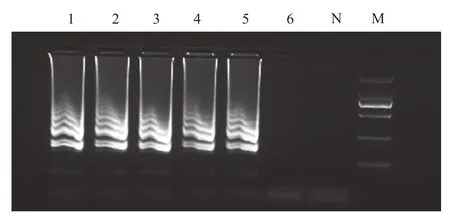
图2 LAMP 灵敏度试验电泳检测结果
2.4 特异性试验
应用建立的反应体系对肠炎沙门氏菌Sal-BJ02 DNA、鸡白痢及禽伤寒沙门氏菌凝集抗原DNA、马流产试管凝集抗原DNA、大肠杆菌DNA、志贺氏菌DNA、猪链球菌2型C55606DNA、布氏杆菌试管凝集抗原DNA以及炭疽沉淀抗原DNA进行检测,以验证方法的特异性。结果显示,可以检出肠炎沙门氏菌Sal-BJ02 DNA、鸡白痢及禽伤寒沙门氏菌DNA和马流产试管凝集抗原DNA,但不能检出其他病原核酸(图3)。
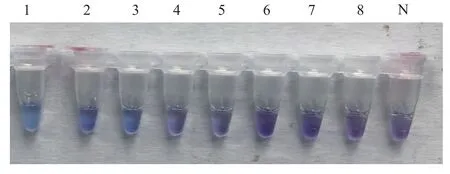
图3 LAMP 特异性试验检测结果
2.5 重复性试验
连 续 3次分别对稀释至 3.6×104~3.6×102CFU/mL 0.2 mL菌液提取的DNA进行检测。结果显示,3个稀释度菌液DNA的3次重复检测均为阳性,表明所建立方法的重复性可以满足要求。
2.6 送检样品检测
对200份进境猴粪拭子样品经亚硒酸盐培养基进行增菌,应用建立的检测方法进行检测,发现2份为阳性,与分离鉴定的检测结果完全一致,表明建立的方法适用于进境动物样品的检测。LAMP眼观结果见图4,产物毛细管电泳结果见图5。

图4 2份阳性样品的眼观检测结果
3 讨论
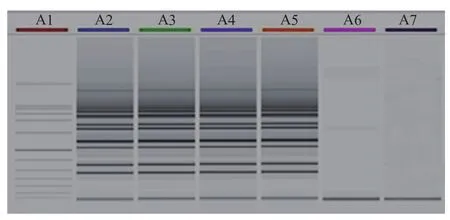
图5 2份阳性样品LAMP 产物毛细管电泳结果
沙门氏菌病可以造成多种动物感染,临床上往往难以鉴别。例如幼龄禽类感染沙门氏菌,其败血型临床表现与其他很多细菌类感染非常相似;禽沙门氏菌感染引起的关节炎临床上与其他病原引起的滑膜炎或滑囊炎难以鉴别;猪霍乱沙门氏菌引起猪的败血性病变与猪瘟相似;小牛的急性沙门氏菌性肠炎与牛的球虫病症状相似。此外,羊流产沙门氏菌、贝氏柯克斯体、羊流出衣原体和羊布氏杆菌等均可引起绵羊流产,同样难以从临床上鉴别[2]。对于沙门氏菌病的病原检测,经典方法仍然是细菌分离培养,费事耗力。替代性检测方法包括免疫磁珠分离结合ELISA或PCR的检测,其可在24 h完成,但检测流程相对复杂。对样品中的核酸进行检测可进一步缩短时间并简化流程,目前已经开始广泛应用,但主要见于食品中沙门氏菌的检测应用[5]。因此,需要加强研制快速检测沙门氏菌的方法。
本研究以进境动物检疫样品中沙门氏菌invA基因作为检测目标,设计了一套针对8个检测区域的LAMP引物,建立了沙门氏菌的LAMP检测技术。由于引物设计对于LAMP方法建立至关重要,引物序列往往决定了LAMP方法的灵敏度和特异性。研究表明沙门氏菌inv基因家族具有属特异性,因此本研究选择沙门氏菌的属特异性基因进行引物设计,设计的引物可覆盖6个亚种的肠道沙门氏菌,并经本研究验证可特异性检出鼠伤寒沙门氏菌,肠炎沙门氏菌,鸡白痢和禽伤寒沙门氏菌凝集抗原以及马流产沙门氏菌试管凝集抗原,但与其他动物病原菌DNA无交叉反应。
LAMP开盖检测容易发生气溶胶污染,因此采用更严格的分区管理措施非常必要。此外,通过加入指示剂实现可视化判定对于防止污染、简化流程具有现实意义。本研究使用了HNB作为指示剂,阳性反应管呈天蓝色,而阴性反应管仍为紫罗兰色。由于进出口动物检疫样品的复杂性,样品中可能存在污染的灭活DNA,因此在LAMP检测前,对样品进行选择性预增菌培养,不仅可减少干扰,还可提高检出率。在对200份进境动物检疫样品的检测中,采取增菌培养后进行检测,检出2份沙门氏菌阳性,与细菌分离鉴定检测结果一致。证实了该方法的实用性。
4 结论
本研究采用基于HNB可视化显色的方法,针对沙门氏菌侵袭因子A基因(invA)建立了LAMP检测技术。该方法的最佳反应温度为61℃,检测灵敏度为 3.6×101CFU/mL;特异性较好,与大肠杆菌DNA、志贺氏菌DNA、布鲁氏菌试管凝集抗原DNA、炭疽沉淀抗原DNA以及猪链球菌2型DNA不发生交叉反应;重复性可满足实际要求,送检样品的检测结果与细菌分离鉴定一致。试验表明,该方法适用于进境动物样品的沙门氏菌快速检测。

