西藏拉萨市鸡源沙门氏菌分子生物学鉴定与血清分型
王 燕,刘会杰,马弘财,曾江勇,元振杰
(西藏自治区农牧科学院畜牧兽医研究所,西藏拉萨 850009)
沙门氏菌是一种可以引起人和动物腹泻的病原菌,也是一种常见的食源性致病菌,禽蛋、家禽和肉类产品是其主要传播媒介,人类食入被沙门氏菌污染的食品,可引发公共卫生事件,因此做好沙门氏菌流行调研、分离鉴定,了解其血清型分布,具有重要的公共卫生意义。血清型是沙门氏菌的重要分类依据[1-2],是研究沙门氏菌流行情况和进行公共卫生检测的重要参数,及时了解和掌握养殖动物中的沙门氏菌血清型分布,对研究沙门氏菌流行态势及其追踪溯源具有重要价值[3]。
沙门氏菌血清型由菌体抗原(O)、鞭毛抗原(H)和荚膜抗原(Vi)决定,而O和H抗原是绝大部分沙门氏菌属血清型鉴定的物质基础[3]。本研究选择拉萨市养鸡业相对集中的城关区、曲水县、达孜县、墨竹工卡县、堆龙区5个县(区),选择12个具有代表性的规模养鸡场进行采样检测,开展沙门氏菌分子生物学鉴定,并利用菌体抗原(A-F)诊断血清,做鸡源沙门氏菌血清分型试验,同时设计致病性试验,以期为西藏地区沙门氏菌病防控提供参考。
1 试验材料
1.1 主要仪器
恒温培养箱:美国SHELLAB公司,型号SMI7-2;生物安全柜:青岛海尔生物医疗股份有限公司,型号HR40-IIA2;全自动纯水仪:四川优普超纯科技有限公司,型号UPS-III-40;
高速冷冻离心机:Thermo Fisher,型号ST40 ST40R;PCR仪:BIO-RAD,型号C1 000 TM Thermal Cycler;电泳设备:BIO-RAD;全自动凝胶成像系统:BIO-RAD,型号Gel Doc XR+;光学显微镜:Leica,型号DM3000 LED;全自动高压蒸汽灭菌锅:CIRRUS-250。
1.2 主要试剂
沙门氏菌快速鉴别培养基、麦康凯培养基、LB培养基、伊红美兰肠杆菌、BS琼脂培养基:购自青岛海博生物公司;沙门氏菌生化编码微量鉴定管:购自杭州天和微生物试剂有限公司;沙门氏菌菌体抗原(A-F)诊断血清:购自杭州天和微生物试剂有限公司;沙门氏菌标准菌株:西藏农牧科学院畜牧兽医研究所微生物实验室提供;PCR反应试剂:购自宝生物公司。
1.3 被检样品
2017年3—4月,采集于拉萨市城关区、曲水县、达孜县、墨竹工卡县、堆龙德庆县12个集约化养鸡场的疑似沙门氏菌病发病鸡样品,共计121份。
2 试验方法
2.1 细菌分离培养
对病死鸡,解剖后采集病变组织;对发病商品鸡和种鸡,采集泄殖腔拭子;对环境用具等,采集表面拭子。采用无菌操作,取待检样品分别接种于沙门氏菌快速鉴别平板、麦康凯平板、伊红美兰平板、BS琼脂平板,37 ℃恒温培养18~24 h后,观察结果[4]。
2.2 细菌染色镜检
分别挑取单个可疑菌落,固定并进行革兰氏染色镜检[5]。
2.3 生化鉴定
根据《伯杰氏细菌鉴定手册》第九版和沙门氏菌编码生化鉴定管说明书要求,挑取培养好的新鲜菌落或菌液分别接种于赖氨酸脱羧酶、靛基质、尿素酶、氰化钾、硫化氢、山梨醇、甘露醇、水杨苷、丙二酸盐、卫矛醇、ONPG及葡萄糖、乳糖、蔗糖、麦芽糖、阿拉伯糖生化鉴定管,37 ℃恒温培养1 d[6-7],观察并记录试验结果。
2.4 血清型鉴定
接照沙门氏菌属诊断血清说明书要求,首先将沙门氏菌接种于LB培养基,37 ℃培养16~18 h,离心后用灭菌生理盐水稀稀至规定浓度,取1滴沙门氏菌A-F诊断血清滴于洁净的玻片上,再加入1滴制备的沙门氏菌液,摇动玻片混匀,在5 min 内观察结果,发生凝集现象的即为阳性,同时设生理盐水和标准菌株对照[8-9]。用同样方法,依次用A(O2)、B(O4)、C1(O7)、C2(O8)、D(O9)、E(O3)的O血清做玻片凝集试验,确定血清群。
2.5 分子生物学鉴定
2.5.1 引物设计 根据Genbank中已发表的序列,参照文献[10]设计invA基因特异性引物,引物序列见表1。
2.5.2 模板制备 挑取单个菌落置于50 μL离心管内,加20 μL 双蒸水混匀,95 ℃水浴10 min,-20 ℃静置10 min,于 4 ℃ 12 000 r/min 离心2 min,取上清4 ℃保存备用。
2.5.3 PCR反应体系 反应体系为50 μL:DNA模板 1 μL,10×PCR 缓冲液(含 MgCl2)5 μL,dNTP 2 μL,P1、P2 各 1 μL,TaqDNA 聚合酶0.5 μL,dd-H2O 39.5 μL。

表1 invA基因引物序列
2.5.4 PCR 反应条件 94 ℃ 8 min;94 ℃ 40 s,52 ℃ 45 s,72 ℃ 1 min,共进行34个循环;最后72 ℃延伸10 min。设不加DNA 模板的反应体系溶液作为空白对照。
2.5.5 PCR反应产物检测 配30 mL 1.5 %琼脂糖于微波炉完全溶化,加入3 μL溴化乙锭混匀,待冷至80 ℃时倒板,完全凝固后拔出梳子,每孔加PCR扩增产物3 μL,以溴酚蓝作指示剂,于0.5×TBE中130 V电压电泳30 min,检测扩增产物。
2.6 动物致病性试验
将120只7日龄健康雏鸡随机分为20组,每组6只。其中:18组分别皮下接种菌液,每只接种菌液0.2 mL(3×109CUF/mL);2组为对照组,一组接种沙门氏菌标准株菌液(3×109CUF/mL),另一组接种生理盐水。接种后,每隔1 h,观察并记录鸡的临床情况[11]。
3 结果与分析
3.1 细菌分离
对所采集的121份样品进行细菌分离,共分离出109株细菌,其中符合沙门氏菌生长特征的107株。挑取单个菌落进行革兰氏染色镜检,发现所分离的细菌为革兰氏阴性、两端钝圆的短杆菌,长约1~5 μm,符合沙门氏菌特征(图1)。
3.2 生化鉴定
对所分离出的107株可疑菌株进行赖氨酸脱羧酶、靛基质、尿素酶、氰化钾、硫化氢、山梨醇、甘露醇、水杨苷、丙二酸盐、卫矛醇、ONPG及葡萄糖、乳糖、蔗糖、麦芽糖、阿拉伯糖试验,确定有104株符合沙门氏菌特征(图2)。

图1 鸡源性沙门氏菌革兰氏染色镜检形态(10×100)
3.3 血清型鉴定
对所分离的104株沙门氏菌进行血清型分型鉴定,发现这104株菌共属于4个血清群,其中A群(O2)13株、C1群(O7)29株、C2群(O8)9株、D群(O9)53株,优势血清群为D群(51%)和C1群(27%)。
3.4 分子生物学鉴定
对所分离的沙门氏菌进行PCR扩增,发现所分离菌株和标准阳性对照均扩增出invA基因片断,大小为372 bp,表明所分离的沙门氏菌为致病性沙门氏菌。空白对照组为阴性,无特异性条带出现(图3)。
3.5 动物致病性试验
雏鸡接种所分离到的细菌6 h左右开始发病,表现精神沉郁,不食或少食,8 h后开始腹泻,拉白色粪便,表明所分离的沙门氏菌具有致病性。接种后感染率达100%,生理盐水对照组感染率为0。
4 讨论
鸡源沙门氏菌病是鸡的常见传染病之一[12],分为鸡白痢、鸡伤寒和鸡副伤寒[13],严重影响种鸡受精率、种蛋孵化率、雏鸡成活率、饲料利用率和商品蛋的品质[14],对养鸡业危害极大[15],而蛋品和鸡肉质的好坏也关系到消费者健康。本研究在拉萨市养鸡密集的城关区、曲水县、达孜县、墨竹工卡县、堆龙德庆县5个县(区),选择有代表性的12个养鸡场疑似发病鸡采样,进行细菌分离鉴定和血清分型。

图2 鸡沙门氏菌生化鉴定结果
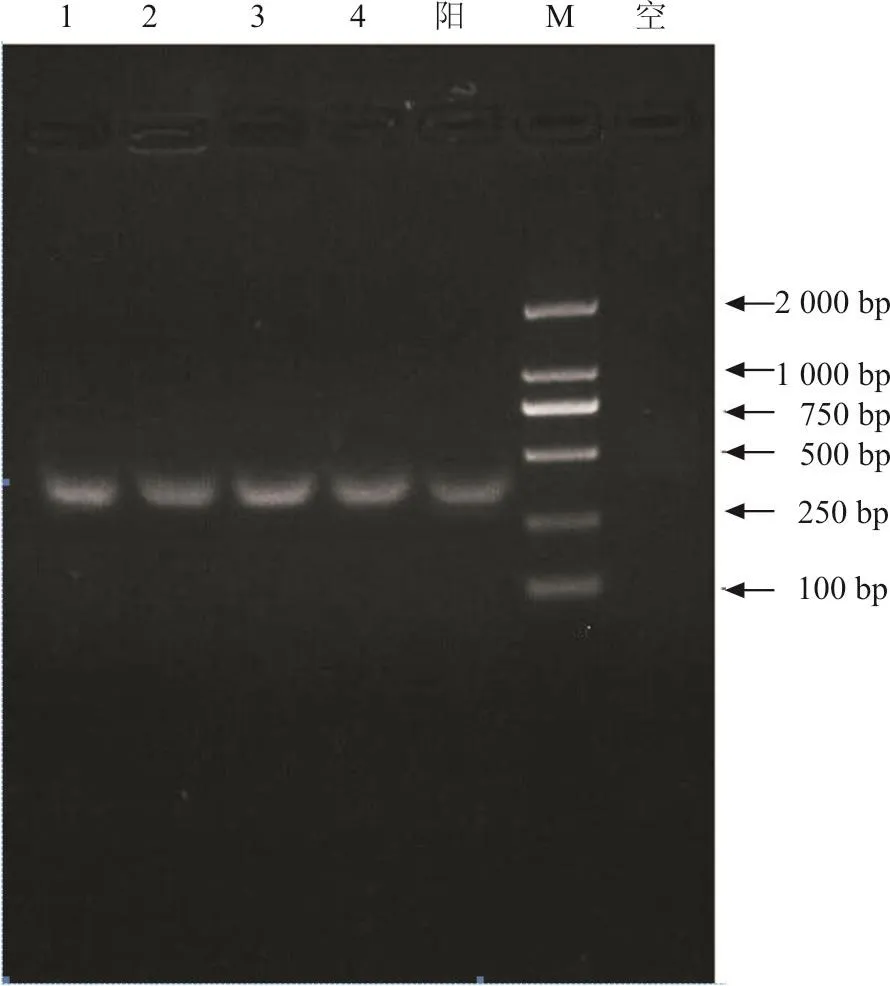
图3 沙门氏菌PCR鉴定结果
所有菌株呈A-F血清群凝集试验阳性,表明可能均为致病性沙门氏菌。目前拉萨市的优势血清群为D群(占51%),其次为C1群(占28%),另外还存在A群、C2群。动物感染试验显示,所分离的沙门氏菌能引起雏禽发病,也表明所分离的沙门氏菌为致病性沙门氏菌。沙门氏菌inv基因簇与沙门氏菌的致病性有关,决定了其通过肠粘膜侵入宿主上皮细胞的能力,其中invA是沙门氏菌的主要毒力因子,因此对invA基因的检测是识别致病性沙门氏菌的有效方法。
近几年来西藏旅游人数逐渐增多,导致高原畜禽产品需求增加,因而带动了畜禽养殖业的快速发展。但该地养鸡场饲养管理技术较滞后,仍采用过去的饲养管理方法,多数鸡舍环境卫生状况较差,通风不良,没有严格执行定期消毒制度,致使沙门氏菌等大量微生物在鸡舍环境中滋生,从而给当地的禽产品卫生安全带来威胁。因此,当地政府在大力发展规模化养殖业的同时,也要加大农牧技术培训力度,推进养殖设备、饲料、兽药、消毒剂等供销市场的建设。

