MSCT在介入治疗泌尿系统医源性出血中的应用
,,,,
(福建医科大学附属泉州第一医院影像科,福建 泉州 362000)
医源性出血是泌尿系统手术及操作中少见的并发症之一,但可导致出血性休克甚至危及患者生命。对发生在泌尿系统不同部位的医源性出血患者,应及时明确出血位置并采取合理手段进行临床干预。本研究主要探讨术前MSCT增强扫描的对泌尿系统不同部位医源性出血介入治疗的价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年2月—2018年4月因泌尿系统不同部位医源性出血接受介入治疗的27例患者的资料,男20例,女7例,年龄28~72岁,中位年龄54岁;均为泌尿系统病变外科手术后持续出血,其中经皮肾镜取石术(percutaneous nephrolithotomy, PCNL)17例,肾脏肿瘤术后7例,肾上腺肿瘤术后2例,肾脏穿刺活检1例;其中持续性肉眼血流15例,造瘘管(或引流管)持续性引流出血性液体11例,膀胱巨大凝血块导致突发排尿困难1例;3例出现休克症状。
1.2 仪器与方法
1.2.1 术前MSCT检查 采用GE LightSpeed 64排螺旋CT扫描仪,于介入治疗前行MSCT检查。于常规平扫后行增强扫描,对比剂为碘克沙醇(320 mgI/ml),以高压注射器经肘正中静脉注射,剂量0.5~2.0 ml/kg体质量,流率3.0 ml/s。扫描参数:管电压 120 kV,自动管电流技术,层厚10 mm,层间距 10 mm。对比剂注射后28~30 s为动脉期,70~80 s为静脉期。将图像数据传至AW 4.6工作站,采用VR、MPI、MPR技术进行后处理,以判定出血的责任血管,增强扫描动脉期图像重建层厚0.625 mm。
1.2.2 介入治疗 采用Innova 3100 DSA系统引导介入治疗。以改良Seldinger技术进行穿刺,选择股动脉或桡动脉入路置入动脉鞘,将5F导管选择至相应动脉造影,而后根据显影情况以微导管超选择后进行造影,判定出血责任血管。对首次DSA无法认定责任血管者,参考术前增强MSCT表现将微导管超选择至靶血管,再次造影确认责任血管。选用COOK白金微弹簧圈和/或明胶海绵颗粒进行栓塞。而后引入造影导管再对周围相关血管进行选择性造影,确认无出血后拔管,术毕;如发现仍有周围或侧支血管出血,则再次行微导管超选择性插管造影并栓塞后拔管,术毕。
1.4 统计学分析 采用SPSS 24.0统计分析软件。以χ2检验比较术前MSCT增强扫描与术中首次DSA对出血责任血管检出率的差异,P<0.05为差异有统计学意义。
2 结果
对26例患者(26/27,96.30%)通过术前MSCT增强扫描判定出血责任血管,包括肾脏相关性动脉20例,其中肾动脉分支15例(图1)、肾盂动脉分支1例、副肾动脉2例、肾包膜动脉2例;肾外动脉6例,其中肠系膜上动脉分支2例(图2)、肠系膜下动脉分支1例、脾动脉胰腺分支1例(图3)、髂总动脉分支2例;对1例患者(1/27,3.70%)未能明确责任血管。
MSCT平扫血肿表现为高密度占位;增强扫描中出血征象如下:①动脉期斑片状对比剂外溢14例,静脉期范围扩大,其中6例对比剂外溢位于腹腔、腹膜后及盆腔内,8例位于肾实质内;②对比剂浓聚3例(图1),均位于肾实质内;③肾静脉早期显影9例,动脉期即可见肾静脉显影,其中5例合并对比剂浓聚征象。
对24例(24/27,88.89%)通过术中首次DSA判定出血责任血管,包括肾脏相关性动脉18例(其中肾动脉分支13例、肾盂动脉分支1例、副肾动脉2例、肾包膜动脉2例);肾外动脉6例,其中肠系膜上动脉分支2例(图2)、肠系膜下动脉分支1例、脾动脉胰腺分支1例、髂总动脉分支2例;对3例患者(3/27,11.11%)未能明确责任血管。
出血的DSA征象:①12例表现为对比剂外溢至腹腔、腹膜后、肾实质或肾盂内;②3例为假性动脉瘤,表现为肾分支动脉旁对比剂浓聚,呈类圆形或不规则形状;③9例为肾动静脉瘘,表现为相邻静脉提前显影,其中5例可见肾动静脉瘘及假性动脉瘤征象同时显示。
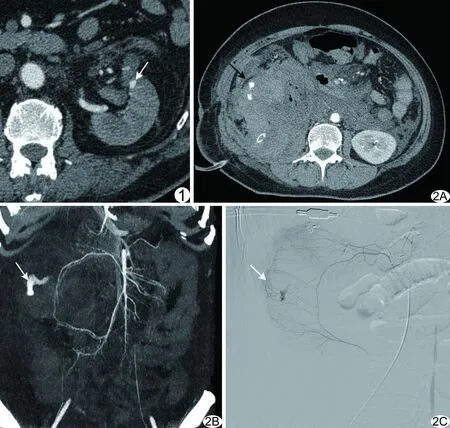
图1 患者男,70岁,左肾PCNL术后出血 介入栓塞前MSCT增强扫描轴位图像示左肾前下段对比剂浓聚(箭),判定出血责任血管为肾动脉分支 图2 患者女,50岁,右肾肿瘤根治性切除术后出血 A、B.介入栓塞前MSCT增强扫描示右侧腹腔内动脉期斑片状对比剂外溢(A,黑箭),MPR图像示肠系膜上动脉分支出血(B,白箭); C.介入栓塞术中首次DSA判定出血责任血管为肠系膜上动脉分支(箭)
术前MSCT增强扫描与术中首次DSA对出血责任血管的检出率差异无统计学意义(χ2=1.08,P=0.29)。1例术前MSCT增强扫描阴性患者,术中首次DSA表现为肾动静脉瘘。术中首次DSA阴性的3例患者,术前MSCT增强扫描表现为对比剂外溢2例、肾静脉早期显影1例;参考术前增强MSCT表现进行调整后术中再次造影明确责任血管,2例可见对比剂外溢,1例可见肾动静脉瘘。
27例中,24例经一次介入栓塞止血成功,术中均使用微弹簧圈栓塞,对其中13例加用明胶海绵颗粒栓塞;1例PCNL术后出血患者经弹簧圈栓塞3支肾动脉分支后扔持续血尿,3天后造影示原栓塞肾上极动脉管径较栓塞前增宽,提示血流开通,再次以微弹簧圈栓塞后达到止血目的(图4);2例出血责任血管分别为副肾动脉及肾盂动脉,由于血管过于纤细,无法超选择进行栓塞,转为外科手术。本组介入栓塞止血成功率为92.59%(25/27)。
3 讨论
泌尿系统医源性出血的原因包括肾脏切除、穿刺活检、PCNL术等,发病率低,但可能造成严重后果。既往临床多采取保守治疗。近年来,介入栓塞已成为主要治疗方法;术前明确出血原因及部位,有助于提高治疗成功率[1]。
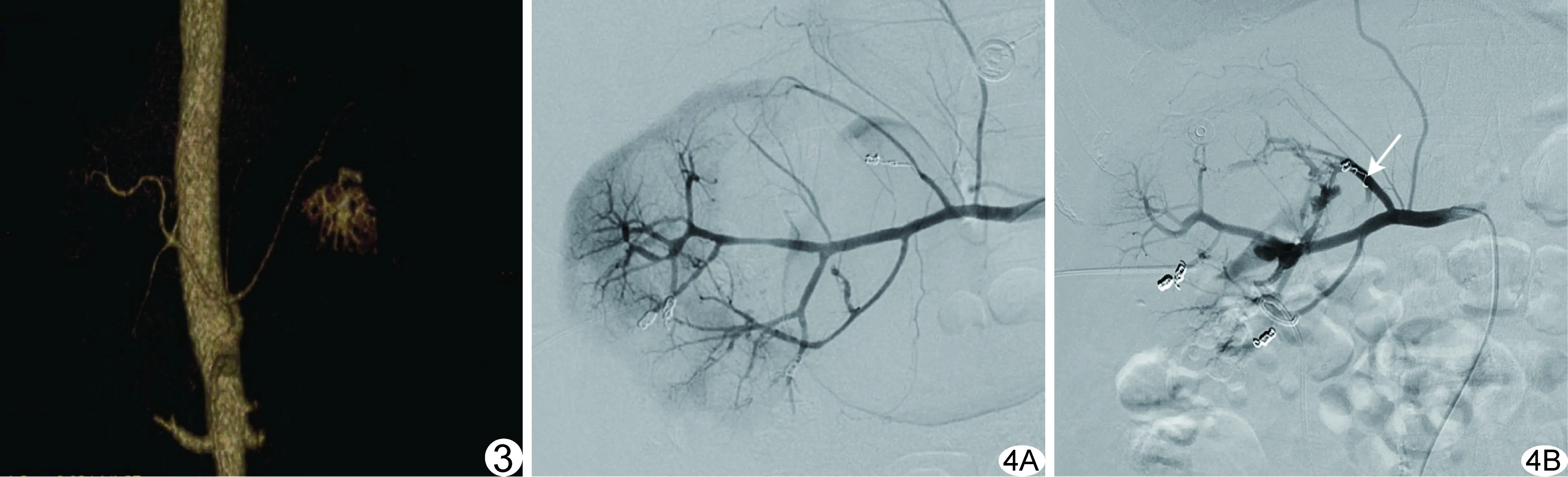
图3 患者男,52岁,左肾肿瘤根治性切除术损伤脾动脉胰腺分支导致腹腔大出血 介入栓塞前MSCT增强扫描示肿瘤供血动脉部分由脾动脉胰腺分支延伸 图4 患者男,65岁,右肾PCNL术后出血 A.介入栓塞术中首次DSA示3支肾动脉分支对比剂外溢,血管纤细,以弹簧圈进行栓塞; B.栓塞后持续血尿,3天后再次造影示右肾上极动脉分支管径明显扩张(箭),对比剂外溢,再次以弹簧圈栓塞
随着MSCT增强后处理技术水平的提高,术前对全腹或肾脏进行多期扫描,经工作站后处理重建,可观察出血部位、判断相关责任血管;介入栓塞术中亦可根据术前MSCT表现,迅速、准确地超选择至靶血管进行栓塞治疗[2]。Sommer等[3]报道,肾动脉CTA对急性肾出血的敏感度、特异度、阳性预测值和阴性预测值分别为86.8%、83.3%、98.3%和35.7%;CTA与DSA对急性肾出血的检出率分别为100%和98%,差异无统计学意义。本研究结果也显示术前MSCT增强扫描与术中首次DSA对出血责任血管的检出率差异无统计学意义。此外,MSCT增强扫描具有操作便捷、检查时间短等优点,尤其适用于急性大出血患者。
泌尿系统肾外出血的出血量大,病情危急,通过MSCT可在短时间内进行全腹扫描,从而及时发现出血点,指导栓塞治疗。本组肾外动脉出血6例,其中2例位于肠系膜上动脉分支,1例位于肠系膜下动脉分支,1例位于脾动脉胰腺分支,2例位于髂总动脉分支,术前MSCT增强扫描均明确显示责任血管(图2、3);介入栓塞术中将微导管分别超选择至靶血管后均成功栓塞止血。术前明确出血责任血管,可有效避免盲目造影,缩短介入治疗时间,降低肠管缺血、坏死风险[4]。
肾内出血MSCT与DSA征象大致相仿,均以对比剂浓聚/假性动脉瘤和肾静脉早期显影/肾动静脉瘘为主,其中假性动脉瘤具有不断扩大或破裂的风险[5]。研究[6]报道,约70%的肾动静脉瘘为获得性,主要与医源性损伤有关。损伤动静脉的内径或瘘口较大时,MSCT动脉期增强扫描可见下腔静脉显影,术前MSCT及术中DSA表现选用合适的弹簧圈是栓塞成功的关键:弹簧圈过大易造成肾实质梗死范围扩大,影响肾功能恢复;弹簧圈过小则可能穿过瘘口阻塞静脉端,存在弹簧圈移位及栓塞的风险[7-8],此时可暂时采用球囊栓塞辅助释放弹簧圈达到止血目的,并且最大程度保留正常肾单位。
虽然本研究中术前MSCT增强扫描与术中首次DSA对出血责任血管的检出率差异无统计学意义,但仍有3例术中首次DSA未明确责任血管,分析原因可能包括:①血凝块暂时阻塞责任动脉;②外科手术后使用大量收缩血管药物,导致责任血管痉挛纤细而无法显影[9];③出血缓慢,每分钟出血量≤0.5 ml,且造影导管位于肾动脉主干,出血点血流量低导致出血点未能显示;有研究[10]报道,动脉出血速度达每分钟0.5 ml以上时方可观察到对比剂外溢征象。本研究还有1例术前MSCT增强扫描未明确责任血管,考虑为出血责任血管过于纤细,且增强扫描时责任血管受压、痉挛,外溢对比剂剂量未能达到显影水平[11-12]。
虽然选择性肾动脉DSA是目前肾动脉出血检查的“金标准”,但其对于泌尿系统术后肾外出血仍无法准确显示责任动脉。MSCT属无创性检查,操作简便,成像速度快,可通过多种后处理技术实现任意角度重建,较为清晰地显示各类出血位置及其与周围血管的关系。介入栓塞术前MSCT增强扫描对泌尿系统医源性出血责任血管的检出率与术中首次DSA相似,且可为术中再次造影提供参考,有利于快速、准确地找到靶血管,提高栓塞成功率,缩短介入治疗时间,减少曝光量,保留尽可能多的正常肾单位。

