超声引导下经皮激光消融治疗进展期胰腺癌的临床研究
安超 梁萍 于杰
胰腺癌被称为“癌中之王”,发病率位列我国恶性肿瘤第7 位,死亡率位列第6 位。其发病隐匿,早期易发生转移,预后差,死亡率接近发病率。研究报道,胰腺癌的五年总体生存率仅为5%,行根治性切除术后的5 年生存率<20%[1-3]。根据发病进展,胰腺癌共分为3 类,分别是可切除胰腺癌、可能切除胰腺癌以及局部进展不可切除胰腺癌[4]。治疗原则是以手术切除为主的综合治疗,包括手术、化疗、放疗及介入治疗。但大部分患者发现时多为局部进展不可切除胰腺癌,在失去手术机会的情况下,为减缓患者痛苦,可采取其他治疗方式进行姑息性治疗,以延长中位生存期并降低疼痛。放疗和化疗属全身系统性治疗,虽然能减缓肿瘤进展,但不能达到肿瘤消除的效果,且不良反应较多[5-6]。介入治疗是近年来应用极多的可替代性微创治疗方式,治疗胰腺癌的方法主要有射频消融、高强度聚焦超声(high intensity focused ultrasound,HIFU)、放射性粒子植入及不可逆电穿孔治疗[7-10]。
激光消融为近年来发展的肿瘤微创治疗新技术,主要原理是以电源激发激励源内部的光子辐射,被激发的光子在两面镜子来回反射并激励出更多的光子(光放大过程)。其中一面镜子做成部分透明,这样激光可以从谐振腔中以很细的光束逃离并经由光学纤维导出至人体目标组织,产生热效应和光学效应,达到使目标组织消融的目的。由于其光纤纤细(直径<300 μm),尤其适合一些小器官、小肿瘤,或者邻近重要组织脏器肿瘤的治疗。开展肿瘤激光消融治疗能为肿瘤患者提供微创、疗效确切的治疗方法,对提高肿瘤患者的生存率、改善患者生活质量有着重要价值。激光消融最早研究是1993年Pacella 等[11]报道的超声引导下经皮激光消融动物实验,作者对9 只新西兰兔进行激光消融,观察术后并发症,处死后取出肝脏观察消融范围。2000年以后伴随激光消融技术的发展和高端设备的研发,激光消融治疗不同脏器肿瘤的文献陆续发表,主要包括肝脏、肾脏、前列腺、甲状腺以及腹膜后肿瘤等,技术有效率和并发症均能达到医生预期,前景良好。最近的报道是超声引导下激光消融治疗腹膜后淋巴结转移的研究,效果较好[12],但激光消融用于胰腺癌治疗在国内尚属空白。胰腺是体内最重要的消化腺体,血供丰富,周边结构复杂,介入治疗难度非常大,必须达到精准定位、适形消融、避免损伤周围脏器的要求。本研究应用超声引导下激光消融治疗胰腺癌7 例,效果较好,报告如下。
资料与方法
一、一般资料
选取2016 年9 月至2017 年10 月在我院诊治的7 例中晚期胰腺癌患者,其中男5 例,女2 例;平均年龄(66.0±2.8)岁。纳入标准∶(1)穿刺活检病理证实为胰腺癌;(2)临床分期为不可手术切除的局部进展期胰腺癌;(3)转移性胰腺癌仅限一个脏器转移,否则以缓解疼痛为主要治疗目的;(4)肿瘤位于胰腺体部和尾部;(5) 美国麻醉医师协会(American Society of Anesthesiologists,ASA)评分为Ⅰ~Ⅱ级;(6) 美国东部肿 瘤协作组(Eastern Cooperative Oncology Group,ECOG)行为状态评分0~1 分。排除标准∶(1)严重凝血机制障碍或严重心肺功能不全;(2)不可控或顽固性腹水;(3)梗阻性黄疸;(4)空腹血糖>8 mmol/L;(5)活动期胰腺炎。本研究采取前瞻性实验设计和执行流行病学增强型观察研究报道(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE),经伦理委员会研究批准,所有患者均签署知情同意书。所有患者术前均未进行放疗和化疗,在纳入研究前经过肝胆胰腺肿瘤多学科委员会讨论和评估,肿瘤分期通过国家癌症综合网络分期系统决定。
二、试验设备
使用意大利百胜ECHO LASER 集成激光介入超声系统,该设备以超声实时监测,通过21G 穿刺套针将直径300 μm 的发射光纤引导至消融目标,以单针或多针(最多4 针)精准布控系统,通过激光控制面板设定单针消融功率和消融时间,最终达到消融范围的精确控制。消融使用掺钕钇铝石榴石(Nd∶YAG)激光,输出波长1064 nm 的近红外光。
三、超声引导下经皮激光消融治疗方法
1%利多卡因经皮、软组织及腹膜下注射进行局部麻醉,激光消融调节成连续性模式,调节至可见光谱中分离出的1 064 nm 波长的激光。在超声引导下注意入针路径安全,避免损伤正常的胰腺、肠管、血管、胰管以及胆管。用一根或两根穿刺套管针插入胰腺肿瘤,针尖距离肿瘤深部边缘10 mm 而针鞘距离肿瘤下部边缘5~10 mm,随后将直径300 μm的光纤沿针鞘插入,针鞘向后方退10 mm,露出10 mm 光纤。激光消融功率调至5 W,消融能量调至3 kJ。对于直径较大的肿瘤可采取多点消融或推针消融的方式,组合形成更大热场范围,直到肿瘤区域形成高回声完全覆盖,消融停止。设备自动计算消融总能量。光纤数量主要依据肿瘤大小和位置决定,如果两根光纤被同步插入,建议将针距调为不超过1 cm,正确的布针位置和针距通过超声影像证实。激光消融完成后用超声造影评估消融效果(消融区域无肿瘤增强)。所有手术操作均由3 个具有10 年以上介入超声操作经验的医生完成。
四、消融效果评估
技术成功被定义为医生能够按照术前规划顺利完成消融。本研究针对中晚期胰腺癌患者的治疗目的对肿瘤适形消融而不是完全性根除。因此,完全消融在这里未被评估。消融效果评估使用三维可视化软件,激光消融术前及术后的MRI 影像数据被导入三维可视化系统(中国珠海和佳公司),与肿瘤相关的解剖信息以及周边临近脏器均以三维可视化影像显示。肿瘤、消融区以及胰腺体积均可自动计算,肿瘤距离临近脏器的最近距离也可自动生成。术后1 个月内的消融相关不良反应按美国国立癌症研究所事件通用术语标准3.0(National Cancer Institute -Common Terminology Criteria for Adverse Events 3.0,NCI-CTC 3.0)评价[13]。
五、术后随访
术后1 个月内进行实验室和影像学检查,之后每3 个月随访一次。在随访期间,常规检测肿瘤标记物CA-199、脂肪酶和淀粉酶等,用增强MRI 评估消融效果和发现潜在的并发症。局部或全身肿瘤进展治疗方案由多个专家共同商讨制定。按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumor,RECIST)评估治疗效果[14],记录可视化疼痛分数,采用生活质量(quality of life,QOL)评分量表于术后3 d、1 个月及间隔3 个月评估患者的生活质量。
六、统计学方法
数据采用SPSS17.0 分析,CA-199、血清脂肪酶、淀粉酶和血糖为非正态计量资料,采用M(P25,P75)表示,术前术后比较采用Wilcoxon 秩和检验;疼痛和生活质量评分为正态计量资料,采用±s 表示,术前和术后1 月、3 月的数值比较采用方差分析。以P<0.05 为差异有统计学意义。
结 果
一、患者一般临床特征
本组7 例患者的肿瘤最大直径(5.3±1.1)cm,其中1 例肿瘤位于胰腺尾部,3 例位于胰腺体部,3例位于胰腺体尾交界部。ASA 分级均为Ⅱ级。根据三维可视化软件分析,平均胰腺体积(93.2±20.4)ml,平均肿瘤体积(16.1±3.8)ml,平均消融区体积(16.1±3.8)ml,消融覆盖率达(89.1±7.4)%。
患者从诊断到激光消融治疗的中位时间是27(9~53)d。6 例术前发生转移,其中转移至肝脏4例,转移至腹膜后淋巴结2 例,转移瘤的直径均<2 cm。2 例患者使用1 根光纤,5 例患者使用2 根光纤。其他临床特征及手术参数见表1。
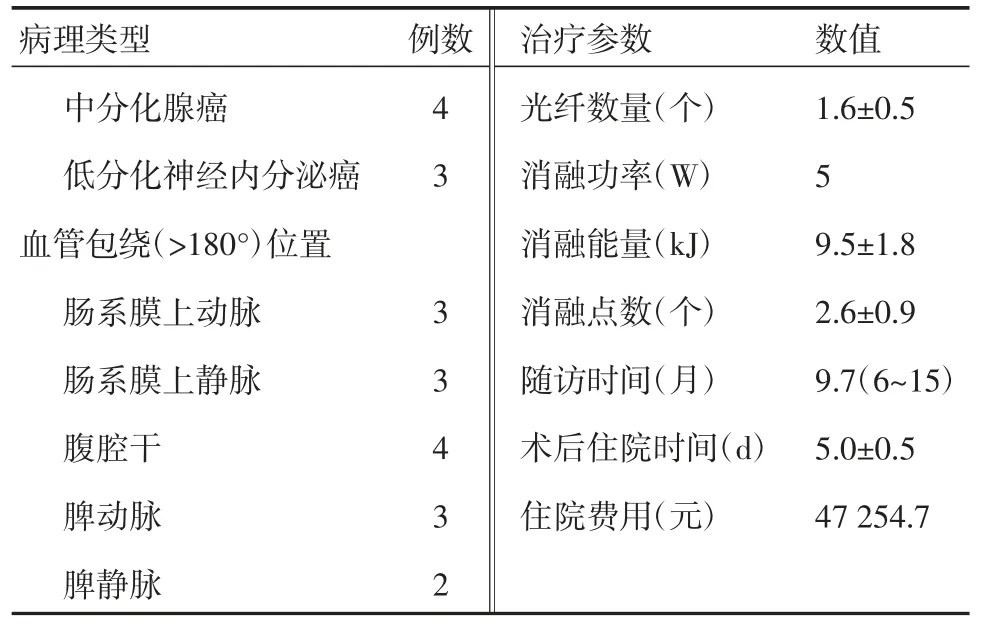
表1 7 例患者的一般临床特征
二、手术效果
患者均仰卧位,超声引导下将光纤从侧方成功插入并消融,技术成功率100%。行激光消融术前与术后的CA-199、血清脂肪酶、淀粉酶和血糖水平差异无统计学意义(P均>0.05),见表2。

表2 消融前后实验室检测指标的变化
三、患者术后疼痛和生活质量评分的改善情况
术后1 周患者疼痛均有所缓解,疼痛评分由术前的(7.2±0.8)分减少至(3.0±1.2)分,两者比较差异有统计学意义(t=4.273,P<0.001)。患者术后1 个月的躯体功能和疼痛较术前有所缓解,差异有统计学意义(P均<0.05);其他生活质量评分没有改变,差异无统计学意义,见表3。
四、患者生存情况分析
本组7 例患者中2 例于激光消融术后接受8个疗程的吉西他滨化疗,3 例接受5 个疗程的吉西他滨化疗,另2 例拒绝接受任何化疗。4 例患者分别在治疗后6.5、7.7、9.4 和12.5 个月死亡,其中1 例死于肝性脑病,另外3 例死于肿瘤进展,余3 例患者在随访期间仍然存活。在中位随访期9.7(6~15)个月内,7 例患者的总体生存时间为10 个月(95%CI∶5~13 个月),典型病例见图1、2。
表3 患者行激光消融术后生活质量评分的改变 (±s)

表3 患者行激光消融术后生活质量评分的改变 (±s)
注∶a 为与术前比较,差异有统计学意义
时点术前术后1 个月术后3 个月F 值P 值躯体功能30.8±3.4 50.0±0a 40.4±15.4 12.102 0.001角色功能41.7±11.8 46.6±6.7 40.7±12.7 3.172 0.208情绪功能27.7±3.8 40.1±18.0 31.3±1.8 3.734 0.243认知功能41.3±11.5 60.0±28.0 41.3±11.5 7.812 0.226社交功能60±0 60±0 60±0 0 1.000整体生活质量54.9±32.9 58.4±31.5 45.0±42.1 2.186 0.239疲乏51.2±16.1 41.1±25.0 64.0±12.9 3.921 0.374头晕和呕吐73.4±14.9 43.3±38.9 53.4±29.8 7.821 0.121时点术前术后1 个月术后3 个月F 值P 值疼痛61.9±16.3 26.7±11.3a 21.7±10.8a 17.205 0.023呼吸困难65.4±13.7 40.1±20.0 65.3±12.6 3.892 0.142失眠65.2±37.9 30.1±36.7 45.1±41.1 5.723 0.184食欲缺乏56.7±30.2 30.1±24.5 60.1±33.5 8.921 0.178便秘51.7±30.3 25.4±31.6 46.7±31.4 11.230 0.095腹泻0 10.2±25.2 0 10.267 0.104经济困难10.1±22.3 10.2±22.3 30.4±27.3 7.843 0.185
五、安全性和并发症
患者在术后3 个月内无死亡,未出现Ⅲ~Ⅴ级并发症,未出现胆汁漏和胰液漏,无梗阻性黄疸。术后3 d 内出现与胃肠相关的不良反应包括恶心、腹痛及食欲不振,对症治疗后均有所好转。2 例于术后3 d 出现胰腺假性囊肿(大小分别为2.4 cm×2.3 cm和2.0 cm×1.8 cm),并出现相应症状和轻微疼痛,未经任何治疗,1 个月后囊肿减小。
讨 论
胰腺癌是前景晦暗的肿瘤,尽管应用多种治疗手段,但预后仍然极差,特别是在晚期。本研究使用Nd∶YAG 激光治疗进展期胰腺癌,在治疗7 个月后,肿瘤得到很好的局部控制。本研究最大亮点在于首次报道了超声引导下经皮激光消融治疗进展期胰腺癌,在此之前报道的激光消融应用在胰腺癌中,仅仅是兔肝实验或是超声内镜下引导激光[15]消融神经内分泌瘤。

图1 典型病例(男性,68 岁,进展期胰腺癌)行激光消融术前术后的MRI 图
美国联合癌症委员会(American Joint Committee on Cancer,AJCC)分期系统是目前对进展期胰腺癌应用最广泛的评估系统,为不可切除的胰腺癌和各阶段生存分析评估提供良好基础。不可切除胰腺癌主要包括阶段Ⅲ(定义为胰腺癌局部进展)和阶段Ⅳ(定义为出现远处转移)。美国NCCN 指南中明确指出位于阶段Ⅲ和Ⅳ的患者,化疗和放化疗是最佳选择,尽管消融治疗在一些实体恶性肿瘤起到很好的治疗效果,且具微创性特点,但尚未列入治疗推荐中。考虑到周围临近脏器,消融治疗胰腺癌是一项极具挑战性的任务,目前已经有报道将消融治疗应用于胰腺实体或囊性肿瘤中。

图2 典型病例(女性,68 岁,进展期胰腺癌伴有胆结石、糖尿病患者)行激光消融术前术后的表现
作为诸多消融技术之一,激光消融主要依靠特殊设备将单位高能量激光以可视可控的精准性方式发送到特定范围的组织区域内,最终引起肿瘤高温灭活。其具有精准高效的特点,激光能量集中,可迅速灭活肿瘤,减少热量无效扩散,减少正常组织热损伤,手术时间短,一般在5~10 min。胰腺癌经常分散分布在腹膜后脏器中,跨越胰管和胆管,甚至是十二指肠、胃或者结肠等。胰腺癌消融的难点在于无意损伤临近脏器或不能达到完全消融。激光消融可以达到精准、预期、重复性消融,且对周围组织损伤小。无水酒精消融虽然能避免损伤周围脏器,但液体分布不均且消融范围受限,相比之下,激光消融能够提供可以控制的、更加可靠的消融范围,这些特点远超其他消融技术,非常适合胰腺癌的消融治疗[16]。
大部分文献报道胰腺癌治疗的消融引导方式主要是开腹探查和腹腔镜引导[17-20],在位置很深的腹膜后部位能够取得较为安全的路径。而对于影像引导下的经皮穿刺十分困难,本研究尝试应用超声引导下Nd∶YAG 激光光纤穿刺进入胰腺癌,结果证实此穿刺路径是安全的,没有出现与激光消融相关的主要并发症。术后立即行超声造影进行评估,决定是否需要采取下一步激光消融治疗,为医生提供一种更微创的胰腺癌治疗方式。
本研究对激光消融治疗进展期胰腺癌的经验∶(1)尽量选择胰体或者胰尾位置的肿瘤,这样可以远离胆管和十二指肠,且血管包埋较少;(2)在消融期间进行胃肠防护较为困难,因此应于术前进行肠道准备,术中使用局麻避免全麻造成的胃肠胀气,可以在消融时提供更加清楚的影像引导;(3)根据近五年的报道,消融相关的死亡率是3%左右,并发症发生率是3.5%~28%[8,21],而本研究并未出现任何并发症,这主要取决于超声精准引导、术前精准规划以及严格的纳入标准;(4)对于局部进展或远处转移的胰腺癌患者,以往报道的中位生存期分别是8~12 个月和5~7 个月,本研究结果与之相似,但是患者均有相对较好的身体条件和生活质量。
本研究的主要局限∶一是样本量小;二是仅仅选择胰体或者胰尾位置的肿瘤,未来计划选择胰头位置的肿瘤;三是三维可视化软件仅用来计算肿瘤和消融体积,但未应用于术中引导精准消融。下一步需要进行更大样本量的临床研究激光消融治疗进展期胰腺癌的长期结局。
综上,超声引导下经皮激光消融不可切除进展期胰腺癌可行、安全且微创。

