慢病毒干扰水通道蛋白4促进脊髓损伤修复与其上调电压依赖性阴离子通道2相关性的研究*
吕 芾,张华阳,黄守娟,向轩颐,郑 莉,张 晓,张奇兰
成都医学院(成都 610500)
脊髓损伤属于中枢神经系统的严重创伤,大部分是由于各种外力作用于脊柱,造成脊髓压迫或断裂,常导致不可恢复的感觉及运动功能部分或完全丧失[1]。由于脊髓损伤难以恢复,常将之视为一种严重的致残性疾病,其给社会和家庭带来了很大负担。脊髓损伤分为原发性与继发性,脊髓水肿是脊髓损伤后的主要并发症之一,是其他继发性脊髓损伤的病理学基础,可以极大地影响创伤后的恢复过程。线粒体功能障碍常为导致细胞水肿加剧的关键性事件,当线粒体能量的产生和利用受到抑制,将进一步增加细胞内渗透压负荷,加剧细胞水肿。研究[2-3]发现,脊髓水肿的形成和消退与水通道蛋白(aquaporins,AQP)表达水平有关。而电压依赖性阴离子通道(voltage-dependent anion-selective channel protein,VDAC)作为线粒体外膜上的一种阴离子通道蛋白,在线粒体能量代谢过程中起重要作用。因此,本课题拟探讨AQP与VDAC的相互作用关系,进一步从能量代谢角度研究损伤性脊髓水肿的分子生物学机制。
AQP家族是一类在细胞膜表达的特殊通道蛋白,负责水和其他小分子运输。目前,AQP已发现13个亚型,其中AQP4在大脑和脊髓中分布广泛,是中枢神经系统调节水含量的主要分子途径[4-5]。AQP4 表达上调与中枢神经系统胶质细胞的水肿密切相关,而当其表达下调时可以减轻脑和脊髓水肿的程度,进而促进损伤修复[6-7]。VDAC家族作为一种线粒体外膜上分子和离子交换出入的通道,对线粒体与胞质之间的物质代谢和能量代谢起着十分重要的作用[8]。其中,VDAC2作为其家族成员之一,是线粒体外膜上含量丰富的阴离子通道蛋白,对线粒体和细胞功能的调节非常重要[9]。当VDAC2表达减少,会使线粒体膜内外代谢物质交换减少,由此导致的ATP产生及利用障碍会影响线粒体发挥正常功能。
尚未有研究将AQP4与VDAC2对细胞水肿的调节作用联系起来,或探讨过二者间的相互作用机制。本实验制备SD大鼠脊髓钝挫伤(SCC)模型,采用免疫组织化学(IHC)技术、定量聚合酶链式反应(PCR)技术,观察脊髓损伤后VDAC2表达变化情况;苏木精-伊红(HE)染色、BBB 功能评分用于检测脊髓损伤后组织和细胞的损伤程度以及大鼠运动功能的受损情况;运用生物信息学方法预测AQP4和VDAC2的基因联系;构建慢病毒干扰AQP4大鼠模型,观察AQP4干扰后SCC模型大鼠体内VDAC2的表达变化;并通过以上步骤探讨干扰AQP4对脊髓损伤过程中VDAC2表达的影响以及VDAC2的差异性表达在脊髓损伤修复过程中的作用。
1 材料与方法
1.1 实验动物
健康成年SD大鼠114只,雌雄不限,体重200~240 g。由四川大学实验动物中心提供。将动物分笼饲养,环境温度控制在20~25 ℃。随机把大鼠分为4大组,即假手术(Sham)组(n=11)、SCC组(n=69),取材时间点分为6、12 h和1、3、5、7、14、28 d;空载(Vector)组(n=17)、AQP4慢病毒干扰(AQP4-SH-LV)组(n=17),取材时间点为手术后3、7、28 d。
1.2 AQP4慢病毒质粒载体的制备
1.2.1 慢病毒质粒的制备 将AQP4 siRNA序列(中国广州,GeneCopoeia)克隆到红色荧光蛋白(red fluorescent protein, RFP)标记的载体中。再将该载体(5 μg)和慢病毒包装质粒 (1 μL, 中国广州,GeneCopoeia)共转染到293T细胞,生成慢病毒质粒载体。48 h后取含有慢病毒质粒的上清液,置于0.45 μmol/L的醋酸纤维素过滤器中过滤,除去滤液后取5 mL,3 500 r/min,离心半径28.5 cm,离心25 min,除去上清液,将沉淀重新溶解在500 μL PBS溶液中。最后置于-80 ℃冰箱冻存。
1.2.2 载体注射 使用3.6%水合氯醛对大鼠进行腹腔麻醉(30 mg/kg),备皮后采用俯卧位固定,在T9~T11的位置沿背部正中段纵向依次切开,分离皮肤、筋膜、肌肉;剥除T10的棘突及椎板,充分暴露该节段脊髓,使用脑立体定位仪(DW-5,成都泰盟)于T10节段脊髓拟打击点左右两侧各注射慢病毒质粒载体5 μL(AQP4-SH-LV组)或含有空载体的质粒 5 μL(Vector组)。朝向大鼠尾侧进针,进针角度与水平面呈45°,进针深度3~5 μm。注射完毕后依次缝合肌肉、筋膜及皮肤,常规消毒及抗感染处理后,独笼饲养。
1.3 动物模型制备
慢病毒载体注射48 h后, AQP4-SH-LV组和Vector组大鼠使用3.6%水合氯醛腹腔注射麻醉(30 mg/kg),常规消毒。俯卧位固定,依次拆下皮肤、筋膜、肌肉的缝合线;SCC组及Sham组大鼠使用同法麻醉,备皮,常规消毒,以 T10为中心,纵行切开皮肤及皮下组织,分离椎旁肌肉,暴露棘突与椎板;Sham组大鼠仅咬除T10椎板后,缝合伤口,其余各组大鼠则采用改良Allen′s打击法,在咬除T10椎板后,用Allen′s打击仪从30 mm高处自由坠落,打击对应节段脊髓,大鼠出现脊髓充血和摆尾,代表损伤成功。打击成功后,逐层缝合伤口,术后各组大鼠腹腔注射青霉素1 mL(1 600 000 U/mL)、5%葡萄糖氯化钠溶液2 mL,小心护理,独笼饲养。每天早晚挤压大鼠膀胱协助排尿各1次,至大鼠恢复反射性排尿。护理时注意观察皮肤有无压疮或感染、下肢有无溃烂。室温维持 25~30 ℃,正常饮食。
1.4 大鼠行为学测试
采用BBB评分体系于术后1、3、5、7、14 d对各组大鼠进行后肢运动功能评分,包括0~21分,功能完全缺失为0分,完全正常为21分。评分由3位以上熟悉评分标准的非本组实验人员进行,最后选取3个人的有效评分取算数均值。
1.5 取材和切片制备
各组大鼠在术后根据需要在不同时间点进行取材。深度麻醉大鼠,若用于qRT-PCR,则自左心室插管后剪开右心耳,快速灌注0.9% NaCl,直接取1 cm损伤段脊髓,放入无RNA酶的EP管中-80 ℃保存。若用于形态学检测,深度麻醉大鼠后,自左心室插管,剪开右心耳,快速灌注PBS缓冲液,再灌注4%多聚甲醛。打开椎弓管暴露脊髓段,切取损伤点前后1 cm的脊髓组织,放入4%多聚甲醛固定,48 h后取出固定好的脊髓组织进行常规脱水、包埋以及切片(切片厚度为5 μm,每切5张选用1张)、摊片、贴片,37 ℃烘片后备用。
1.6 HE染色法
选用制备好的脊髓切片,65 ℃烤片2 h,染色流程:1)二甲苯(Ⅰ)10 min;2)二甲苯(Ⅱ)10 min;3)100% 水化乙醇(Ⅰ)5 min;4) 100% 水化乙醇(Ⅱ)5 min;5)95% 水化乙醇(Ⅰ)5 min;6) 95% 水化乙醇(Ⅱ)5 min;7)80% 水化乙醇5 min;8)RO水5 min;9)苏木素液染色5 min;10)RO水漂洗5 min;11)0.5% 盐酸乙醇分色8 s;12)自来水缓水流冲洗15 min返蓝;13)伊红液染色7 min;14)RO水漂洗2 min;15)80% 乙醇3 min;16)95% 乙醇(Ⅰ)1 min;17)95% 乙醇(Ⅱ)3 min;18)100% 无水乙醇3 min;19)二甲苯(Ⅰ)5 min;20)二甲苯(Ⅱ)5 min;21)中性树胶封片。
1.7 免疫组织化学染色
选用制备好的脊髓切片,65 ℃烤片2 h。用免疫酶组化SP法进行染色:与HE染色同法脱蜡、水化后,放入枸橼酸钠溶液中行高压热抗原修复,0.01 mol/L PBS漂洗,用3%H2O2,37 ℃,孵育15 min,封闭内源性过氧化酶,PBS漂洗,使用5%正常山羊血清37 ℃孵育15 min封闭非特异性抗原,加一抗(1∶100)4 ℃放置18 h,取出切片,室温下放置20 min,PBS漂洗,加入二抗工作液,37 ℃孵育15 min,PBS漂洗,加入辣根过氧化物酶,37 ℃孵育15 min,PBS漂洗,配制DAB-H2O2显色液(1 mL过滤PBS+5滴0.3%H2O2+DAB粉末),室温下加DAB-H2O2显色液反应3~5 min,显微镜下充分显色后,及时用RO水终止反应,苏木素复染5 min,RO水漂洗,1%盐酸-酒精分色10 s,自来水返蓝,梯度酒精逐步脱水,二甲苯透明,最后使用中性树胶封片。光学显微镜400倍下观察免疫阳性反应物分布情况并拍照。
1.8 荧光定量PCR
把1 cm脊髓损伤节段从-80 ℃保存的冰箱中取出,用Trizol(中国北京,TransGen Biotech)匀浆破碎脊髓组织细胞,经氯仿、异丙醇、75%乙醇处理后得到总RNA。采用试剂盒 (中国南京,Vazyme biotech)将总RNA逆转录成cDNA,置于-20 ℃冰箱保存备用。设计大鼠内参β激动蛋白(β-actin)、VDAC2的上下游引物序列和探针序列。从冰箱中取出逆转录的cDNA,使用通用试剂盒(中国南京,Vazyme biotech公司)根据说明进行荧光定量PCR,获得PCR扩增产物。反应条件:95 ℃ 2 min,95 ℃ 15 s,52 ℃ 20 s,60 ℃ 40 s,循环45次。以β-actin为内参照,得到S形动力学曲线后读取Ct值,经过人工校正后按2-ΔΔCt计算出相对表达量(表1)。
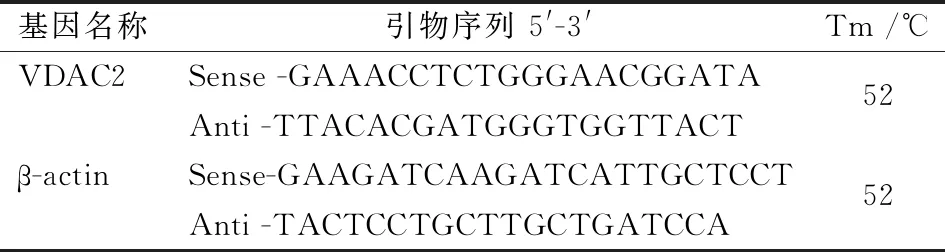
表1 引物序列信息
注:Tm为DNA解链温度
1.9 生物信息学
采用GeneMANIA生物信息学方法预测AQP4和VDAC2两基因之间的关系,网址:http://www.genemania.org。
1.10 统计学方法
2 结果
2.1 BBB评分
采用BBB评分检测运动功能,评价大鼠脊髓损伤后的运动功能。Sham组大鼠各时间点评分均达到21分;对于SCC、AQP4-SH-LV、Vector组大鼠,脊髓损伤后1 d其后肢均瘫痪,BBB运动功能评分结果为0,此后随着后肢功能恢复,其评分逐渐增加,在第14天达到最大值。但在各个时间点(1、3、5、7、14 d),上述3组大鼠BBB评分均低于Sham组(P<0.05); 此外,AQP4-SH-LV组大鼠评分结果在各时间点(1、3、5、7、14 d)均较Vector组高,其中,5、7 d两组评分差异有统计学意义(P<0.05)(图1)。
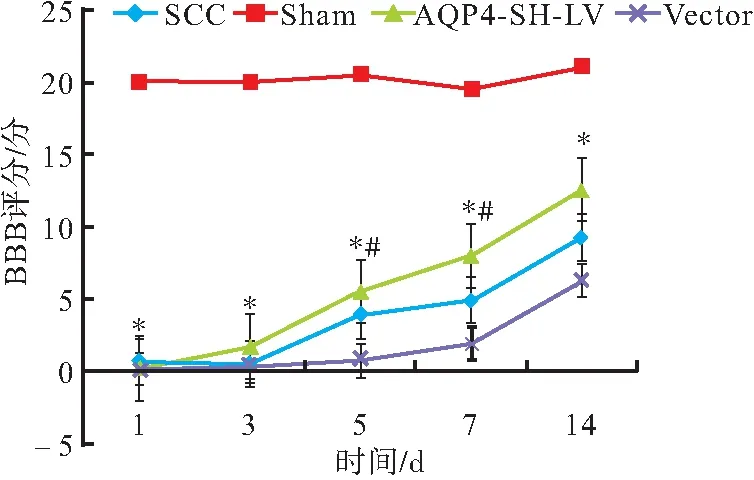
图1 BBB评分结果
注: 与Sham组比较,*P<0.05;AQP4-SH-LV组与Vector组比较,#P<0.05
2.2 脊髓钝挫伤后VDAC2的表达变化
2.2.1 SCC后qRT-PCR结果 本实验采用qRT-PCR技术检测脊髓损伤后VDAC2的表达变化,结果表明,SCC组和Sham组大鼠在各时间点(6、12 h和1、3、5、7、14、28 d)均能检测到VDAC2 mRNA转录。与Sham组相比,SCC组大鼠各时间点VDAC2的mRNA转录量均低于前者(P<0.05)。SCC组大鼠VDAC2 mRNA转录水平在脊髓损伤后随时间的推移而发生改变,其在脊髓损伤后6 h明显下降,并在第7天降至最低水平;第7天后其VDAC2 mRNA表达水平缓慢上升,至损伤后第28天,VDAC2的mRNA转录量高于第7天,差异有统计学意义(P<0.05)(图2)。
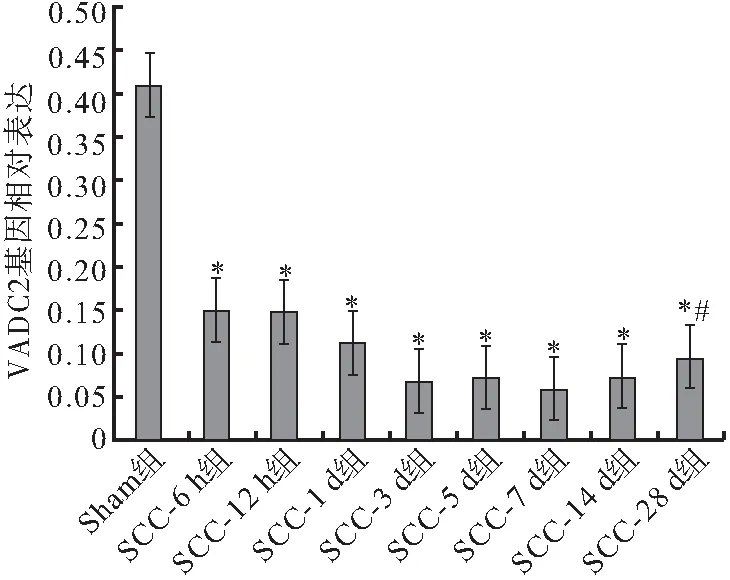
图2 qRT-PCR示VDAC2 mRNA的相对表达
注: SCC后VDAC2 mRNA的表达变化;与Sham组比较,*P<0.05;与SCC-7 d组比较,#P<0.05
2.2.2 SCC后IHC结果 采用免疫组织化学技术检测VDAC2蛋白表达的定位及半定量情况,结果显示,VDAC2在各组大鼠脊髓灰质神经元和神经胶质细胞、脊髓白质的星形胶质细胞中有表达,棕褐色免疫阳性产物主要分布于细胞质。SCC术后6 h和1、3、7、14 d,SCC组大鼠免疫阳性细胞数均低于Sham组(P<0.05),且胞浆内VDAC2阳性反应物明显减少,提示VDAC2蛋白表达减少;其中,7 d阳性细胞数最少,14 d较7 d有所增加(P<0.05),但依旧低于Sham组水平(图3)。
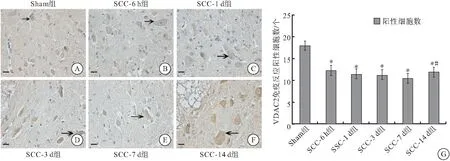
图3 Sham及SCC组大鼠脊髓组织VDAC2的IHC染色分布(400×)及免疫阳性细胞统计
注: A~F:Sham组及SCC组大鼠脊髓组织VDAC2的IHC染色结果,比例尺=20 μm;黑色箭头表示免疫反应阳性细胞; G:VDAC2免疫阳性细胞计数结果;与Sham组相比较,*P<0.05;与SCC-7 d组比较,#P<0.05
2.3 HE染色
Sham组:Sham组大鼠脊髓结构完整,灰白质界限清楚;灰质内神经元和神经胶质细胞胞体结构完好,分布均匀;血管、中央管形态正常;白质内神经纤维排列整齐而致密。SCC、Vector组:SCC造模后3 d,可见SCC组和Vector组大鼠脊髓组织广泛出血,如脊髓中央管出血,毛细血管充血,血管周围有红细胞;灰质中可见成片坏死区,周围组织水肿严重,细胞间隙和血管间隙明显增大, 大量神经元和胶质细胞肿胀、破裂,细胞核发生固缩,胞浆红染加深;有神经胶质细胞增生;脊髓灰质和白质界限模糊不清;损伤后7 d: 脊髓组织大部分液化坏死并有空洞形成,脊髓白质破坏严重,形成大量囊腔和空泡,神经元和胶质细胞肿胀有所减轻, 细胞间隙和血管间隙水肿逐渐减轻,充血消退, 仍有少量增生的胶质细胞。AQP4-SH-LV组:大鼠SCC术后3、7 d,脊髓组织有出血现象,可发现与Vector组相比,该组大鼠脊髓内血管周围组织和神经元的肿胀程度较轻,水肿体积减小,脊髓灰质和白质的界限较清晰;脊髓中央散在小部分坏死区,程度较轻,白质内大部分髓鞘完整且分布均匀(图4)。
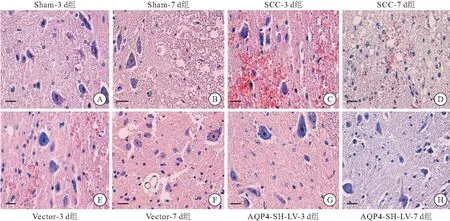
图4 HE染色结果显示各组大鼠脊髓组织情况(400×)
注: A~H:各组大鼠各时间点脊髓组织,比例尺=20 μm
2.4 慢病毒干扰AQP4后VDAC2的表达变化
2.4.1 慢病毒干扰AQP4后qRT-PCR结果 AQP4-RNAi-LV的模式图如下,qRT-PCR结果显示,慢病毒干扰后12 h,AQP4-SH-LV组大鼠AQP4的mRNA表达量与Vector组相比下降(P<0.05),证明AQP4干扰模型制备成功;SCC术后7 d, AQP4-SH-LV组大鼠体内VDAC2的mRNA表达量较Vector组大鼠上调,差异有统计学意义(P<0.05)(图5)。
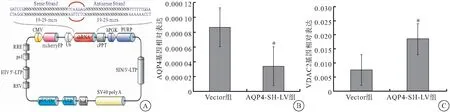
图5 慢病毒干扰AQP4后VDAC2的表达变化
注:A:AQP4-RNAi-LV的模式图,增强型RFP(mCherry FP)作为报告基因被插入到质粒中,该框架也包括抗生素氨苄西林以及作为表达载体启动子的pUC Ori;B:AQP4-RNAi-LV感染后12 h AQP4 mRNA的表达变化;C:AQP4-RNAi-LV感染后7 d VDAC2 mRNA的表达变化;与Vector组比较,*P<0.05
2.4.2 慢病毒干扰AQP4后IHC结果 Vector组和AQP4-SH-LV组大鼠体内VDAC2免疫阳性产物分布于大鼠脊髓灰质神经元和神经胶质细胞,脊髓白质的星形胶质细胞胞质中。在SCC术后3、7、28 d,AQP4-SH-LV组大鼠VDAC2的免疫阳性细胞数相较于Vector组均有所增加,其中,3、7 d两组差异有统计学意义(P<0.05),28 d时差异无统计学意义(P>0.05)(图6)。
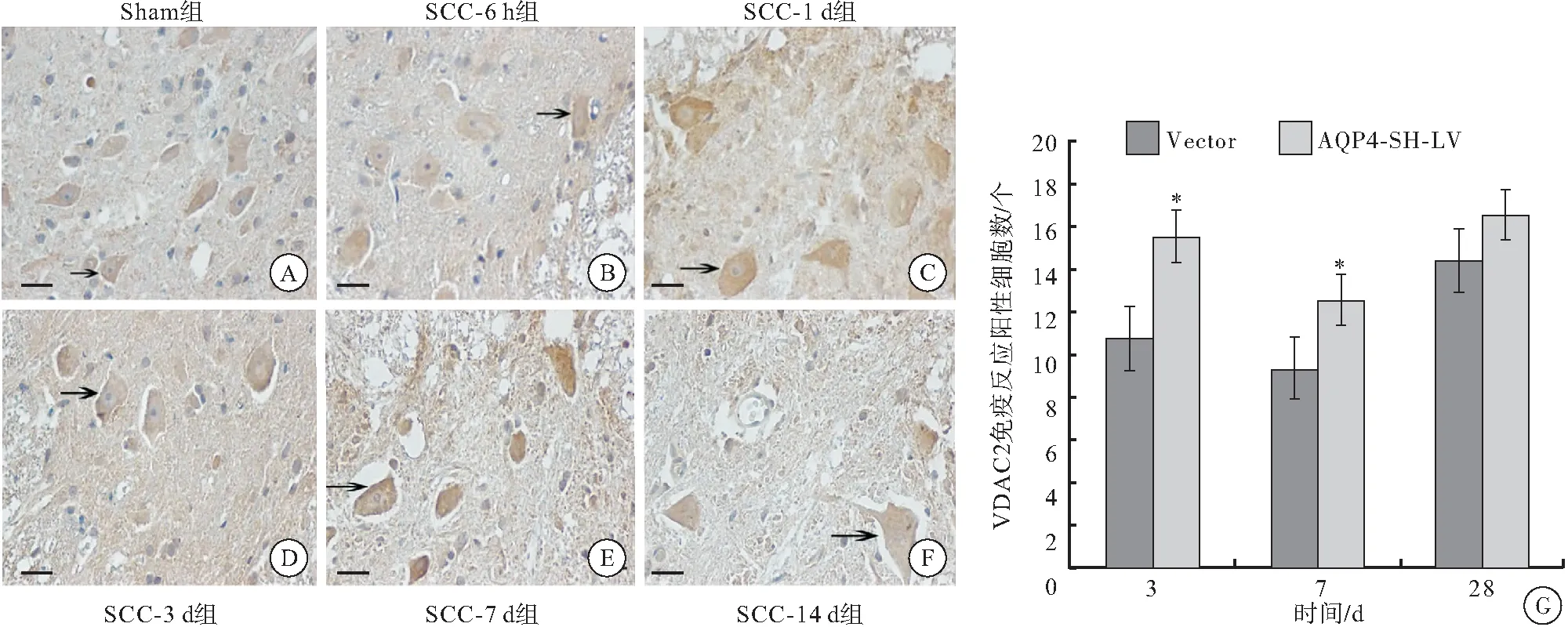
图6 AQP4-SH-LV及Vector组大鼠脊髓组织VDAC2的IHC染色分布(400×)及免疫阳性细胞统计
注: A~F:AQP4-SH-LV及Vector组大鼠脊髓组织VDAC2的IHC染色结果,比例尺=20 μm;黑色箭头表示免疫反应阳性细胞; G:VDAC2免疫阳性细胞计数结果;与Vector组相比较,*P<0.05
2.5 生物信息学结果
利用GeneMANIA数据库(http://www.genemania.org),检索时输入AQP4与VDAC2基因并选择物种大鼠(rattusnorvegicus),预测AQP4与VDAC2基因在该物种中的联系。结果显示,两基因在人类和大鼠间均具有共表达(co-expression)、共定位(co-localization)、共享蛋白结构域(shared protein domains)、物理结构互作(physical interactions)、基因互作(genetic interactions)等联系。通过蛋白质相互作用预测,结果显示,VDAC2与AQP4蛋白质均具有底物特异性通道活性、被动跨膜转运蛋白活性和通道活性等相关作用(图7)。
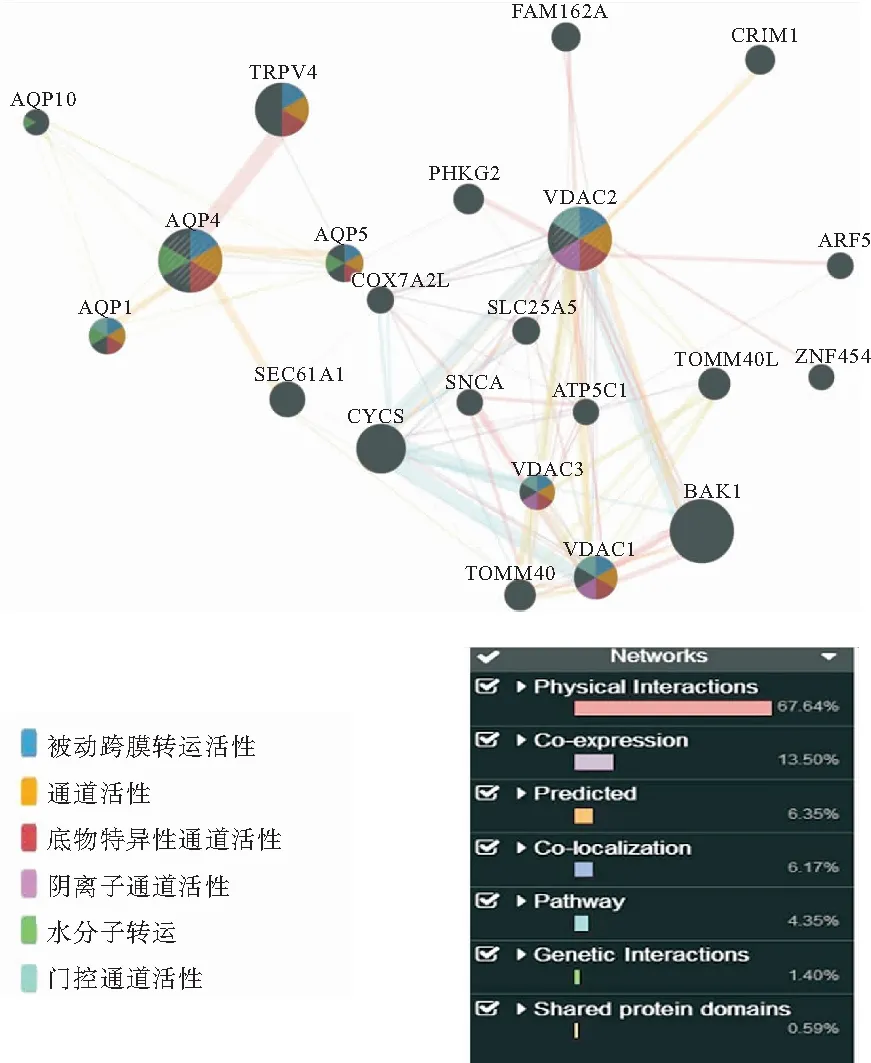
图7 GeneMANIA生物信息学方法检测VDAC2与AQP4的关系
3 讨论
脊髓损伤是一种中枢神经系统的严重创伤,其导致的脊髓水肿在很大程度上影响脊髓损伤后的修复过程,而脊髓损伤后水肿的发生发展过程与线粒体能量代谢息息相关。AQP4和VDAC2作为调节水代谢和能量代谢的重要因子,对脊髓损伤的修复起着至关重要作用。
3.1 脊髓损伤后VDAC2表达的意义
VDAC2通过在线粒体外膜上形成亲水性电压门控通道,对线粒体外膜透化起门控作用,且因调控物质出入的特性,在能量代谢、维持线粒体稳态等方面也发挥着不可替代的作用[10]。本实验成功制备了SD大鼠SCC模型,在脊髓损伤后1 d,SCC组大鼠BBB评分降为0,3 d后随着运动功能的恢复,评分缓慢增加,但低于Sham组大鼠;脊髓灰质周围组织水肿严重且有大量神经元和胶质细胞肿胀、破裂。与此同时,该组大鼠VDAC2的 mRNA表达明显下调,VDAC2的免疫阳性细胞数减少,至28 d也未恢复到损伤前水平。上述结果提示,VDAC2的表达水平对维持正常的脊髓功能有重要作用,SCC后其表达下调不利于脊髓损伤恢复。研究[11]发现,VDAC2可能通过凋亡因子影响脊髓损伤后水肿的发生发展,Bax、 Bak等是Bcl-2 家族中的促凋亡蛋白。Bax可以透过线粒体外膜使得细胞凋亡,Bax受不断转运到线粒体和逆向转运到胞浆的调节,在VDAC2缺乏的细胞中,Bax和Bak构成的线粒体定位会受到影响,提示VDAC2在Bax和Bak进入线粒体及维持线粒体外膜稳定性中起重要作用。 Lauterwasser等[12]进一步发现,线粒体外膜上的孔道蛋白VDAC2为Bax逆向转运平台的基本成分,VDAC2具有授予线粒体外膜相关的Bax募集,以及通过逆向转运来抑制Bax的双重作用。有研究[13]发现,VDAC2可作为促凋亡蛋白Bak激活的抑制剂。Lazarou等[14]通过实验发现,在健康细胞中存在内源性依赖VDAC2存在的非活性BAK。在线粒体外膜上,VDAC2与BAK的疏水尾部相互作用,将其隔离在一个非活性状态,激活的Bak被VDAC2抑制。Plötz等[15]结果表明,当Bcl-xs过表达,可干扰VDAC2-Bak的互动,导致释放Bak,而过表达VDAC2可大幅度降低Bcl-xs导致的细胞凋亡。此外,Wu等[16]发现,VDAC1 和 VDAC2 基因敲除的小鼠,呼吸容量减少,因为线粒体外膜通透性降低,可导致氧化磷酸化所需的代谢物减少。另外,大量研究[17-19]结果显示,VDAC与钙离子进出线粒体密切相关,提示VDAC 作为Ca2+进出线粒体的通道,在维持钙稳态和细胞活性调节中起关键作用。VDAC2还具有胞浆酶的结合位点,包括己糖激酶(HK)和甘油激酶的同工酶,HK是细胞糖酵解过程重要的限速酶之一,VDAC2结合HK-1/HK-2后,可优先利用线粒体产生ATP,使糖酵能供顺利进行[20]。因为VDAC2控制着多种离子和代谢产物在线粒体内外的转运,其表达水平可影响许多生理及病理过程。一些实验[21-23]已表明,VDAC2会影响ATP/ADP进出线粒体,低表达时可抑制线粒体能量的产生和利用,与线粒体的能量代谢密切相关。而细胞线粒体能量代谢障碍时,会发生ATP生成减少,细胞膜钠钾泵功能障碍,细胞内钠离子和水的过多积聚,导致细胞水肿。无机磷酸盐、乳酸和嘌呤核苷酸等代谢产物的蓄积,将增加渗透压负荷,进一步加重细胞水肿,这与本实验结论相吻合。因此,本实验认为脊髓损伤后VDAC2表达水平与水肿的发生发展直接相关,其表达下调不利于脊髓损伤恢复。
3.2 慢病毒干扰AQP4后可上调VDAC2的表达
AQP是一族构成跨膜的水通道蛋白,主要功能是参与生物体内细胞水分的调节,对维持组织内水平衡具有重要作用。在中枢神经系统中广泛分布的是AQP4,其主要表达在脑和脊髓中的胶质细胞膜或足突和室管膜细胞上,在神经元中尚未发现其蛋白表达。在脊髓损伤后,AQP4表达增加,提示 AQP4高表达提供途径,使得过量的水分进入脊髓损伤区, 从而引起脊髓水肿、脊髓压力升高[24]。本项目的前期实验中,成功建立了AQP4的慢病毒干扰模型,行Allen′s法脊髓损伤后,qRT-PCR和IHC结果显示,AQP4干扰后VDAC2表达水平上调,差异有统计学意义(P<0.05);本实验结果显示,脊髓损伤后手术组大鼠体内VDAC2的表达水平下降,与Sham组比较,差异有统计学意义(P<0.05);AQP4慢病毒干扰组大鼠体内VDAC2的表达相对于Vector组大鼠明显升高。生物信息学分析结果表明,AQP4与VDAC2具有共表达、共定位和共享蛋白质结构域等关系。因此,本实验推测AQP4在脊髓损伤后的高表达可能对VDAC2表达有抑制作用,这不仅使得更多水分进入细胞,线粒体肿胀,也使线粒体外膜上的VDAC2表达下降,结果导致线粒体能量的产生和利用受到抑制,进一步增加了胞内渗透压负荷,加剧细胞水肿,对脊髓损伤后的修复过程起负面影响。
3.3 干扰AQP4促进脊髓损伤的修复与上调VDAC2有关
AQP4广泛表达于水分子流动活跃的部位,其存在可能起着调节水代谢的作用,并参与多部位水肿的发生和发展。Hiroaki等[25]实验显示,AQP4参与脑出血后期(3 d以后) 细胞毒性脑水肿的形成, 增加了细胞膜对分子的通透性, 导致胞内水肿。在外伤性脑水肿大鼠脑中,受伤部位AQP 4的 mRNA 表达明显高于脑部其他地方[26]。Yang 等[27]通过实验发现,在腹膜注射去氨加压素的水中毒模型中, 观察到AQP4过表达的转基因小鼠细胞毒性脑肿胀更为快速。此外,Fu等[28]通过制备低氧处理大鼠星形胶质细胞模拟低氧脑缺血的模型,也发现相比于AQP4 敲除型星形胶质细胞,野生型星形胶质细胞会更快速肿胀,并且细胞体积更大。另有一些实验研究[29]发现,AQP4的表达变化在脊髓损伤时脊髓水肿的形成和消退过程中起重要作用。本实验结果也显示,脊髓损伤后,AQP4-SH-LV组大鼠体内VDAC2 mRNA的转录水平相较于Vector组大鼠有所上调,并伴随有大鼠脊髓细胞水肿减轻,运动功能恢复较好的现象。
综上所述,线粒体能量代谢功能障碍是导致细胞水肿加剧的关键性事件。脊髓损伤后,AQP4通过高表达导致细胞水肿,并下调VDAC2的表达水平,干扰了线粒体能量的产生和利用,进一步增加胞内的渗透压负荷,加剧SCC后的脊髓水肿。人为干扰AQP4的表达,其对VDAC2的抑制作用减弱,VDAC2的表达得以上调,这使得线粒体能量代谢可维持在一定水平,从而减轻损伤后的脊髓水肿,有利于脊髓损伤的恢复。本研究从能量代谢的角度进一步探讨了损伤性脊髓水肿发生发展的分子生物学机制,为临床上脊髓损伤的基因疗法提供了新的治疗靶点。