丁醇的生物炼制及研究进展
肖 敏,吴又多,薛 闯
(大连理工大学 生命科学与技术学院,辽宁 大连 116024)
随着人们生活水平的提高和生产工业的发展,化石燃料需求量日益增长,导致原油资源逐渐枯竭且价格逐步上升,同时,化石燃料的大量使用也加剧了一系列环境问题,如全球气候变暖和大气污染等[1]。2009年,美国环境保护局出台了可再生燃料标准计划(RFS2),发展可再生生物燃料作为替代能源已成为全球趋势[2]。丁醇是继燃料乙醇之后另一个备受瞩目的可再生生物燃料,其优越的理化性能使其成为潜在的优良替代能源。丁醇通常通过生物发酵法制备得到,生物发酵法产丁醇的流程一般分为原料选择、原料预处理、纤维素酶酶解和丁醇发酵4个部分,本文中,笔者围绕这4个方面总结了近年来国内外在生物丁醇领域的研究成果。此外,本文重点分析丁醇生产的主要瓶颈,并总结相关研究进展,以期为相关研究人员提供参考。
1 生物丁醇简介
Weizmann[3]曾在第一次世界大战期间开创了生物发酵法生产丙酮-丁醇-乙醇(acetone-butanol-ethanol,ABE),主要利用丙酮为化工原料生产弹药,而丁醇则用来生产涂漆。然而在20世纪五六十年代石化合成方法的竞争下,欧洲和北美的ABE发酵工业完全停止。
中国的ABE发酵产业最早建立于20世纪50年代,同样在石化产业的冲击下,20世纪末所有的ABE生产工厂被关闭[4]。直到近年来,由于石油资源的短缺和环境问题的凸显,丁醇作为极具前景的第二代生物燃料再次成为研究热点。与燃料乙醇相比,生物丁醇有天然的性能优势:①丁醇烷基链较长且能量密度高,可与柴油或汽油等传统化石燃料较好的混溶;②丁醇和商用柴油具有较为接近的黏度值及表面张力值,可在发动机内部快速雾化,且无需改造现有发动机构造而直接加入使用[5-6];③丁醇含氧量为22%,这使得丁醇的燃烧更加清洁,Zhang等[7]和Nigam等[8]也发现丁醇的添加有助于减少重型柴油机的污染物排放;④丁醇还具有吸湿性小和腐蚀性小的优点,不会腐蚀现有的汽油存储和运输的基础设施[8-9]。
生物丁醇可通过厌氧发酵各类可再生生物质资源中的碳源得到,发酵微生物主要是一些产溶剂梭菌,如丙酮丁醇梭菌(Clostridiumacetobutylicum)和拜氏梭菌(Clostridiumbeijerinckii)等,它们是革兰氏阳性和专性厌氧微生物,能够利用多种碳源代谢,包括多糖、二糖、己糖及戊糖等。以葡萄糖为例,菌株先通过糖酵解途径将糖转化为丙酮酸,同时生成大量对菌体对数生长及后期产溶剂代谢至关重要的储能化合物ATP及还原力NADH。碳流经糖酵解催化转化后进入产酸期,菌体对数生长状态进一步增强,乙酸和丁酸快速积累,引发发酵体系pH水平迅速下降,同时气体产物CO2与H2大量释放。当酸积累到一定水平时,ABE发酵进入产溶剂阶段,以3∶ 6∶ 1的体积比生产丙酮、丁醇和乙醇。以可再生生物质资源为发酵原料的丁醇生产不仅有助于农业废物的资源化利用,而且可降低生产成本。但是,有些生物质资源具有刚性结构,直接纤维素酶水解获得可发酵糖的效率较低,必须经过预处理后,再进行酶解发酵。
2 生物发酵法产丁醇的工艺路线
2.1 原料的选择
目前用于丁醇生产的原料主要来源于淀粉质和糖质原料。淀粉质原料主要是一些块茎作物,如甘薯、木薯和菊芋等,它们不是主要的粮食作物,且均含有大量碳水化合物。其中,菊芋是一种耐寒耐旱、适应性强的植物,因其产量较高而成为有前景的丁醇生产原料[10]。据报道,在控制pH的条件下,使用菊芋酶水解液发酵可得到23~24 g/L 总溶剂[11]。另一种产量较高的淀粉质原料是木薯,Li等[12]利用100 g/L木薯粉发酵产出18.3 g/L丁醇和29.2 g/L 总溶剂。另外,Luo等[13]还发现小麦淀粉废水的添加可以提高木薯粉产丁醇的浓度,同时也可降低生产成本。
用于丁醇生产的糖质原料则主要有甘蔗、甜菜和糖蜜等,这些原料无需预处理,压榨得到的汁液可直接用于酶解发酵,一定程度降低了生产丁醇的成本[14-16]。Wechgama等[17]曾比较甜高粱茎秆汁、蔗糖汁和甘蔗糖蜜作为原料的发酵,结果发现甘蔗糖蜜是最适合丁醇生产的发酵基质。为了从甘蔗糖蜜发酵获得更高的丁醇产量,Wechgama等[18]又对发酵条件进行优化,在最优条件下发酵得到12.55 g/L丁醇和17.96 g/L 总溶剂。虽然这些淀粉质原料和糖质原料含有大量的碳水化合物,且处理方式简单,但原料来源受限,价格偏高,大量种植会产生与粮争地的问题,因此近年来逐步转向以廉价的纤维质资源为原料的丁醇生产工艺,这类原料大致可分为木质生物质、海洋藻类和农业废弃物三大类。
木质生物质可以分为软木和硬木。硬木是被子植物,大多是落叶树,包括杨树、柳树等树木,它们主要存在于北半球。与硬木不同,软木来源于针叶树和裸子植物的树木,生长速度较快、密度较低[26]。木质生物质具有更灵活的收获时间,不需要长时间储存[27],同时还具有密度高、灰分含量小和戊糖含量低的特性,这使得木质生物质的运输更加经济有效[27]。但是,木质生物质较高的木质素含量使其对微生物和纤维素酶具有更强的抵抗力,因此需要在预处理过程中投入更多能量来克服木质生物质的“顽固性”,这也使得成本大大提高。
海洋藻类作为第三代生物燃料的原料,具有不与粮食作物争地、无需淡水栽培的优点,且在生长过程中可以消耗大量CO2,具有突出的环境效益。此外,海洋藻类生长快速,含有高组分的碳水化合物和少量木质素,甚至有些藻类不含木质素,比如红藻,这进一步降低了预处理成本[28-30]。目前,一些大型藻类,如绿藻和褐藻,已经用于梭菌发酵产丁醇,Potts等[31]以绿藻为原料,在酸水解后提取藻多糖进行发酵,丁醇产率达到0.29 g/g。
农业废弃物是目前最具潜力的一类原料,以农作物秸秆和一些废渣为代表,如玉米秸秆、小麦秸秆和甘蔗渣等,表1列出了几种代表性的农业废弃物的组分。与木质生物质相比,农业废弃物含有较少的纤维素组分(大约30%~40%)和木质素组分(大约15%~20%)以及更多的半纤维素组分(大约15%~30%),这使得农业废弃物在处理过程中消耗的能量较少[32]。此外,农业废弃物的资源化利用不仅有助于环境保护,还可以避免对木质生物质原料的依赖,从而减少森林砍伐。因此,目前国内外研发重点主要集中在秸秆类农业废弃物的高效生物炼制方面。

表1 3种国内常见农业废弃物的组分
2.2 原料预处理
木质生物质主要由纤维素、半纤维素和木质素构成,半纤维素和木质素将纤维素包裹在内部。预处理可以将纤维素暴露,增加纤维素酶的可及性,从而提高酶解效果。因而,有效的预处理对于成功的酶水解和下游操作是至关重要的[33]。
图1展示了目前普遍使用的原料预处理方法,主要包括生物法、物理法、物理化学法和化学法。
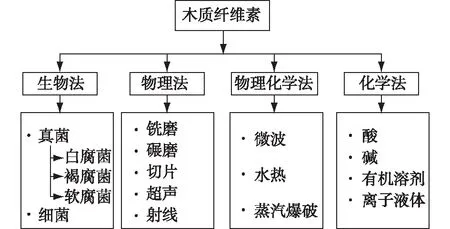
图1 常用的原料预处理方法Fig.1 Common methods used for feedstocks pretreatment
其中,生物法预处理采用微生物降解可再生生物质,从而改变其化学组成,这些微生物包括白腐菌、褐腐菌、软腐菌和细菌[34-36]。其中,白腐菌被认为是处理木质纤维素最有前景的微生物。Zhang等[37]筛选了35株白腐菌,用于处理竹子,他们观察到Echinodontiumtaxodii2538、TrametesversicolorG20和CoriolusversicolorB1是一类高选择性降解木质素的白腐菌,可以显著改善酶促糖化效率[38]。尽管生物预处理具有许多优点,如能耗低、处理条件温和,但菌株生长缓慢、预处理时间长且需要控制生长条件。因此,生物预处理面临着技术经济挑战,在工业生产上不具有吸引力。
物理法预处理主要是通过碾磨、研磨、切片、超声和射线等方式来破坏植物细胞的细胞壁结构,减小原料的尺寸,这可以提高下游预处理的效率。但是,在研磨阶段能量消耗较高,且若研磨成很小的颗粒反而会对随后的预处理产生负面影响,导致预处理结果并不理想。值得注意的是,超声和射线预处理方法本质上属于物理预处理方法,由于这2种方法不能去除木质纤维素材料中的半纤维素或木质素,所以常将这几种方法作为其他预处理方法的辅助工艺。其中,射线预处理由于安装成本太高,很少用于工业生产[39]。
常用的物理化学法预处理主要有微波、水热和爆破。其中,微波处理可以尽可能减小微晶纤维素的粒径(<4 mm),从而提高糖的产量[40]。Ma等[41]用微波处理稻草,在最佳条件下,纤维素含量从33.4%增加到41.8%,酸溶性木质素含量从2.1%减少到1.9%,总糖化率增加了30.3%。水热预处理可以在纤维素降解之前去除大部分半纤维素和部分木质素,具有反应器成本低、较少发酵抑制物形成以及可以直接使用湿物料的优点。由于纤维素在高于240 ℃的温度下会发生严重降解,因此处理温度通常为160~240 ℃[42-43]。此外,为了提高半纤维素或木质素的去除率,水热预处理也可以在化学物质催化下进行[44-45]。爆破主要包括蒸汽爆破和氨纤维爆破(AFEX),它们对环境的污染较小、产生的毒性物质也较少[46-48],Horn等[46]在210 ℃下蒸汽爆破处理小麦秸秆10 min时,酶水解产率达到最高。另外,经氨纤维爆破处理过的百慕大草的酶解糖产量也可以达到理论糖得率的94.8%[48]。
化学法预处理大致可以分为酸、碱、有机溶剂和离子液体预处理4种。
由于半纤维素和纤维素的糖苷键对酸敏感,酸预处理可溶解木质纤维素材料中的部分半纤维素,从而改善纤维素酶的可及性。在酸处理中,稀H2SO4预处理工艺的经济性最佳,一直是国内外研究的热点。Deshavath等[49]在最佳条件(0.2 mol/L H2SO4、121 ℃、120 min)下处理高粱秸秆,97.6%的半纤维素转化为木二糖、木糖和阿拉伯糖,且糠醛产率仅为4.6 mg/g。
碱预处理过程使得木质纤维素原料中半纤维素和木质素间的酯键断裂,从而促进半纤维素和木质素溶解,使纤维素暴露出来[50]。用于碱处理的试剂主要有NaOH、KOH、Ca(OH)2、Na2CO3和氨水,其中尤以Ca(OH)2预处理方法的效果最优,Kim等[51]曾使用此方法去除了87.5%的木质素。与此同时,氨预处理因氨易于回收、腐蚀性小、无毒等优点也被广泛研究[52],它除了可以去除木质素,还可以通过引发原料膨胀,增加比表面积,使其易于被纤维素酶水解[53]。
有机溶剂预处理则是通过有机溶剂在酸或碱的催化下破坏木质素和半纤维素之间的化学键,从生物质中提取木质素[54]。这个过程的优点是溶剂易于回收,提取的木质素也可以被用来生产其他化学品[39,55]。迄今为止,甲醇[56]、乙醇[57]、丙酮[58]和乙二醇[59]等溶剂被用来预处理操作,其中,乙醇由于其低毒性更安全[60-61]。但是,有机溶剂的价格较高,且由于其高挥发性,需要高压设备支持,因而难以用于工业生产中。
相比之下,离子液体是一种高效且“绿色”的纤维素溶剂,离子液体与纤维素分子中的羟基相互作用使得纤维素分子链间的氢键断裂,溶解纤维素形成均匀的溶液[61-63]。溶解的纤维素可以在一些抗溶剂中快速沉淀而被回收,如水、乙醇、甲醇或丙酮,Zhu等[64]发现回收的纤维素与初始纤维素具有不同的宏观和微观结构,特别是结晶度降低。此外,再生的木质纤维素的酶水解速率可以提高数倍至数十倍[65]。但是,由于大多数离子液体都非常昂贵,且预处理需要较严格的条件,造成工艺成本很高。
2.3 纤维素酶水解
高效的预处理是成功酶解的基础,而使用合适的纤维素酶进行水解可以有效从可再生生物质中释放出单糖。纤维素酶是一系列协同将纤维素转化为葡萄糖的酶的混合物,典型的纤维素酶系统至少需要3种酶来行使这个功能,包括内切-1-4-β-葡聚糖酶(EC 3.2.1.4)、外切葡聚糖酶(EC 3.2.1.91)和β-葡糖苷酶(EC 3.2.1.21)[66-67]。纤维素酶通过吸附、生物降解和解吸3个步骤发挥作用,然而在水解过程中,纤维素酶活性会降低,这可能是由于其对纤维素的不可逆吸附作用。木质素对酶的非生产性吸附也会对纤维素酶的活性产生不良影响。因此,一些研究确定了几种消除纤维素酶抑制的方法。Liu等[68]已经证明添加的金属离子(Ca2+和Mg2+)可以与木质素形成络合物,增强酶水解。表面活性剂也可以改变纤维素表面的特性,减少酶对纤维素的不可逆结合,防止纤维素酶变性以及与木质素的非生产性结合,Tween 20被证明是可以增强纤维素酶促水解最有效的非离子表面活性剂[69-70]。此外,Erickson等[71]报道了牛血清白蛋白(BSA)可以阻断木质素与纤维素酶的相互作用从而保护酶活性。Sewalt等[72]则发现木质素对纤维素酶的不利影响可以通过木质素的氨化和各种含氮化合物的添加来克服。
预处理产生的发酵抑制物会对酶解过程产生不利影响,需要首先对水解液进行脱毒处理来提高酶解效率。水解液脱毒方法可以分为物理法、化学法和生物法。
物理法脱毒主要包括蒸发[73]、有机溶剂萃取[74]、离子交换树脂[75]、活性炭吸附[76]和膜分离[77],其中最常用的方法是活性炭吸附。Liu等[78]发现活性炭可以吸附25%的可溶性发酵抑制物,即羟甲基糠醛(HMF)、糠醛和酚类化合物,用活性炭脱毒后的水解液发酵可得到13 g/L丁醇,而未经脱毒的水解液发酵生产的丁醇质量浓度仅为1 g/L。
化学法脱毒是在特定的pH下沉淀有毒化合物或使发酵抑制物电离,后者能够改变化合物的毒性程度[79-80]。常见的用来进行化学脱毒的试剂有Ca(OH)2、NaOH和KOH等,其中Ca(OH)2的脱毒效果最佳。
生物法脱毒方分为两大类:微生物酶的使用和可以改变发酵抑制物结构的生物试剂的使用[81]。在最近的研究中,Morozova等[82]为了提高丁醇产量,使用了一种微生物联合体的活性污泥,它只利用木质纤维素水解液中的有毒成分而不消耗碳源,从水解产物中去除了98%的HMF和99%的糠醛。
2.4 纤维素丁醇发酵工艺
发酵工艺是决定丁醇产量的重要因素,合适的发酵策略的选择能够大大提高丁醇产量,目前广泛使用的丁醇发酵工艺主要有:分步水解发酵(SHF)、同步糖化发酵(SSF)和同步糖化共发酵(SSCF),其中SHF和SSF是丁醇生物炼制过程中常用的2个工艺。
SHF工艺是将水解和发酵在各自的最佳条件下分别进行,首先将预处理的可再生生物质通过纤维素酶转化为可发酵的糖,然后将可发酵糖进行灭菌后作为发酵碳源用于微生物发酵。目前,大部分研究都是利用SHF工艺来生产生物丁醇,但是,SHF工艺具有一些明显的缺点。首先,在酶解过程中葡萄糖的积累会对β-葡萄糖苷酶产生抑制作用,导致酶解效果不佳;其次,在SHF工艺中,高温灭菌不仅会破坏酶解液中的一些营养物质,还会产生少量糠醛和5-羟甲基糠醛[83]。因此,为了克服SHF工艺的缺点,Gauss等[84]开发了同步糖化发酵的方法,已在生物乙醇的生产中被广泛研究,最近开始用于生物丁醇的生产。
SSF工艺是在一个容器中同时进行水解和发酵,水解过程中产生的糖立即发酵成丁醇,避免了糖积累对纤维素酶的抑制,从而提高了酶解效率[85],获得更高的丁醇产率[86],有效降低总操作成本。Dong等[87]以玉米秸秆为原料分别采用SHF工艺和SSF工艺进行丁醇发酵,SSF工艺发酵得到12.3 g/L丁醇,比SHF工艺发酵得到的丁醇浓度高出20.6%。另外,Sasaki等[88]以木屑为原料,通过SSF工艺获得了100%的ABE转化率。
但是,SSF工艺也有一定的缺点,即酶解和发酵过程的最佳温度不同,这可能导致酶解或发酵效果不佳。Qureshi等[89]评估了在35 ℃、pH 6.8条件下,利用稀酸预处理的小麦秸秆生产ABE的同步糖化发酵工艺,结果发现,SSF工艺生产的ABE质量浓度为12 g/L,而SHF工艺生产的ABE质量浓度为13 g/L,产生这样的结果是由于酶解产糖速度低于梭菌消耗糖的速度。因此,该研究提出了改进SSF工艺的方法,即在较高温度和较低pH下进行SSF,使环境有利于纤维素酶水解。此外,Guan等[90]发现,在SSF的过程中,随着固载量的增加,发酵液因变得黏稠而产生了“固体效应”,这会使得发酵效果变差,丁醇得率大大降低。在SSF工艺中,为实现溶剂产量最大化,使用50 g/L的固载量为最佳,当固载量增加到70 g/L时,会由于酶水解受到阻碍而使得丁醇产量下降,由此可知,很难利用SSF工艺得到高浓度的溶剂[90]。
SSCF工艺是SSF的改进,这个过程通常需要通过对菌株进行基因改造,使其可以同时利用葡萄糖和戊糖,提高酶解发酵效率,也可以同时使用几种菌株进行共发酵来提高糖利用率。SSCF工艺大多是用于生物乙醇的发酵中,Jafari等[91]首次评估了SSCF工艺对溶剂产量的影响,对比了同步糖化发酵和同步糖化共发酵生产溶剂的效果,结果发现,与SSF相比,SSCF工艺使溶剂产量增加了27%~36%。
3 生物丁醇的研究进展
3.1 生物丁醇的主要瓶颈
尽管ABE发酵是最古老的大规模发酵过程之一,但目前仍面临许多困难。首先,产溶剂梭菌可以发酵各种己糖和戊糖,但其优先利用的底物是葡萄糖,对其他糖类的利用率较低。如前所述,生物丁醇可由不同种类的原料生产得到,但由于它们含糖的种类不同,菌株很难有效地利用水解液中所有的可发酵糖,这使得丁醇产率较低。其次,尽管预处理大大提高了酶解效率,是将可再生生物质转化为生物丁醇的重要步骤,但是在预处理时会产生一些降解副产物,作为纤维素酶和发酵菌株的抑制物,这些副产物积累到一定程度会给整个过程带来不利的影响。再次,丁醇对宿主细胞的毒性较高,积累到一定程度会导致微生物自溶,据报道,菌株以可再生生物质作为原料发酵产生的总溶剂质量浓度通常仅有20 g/L左右[92],Ezeji等[93]也发现,在反应器中,当总溶剂质量浓度高于16 g/L时,细胞的生长开始受到抑制。最后,在传统的ABE发酵中,副产物丙酮、乙醇和有机酸的产生也影响了丁醇生产的经济性,分离这几种产品会增加成本。因此,针对这些丁醇生产的瓶颈,常利用菌株改造和丁醇分离这2种方法来提高丁醇产量。
3.2 菌株改造
3.2.1 提高菌株对底物的利用
用于生产丁醇的原料中大多含有不同种类的己糖和戊糖,针对这些原料进行菌株适应性改造有助于提高糖的利用率和丁醇产量。Li等[94]用低能离子束和N-甲基-N-硝基-N-亚硝基胍对C.beijerinckiiL175进行诱变后分离出突变菌株MUT3,并以甘蔗糖蜜作为底物进行丁醇发酵实验,发现MUT3可有效利用底物中的葡萄糖、果糖和蔗糖,且丁醇质量浓度最大能达到14.9 g/L。此外,在最近的研究中,Zhang等[95]构建的基因工程菌株C.tyrobutyricumCt(Δack)-pscrBAK在以甘蔗汁为底物的发酵中表现出对蔗糖的高利用率。对于木质生物质和农业废弃物来说,其主要的单糖单元为葡萄糖和木糖,由于产溶剂梭菌对木糖的利用率较低,因此需要提高菌株对木糖的利用率。Gu等[96]通过破坏C.beijerinckii中编码D-木糖阻遏物XylR的基因cbei2385使得D-木糖的消耗显著增加。Xiao等[97]将C.acetobutylicumATCC 824中编码D-木糖质子同向转运体、D-木糖异构酶和木酮糖激酶的基因cac1345、cac2610和cac2612过表达后,对D-葡萄糖、D-木糖和L-阿拉伯糖的混合物进行发酵,得到的总溶剂比野生型菌株高了24%。这些策略都使得梭菌更适合利用木质纤维素材料生产丁醇。对于海洋大型藻类来说,它们含有一些不被梭菌利用的糖成分,如L-鼠李糖、半乳糖和3,6-脱水-L-半乳糖,这些糖是绿色和红色大型藻类的主要成分,因此必须通过代谢工程来克服这一障碍,但目前相关的研究还比较少。
3.2.2 提高菌株对丁醇的耐受性
为了克服丁醇对宿主细胞的高毒性,已经在产溶剂梭菌中尝试了各种代谢工程策略。热激蛋白(HSP),也称为分子伴侣,是细胞应激反应相关的重要蛋白,在蛋白质的合成、转运、折叠和降解中发挥重要作用。HSP的表达可以由很多种应激物诱导,包括溶剂和其他生物体内的有毒化学物质[98-101]。热激蛋白的过表达使得菌株在应激状态下具有更高的存活率。在丙酮丁醇梭菌中,groESL过表达将丁醇胁迫引起的生长抑制降低了85%,细胞代谢时间延长了2.5倍[102]。在后续工作中,Tomas等[101]又证明当细胞受丁醇胁迫时,groESL过表达会使得其他几种HSP编码基因的表达增加,包括dnaKJ、hsp18和hsp90。此外,Spo0A是一种反应调节因子,可作为基因表达的激活因子和抑制因子,Alsaker等[99]发现spo0A过表达使得与应激反应相关的一些基因表达上调,菌株响应丁醇胁迫的耐受性增加且代谢时间延长。Zhu等[103]通过实验发现在培养基中添加谷胱甘肽可以提高细胞的存活率,提出了另一种基因改造的方法,即引入大肠杆菌gshAB基因,使得C.acetobutylicumDSM1731产生谷胱甘肽,以此来赋予宿主菌株更强的丁醇耐受性。为了解决丁醇耐受性的问题,还有一些研究直接转向其他具有较高丁醇耐受性的菌株,以它们作为平台宿主来异源表达生物丁醇相关的基因。迄今为止,已开发出许多非天然丁醇生产菌株,如大肠杆菌[104-105]、酿酒酵母[106]和短乳杆菌[94]等。
3.2.3 提高菌株产丁醇的比例
开发高丁醇比例或仅含丁醇的产溶剂梭菌可以显著改善ABE发酵的经济性,一些研究希望通过敲除产丙酮和酸途径的相关基因,或是过表达与产丁醇相关的一些基因,来提高梭菌产丁醇的比例。例如,adc、ctfA和ctfB这3个基因在丙丁梭菌中负责将乙酰乙酰-CoA转化为丙酮,在ctfA、ctfB和adc单敲除突变体中完全没有丙酮的形成也证实了这点[107-110]。然而,在ctfA、ctfB和adc单敲除突变体发酵实验中,丁醇产量也减少,而乙酸和丁酸产量则增加,这表明丙酮生成途径对酸重吸收起到重要作用。Jiang等[108]破坏了工程菌株C.acetobutylicumEA 2018中的adc基因后,丙酮产量仅有0.21 g/L,再通过调节pH和添加甲基紫精的手段控制电子流向,使得菌株产丁醇的比例达到82%。另外,还有一些研究是通过敲除与产乙酸和丁酸的相关基因来提高菌株产丁醇的比例,这些基因分别是pta、ack、ptb和buk。Jang等[111]发现pta和buk单敲除突变体发酵的丁醇质量浓度为17.2和15.2 g/L,与野生型C.acetobutylicumATCC 824的11.8 g/L相比,产量有所增加。Shao等[112]发现buk单敲除也可以提高丁醇产量,基于这个事实,Jang等[111]将pta和buk同时敲除,发现丁醇占总溶剂的比例提高到0.8,丁醇浓度进一步提高。
3.3 丁醇分离
丁醇分离通常采用发酵分离耦合的方法,在发酵的同时将丁醇分离出来,一方面可以得到高浓度丁醇,另一方面可以将丁醇从发酵液中移除,减轻丁醇对微生物的毒性,从而提高丁醇产量。目前常用的丁醇分离方法主要有吸附、气提、液-液萃取和渗透汽化等。
吸附是指液体或气体混合物的其中一种颗粒优先附着在固体表面的过程,介孔碳、活性炭、大孔吸附树脂、高二氧化硅沸石和硅沸石等都可以吸附丁醇,从而达到回收的目的[113-116]。最近,Xue等[117]开发了一种有效的方法,将细胞固定在纤维基质中,并用活性炭吸附丁醇,在整个原位吸附发酵过程中产生了54.6 g/L丁醇,通过热解吸得到含约167 g/L丁醇的冷凝物。虽然吸附具有高选择性和易操作性,但当吸附剂重复使用时,细菌和培养基中的营养成分会吸附在吸附剂上,导致吸附效率的降低。
气提是通过鼓泡将气体介质释放到生物反应器或塔中,然后通过冷凝器的冷凝从发酵液中回收挥发性溶剂的方法。代表性研究是采用间歇式气提在补料分批发酵中产生高浓度的丁醇[118],在此研究中,发酵共产生113.3 g/L丁醇与172 g/L 总溶剂,当发酵液中丁醇质量浓度大于8 g/L时进行气提,自发相分离后最终产物中含有大于600 g/L的丁醇。此外,发酵时产生的H2和CO2可以经回收后用到气提中,并在生物反应器和冷凝器之间的闭合回路中循环利用[93]。与其他分离技术相比,气提具有操作简单、成本低,效率不会因生物质的堵塞而受影响的优点[93,119]。但是,气提过程中需要防止气泡过多或其直径太大而影响传质效果。
液-液萃取是使萃取剂与发酵液接触,通过分配系数的不同而使目标产物溶解在萃取剂中的一种方法。许多萃取剂,如油醇[120]、生物柴油[121]、癸醇[122]和甲基化粗棕榈油[123],已经被用来从水溶液或发酵液中提取ABE。在各种萃取剂中,油醇的分配系数相对较高且对微生物无毒性。当以木薯为原料用C.acetobutylicumATCC824发酵时,使用油醇作为萃取剂产生了35.9 g/L丁醇[124]。原位萃取发酵是最节能的一种工艺,但是由于分配系数低,萃取相中的丁醇浓度通常远低于使用其他技术回收得到的丁醇浓度。此外,在发酵过程中直接提取丁醇可能会形成乳液并产生萃取剂结垢的问题,导致不完全的相分离和发酵液污染。
渗透汽化是建立在膜分离技术基础上的,进料溶液直接与膜的选择性层接触,然后将渗透物在冷阱中冷凝回收。很多研究者已经评估了各种聚合物膜的丁醇回收效率,其中聚二甲基硅氧烷(PDMS)复合膜由于其超疏水性、良好的热稳定性和力学稳定性而被广泛研究[125-127]。许多研究希望通过制造疏水性填料混合的复合膜或多层复合膜来改善膜性能。例如,Xue等[128]发现当沸石混合的PDMS膜整合在发酵系统中用于丁醇回收时,丁醇产量提高至34.5 g/L,回收后得到含有169.6 g/L丁醇的冷凝物。在最新的研究中,Yang等[129]开发出了垂直定向两端开口的碳纳米管-聚二甲基硅氧烷复合膜,有效提高了乙醇和丁醇的分离效率。渗透汽化被认为是丁醇回收最具潜力的方法,因为它具有高分离因子且对细胞培养没有影响,但生物分子、培养基组分和细胞会引起膜污染,导致渗透汽化性能的降低。
最近,汽化渗透过程开始被提出,这个过程是在生物反应器中通过气提将挥发性溶剂以蒸汽的形式选择性地渗透过分离膜,实现与水脱离,获得目标产物。Xue等[130]在ABE发酵期间利用汽化渗透,对含有约10 g/L丁醇和17 g/L 总溶剂的玉米秸秆发酵液进行原位产物回收,最终获得含有212.0~232.0 g/L丁醇、86.3~115.5 g/L丙酮和8.3~8.6 g/L乙醇的回收冷凝物,而经渗透汽化过程回收的冷凝物中仅含有71.5~77.4 g/L丁醇,35.0~39.8 g/L丙酮和6.3~6.7 g/L乙醇。当使用相同的膜时,汽化渗透过程对ABE溶剂的选择性比渗透汽化更高,它更像是气提和渗透汽化的组合,使ABE回收更加高效[130]。
4 展望
生物丁醇具有洁净、热值高和腐蚀性小等特点,是最具前景的可再生生物燃料。由于木质纤维素难分解、预处理产生的发酵抑制物和丁醇毒性等问题使得生产成本较高、丁醇产量较低。其中,预处理的能量消耗是丁醇生产成本较高的主要原因,至今仍未开发出环保、经济、有效的预处理方法,为了寻求适当的预处理策略,未来研究的重点应集中在以下几个方面。首先,应尽可能减少能量输入,减少化学品和水的使用;其次,开发清洁的去木质素剂,最大程度保留己糖和戊糖;最后,减少糠醛、5-HMF和乙酸等发酵抑制物的产生,避免增加脱毒环节。此外,尽管各种丁醇分离技术可以减轻丁醇的抑制作用并提高产率,但设施的建造和分离过程中能量的消耗都会增加丁醇的生产成本。因此,菌株改造成为降低成本的关键。一方面,提高菌株对碳源利用,尤其是对戊糖的利用,来提高原料利用率;第二方面,开发出稳健的丁醇高产菌种,同时将经典ABE发酵转化为单一丁醇产品的发酵,可减少不必要的碳流失,有效提高原料转化率;第三方面,提高菌株对发酵抑制物和丁醇的耐受性,开发适用于无需脱毒处理的纤维素料液的生产菌株,节约能耗并减少废水产生。总体而言,生物丁醇的炼制工艺需要适当整合预处理方法、菌株改造和丁醇分离技术,通过大量的协调研究进行优化,从而获得高产量、高浓度的生物丁醇以及增值副产品。

