多孔整体柱固定化酶研究进展
陈佩佩,龚林军,吕永琴
(北京化工大学 生命科学与技术学院 北京市生物加工过程重点实验室,北京 100029)
酶作为一种生物催化剂,与无机催化剂相比具有高效性、专一性和温和性等优点,在工业催化中具有广泛的应用。但游离酶稳定性差、不能重复使用,通常需要对其进行固定化。与游离酶相比,固定化酶具有稳定性高、易于分离回收、可重复使用以及操作工艺简便且可控等一系列优点。
固定化酶的性能主要取决于固定化方法和所使用的载体材料,二者能直接影响固定化酶的催化活性。理想的固定化酶载体需要具有以下特点:较高的稳定性、良好的生物相容性、大的比表面积、传质性能好、易于功能化修饰和成本较低等[1-2]。近年来,研究者开发了很多新的固定化酶载体,但大多停留在实验室的小试阶段,难以应用于工业催化放大应用。
整体柱(monolithic column),又称为连续床,是由单体、交联剂、致孔剂以及引发剂的混合溶液在色谱柱内通过原位热引发或光引发聚合得到的整体、连续的柱体。相对于常规填充柱,具有制备简单、易于改性、渗透性好、柱压低和传质速度快等优点。20世纪50年代,诺贝尔奖获得者Synge课题组首次提出了类似整体柱结构的介质[3]。1967年,Kubín等[4]用高度溶胀的聚2-羟乙基甲基丙烯酸制备了整体柱并用于蛋白质的分离,但由于柱体溶胀、耐受压力低,一直没有引起人们的注意。直到1989年,Hjertén等[5]用高度交联的丙烯酰胺成功制备了软胶整体柱并应用于蛋白质的分离,整体柱技术才日益受到人们的重视。其后Svec等[6]和Ishizuka等[7]用聚甲基丙烯酸酯和聚苯乙烯制备了高硬度有机聚合物整体柱。整体柱技术越来越受到人们的关注,并被誉为第四代生物色谱固定相,广泛应用于色谱分离、固相萃取、分析检测、气体储存和生物催化等领域。
多孔整体柱作为固定化酶的载体,其独特的优点在于大的贯穿孔道和良好的通透性,区别于传统固定化酶载体的扩散传质,整体柱可以为底物和产物提供快速的对流传质性能,从而大大提高酶催化的速率和效率。同时,整体柱的“柱体”形式可以实现连续可控酶催化反应,产物易于分离,有利于实现工业放大。
根据整体柱骨架结构的材质不同,可将整体柱分成无机整体柱、有机聚合物整体柱、杂化整体柱(有机-无机杂化整体柱)和纳米材料整体柱。本文中,笔者将主要从硅胶整体柱、有机高聚物整体柱、有机-无机杂化整体柱和纳米材料整体柱4个方面介绍近年来整体柱在固定化酶方向的研究进展。
1 硅胶整体柱固定化酶
硅胶整体柱是以硅胶为基质的无机整体柱,与有机聚合物整体柱相比,具有理想的力学强度和比表面积大的优点,缺点是化学稳定性不高、适用的pH范围较小。
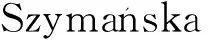
硅胶整体柱除了以毛细管和不锈钢柱为模具外,也可在微流控芯片的微通道内合成。He等[12]在微流控芯片里制备了聚乙烯亚胺修饰的硅胶整体柱(图1),通过静电吸附作用对乙酰胆碱酯酶和胆碱氧化酶进行共固定化,利用电化学方法检测了马拉氧磷、毒扁豆碱和灭多虫,检测限分别达到0.5、0.2和1.0 μmol/L。在微流控芯片微通道内制备硅胶整体柱的难点之一是整体柱材料与通道表面的结合力差,这会引起整体柱的收缩和脱落。为解决这一问题,Yesil-Celiktas等[13]选用四乙氧基硅烷(TEOS)和乙二醇改性硅烷(EGMS)为前体,同时加入聚氧化乙烯(PEO),大大降低了硅胶整体柱的收缩,保证了整体柱的多孔结构,以此对葡萄糖-6-磷酸脱氢酶和纤维素酶进行固载,最高转化率可达28.8%。Pirozzi等[14]通过对四甲氧基硅烷、甲基三甲氧基硅烷和N-丙基三甲氧基硅烷3种硅烷偶联剂前体的配比进行优化,成功解决了整体柱材料与芯片通道表面结合力差的问题,同时通过增加整体柱的疏水性提高了酶的活性。
(a)整体柱通道(宽600 μm,深50 μm,长20 mm);(b)电化学检测通道(宽1.5 mm,深50 μm,长20 mm);(c)连接通道(宽100 μm,深50 μm,长5 mm);(d)入口(直径1.5 mm,连接塑料管的直径0.5 mm);(e)出口(直径1.5 mm);(f)工作电极(WE,铂圆盘,直径0.5 mm);(g)铂电极CE(直径1 mm);(h)参考电极RE(Ag/AgCl,直径1 mm)图1 微流控装置示意[12]Fig.1 Schematic of the micro-fluidic device[12]
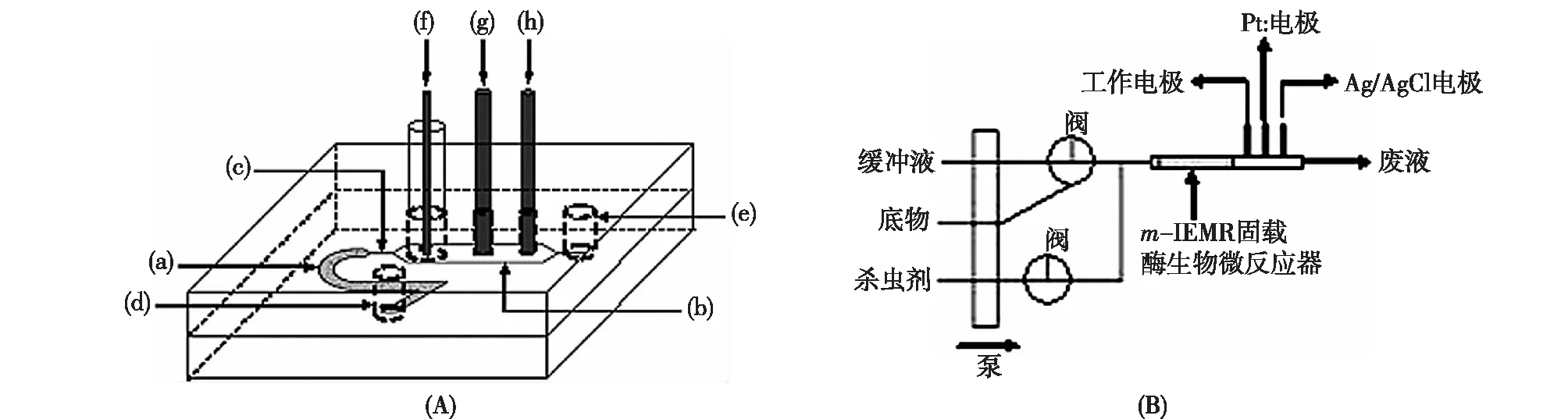
多酶的共固定化是酶工程领域的重要研究课题,底物通道效应[15]是多酶催化需要解决的关键科学问题,即前一个酶催化反应的产物直接进入到下一个酶的活性中心作为底物进行催化反应,而不是扩散进入反应微环境中[2]。因此,多酶共固定化需要实现每个酶的定向有序固定化。Yin等[16]利用硅胶整体柱成功实现了苯甲酸酶、蛇毒磷酸二酯酶和碱性磷酸酶的有序固定化,设计了三酶酶联微反应器(图2),在10 min内可将99.5%的基因组DNA酶解成单核苷酸。与HPLC-MS联用,从膀胱癌细胞(T24)的基因组DNA中成功检测到表观遗传5-甲基胞嘧啶的主要氧化产物5-羟甲基胞嘧啶。
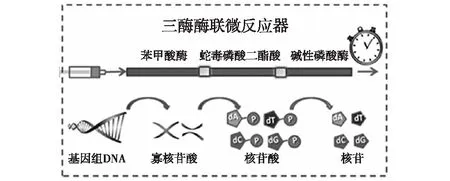
图2 硅胶整体柱有序固载苯甲酸酶、蛇毒磷酸二酯酶和碱性磷酸酶的三酶酶联微反应器的设计合成[16]Fig.2 Schematic diagram of design and synthesis of athree-enzyme-linked microreactor with orderlyimmobilized formate,snake venom phospho-diesterase and alkaline phosphatase[16]
在基于鸟枪法的蛋白质组学研究中,蛋白质酶解非常重要,整体柱固载酶在保证高效酶催化的同时,有利于减少酶的自身降解和交叉感染,并可以实现和分离鉴定系统的联用。Rivera等[17]合成了硅胶和钛整体柱,通过包覆一层生物仿生聚多巴胺膜,实现对胰蛋白酶的固定化,并与质谱联用,对蛋白质组学进行分析。Stanley课题组的Foo等[18]利用该类型的胰蛋白酶微反应器结合高效液相-电喷雾-质谱/质谱(LC-ESI-MS/MS)分析了马血浆中重组人红细胞生成素的酶解和去糖基化反应过程。
除以上应用外,硅胶整体柱还被用于蛇毒磷酸二酯酶、大豆过氧化物酶、转氨酶和青霉素G酰化酶等多种酶的固定化,并将固定化酶应用于不同的研究领域。
2 有机聚合物整体柱固定化酶
有机聚合物整体柱的制备是将单体、致孔剂和引发剂的混合溶液注入空模具内,经热、光或γ线引发,在模具内发生聚合形成整体柱,聚合完成后用合适的溶剂除去柱体内的致孔剂和残留的单体,其主要特点是制备过程简单,渗透性和孔径可通过调整致孔剂的配比来改变,pH使用范围宽。此外,可供选择的单体类型非常丰富,种类上基本不受限制,可根据不同的需要选用相应的有机功能单体,还可在基质的表面进一步修饰或衍生,以满足不同的需求[19]。
Xie等[20]首先将有机聚合物整体柱应用于酶的固定化,他们利用甲基丙烯酸缩水甘油酯(GMA)作为功能单体合成有机聚合物整体柱,通过环氧基团与乙二胺反应键合氨基,进一步利用戊二醛交联实现胰蛋白酶的共价固定化。由于整体柱快速的对流传质性能,胰蛋白酶生物微反应器的催化反应速率是游离酶的300倍,在88 s内即可实现蛋白质的快速酶解[21]。Ozoner等[22]也利用戊二醛交联的方法实现了辣根过氧化物酶的固载,对酚类物质的检测限为1~250 μmol/L。除戊二醛交联外,也可通过静电吸附作用或金属螯合作用实现酶的固定化,例如,可选用带氨基的功能单体(如甲基丙烯酸氨基乙酯)合成整体柱,通过氨基对酶的静电吸附作用实现酶的固载[23]。同时,可利用聚乙烯亚胺(PEI)修饰聚甲基丙烯酸缩水甘油酯整体柱,之后吸附Cu2+,通过金属离子对酶的配位作用固定化酶[24]。后来很多课题组也将聚甲基丙烯酸缩水甘油酯整体柱用于脂肪酶、胰凝乳蛋白酶、核糖核酸酶A、糖基肽酶和乙酰胆碱酯酶的固载,成功实现了药物的手性拆分、核苷酸降解、糖基化分析和抑制剂的筛选。
乙烯基吖内酯是另一种易衍生的功能单体,其吖内酯基团在常温下可与酶的氨基反应,从而实现酶在温和条件下的共价固载。Xie等[20]首次提出利用乙烯基吖内酯和丙烯酰胺作为功能单体,乙二醇二甲基丙烯酸酯(EDMA)作为交联剂合成整体柱,通过吖内酯基团的开环反应对胰蛋白酶进行固定化。结合甲基丙烯酸缩水甘油酯和乙烯基吖内酯2种功能单体,该课题组同时开发了新的固定化酶工艺[25],首先合成聚甲基丙烯酸缩水甘油酯整体柱,在碱性条件下与甲基丙烯酸羟乙酯(HEMA)反应,再通过光引发接枝乙烯基吖内酯。该工艺一方面在整体柱上引入了HEMA,增加了聚合物的亲水性,降低了酶解过程中底物蛋白质和产物多肽的非特异性吸附;另一方面,光引发接枝改性大大提高了吖内酯的键合量,从而增大了酶的固载量。也可利用N-丙烯酰氧基琥珀酰亚胺为功能单体制备整体柱,通过琥珀酰亚胺与酶的氨基的共价结合,实现酶的固载[23]。
除通过自由基聚合反应外,有机聚合物整体柱也可通过相分离技术合成。Sun等[26]利用非溶剂致相分离法制备了聚乙烯醇整体柱,比表面积高达102 m2/g,通过键合聚乙烯亚胺(PEI)和戊二醛,分别通过静电吸附和共价结合对脂肪酶和辣根过氧化物酶进行了固载。Uyama等[27]通过热致相分离合成了聚甲基丙烯酸缩水甘油酯整体柱,通过EDC/NHS共价偶联或醛基交联实现了胃蛋白酶的固载。
寻求高效的化学反应是提高酶固载率的有效手段。Kolb等[28]提出的点击化学(click chemistry)具有产率高、副产物无害、反应立体选择性高、反应条件简单、原料和反应试剂易得、合成反应快速、可在水相合成、产物对氧气和水不敏感、符合原子经济性等优点。目前常用的点击化学反应主要包括铜催化叠氮化炔环加成(CuAAC)反应和硫醇-烯(thiol-ene)点击反应。Çelebi等[29]将聚甲基丙烯酸缩水甘油酯整体柱与叠氮化钠反应键合叠氮基团,对α-胰凝乳蛋白酶修饰键合炔键,利用CuAAC点击化学反应实现了α-胰凝乳蛋白酶的固载。Wu等[30]分别合成了叠氮配基和炔键配基的整体柱,分别对键合炔键合叠氮基团的辣根过氧化物酶进行了固载。与Cu(I)催化点击化学法相比,硫醇-烯(thiol-ene)点击反应无需使用金属铜作催化剂,具有良好的应用前景。Lafleur等[31]首次利用硫醇-烯点击化学在微流控芯片微通道内合成了乳液模板化的整体柱,成功实现了半乳糖氧化酶和糖基肽酶的固载(图3)。同时,其他研究者利用相同的方法构建整体柱,对胃蛋白酶进行固定化,与超高效液相色谱-质谱(UPLC-MS)联用,对酶解后的多肽进行了高效肽谱分析[32]。原子转移自由基聚合(ATRP)反应是以有机卤化物为引发剂、过渡金属配合物为卤原子载体,通过氧化还原反应,在活性种与休眠种之间建立可逆的动态平衡,从而实现对聚合物的可控合成。Li等[33]利用ATRP反应合成了聚乙二醇二甲基丙烯酸整体柱,同时利用ATRP反应在整体柱上接枝了聚(乙二醇)甲基丙烯酸酯,大大增加了环氧基团的含量,提高了胰蛋白酶的固载量,在50 s内可实现蛋白质的快速酶解,反应速率是游离酶的900倍。
图3 硫醇-烯点击化学和ASA连接构建肽-N-糖苷酶F固载酶生物微反应器实现核糖核酸酶B的去糖基化[31]Fig.3 Deglycosylation of RNase B on the enzymaticmicroreactor featuring PNG ase F immobilizedvia thiol-ene click chemistry and ASA linkage[31]
固定化酶在反复多次使用后会失活,为降低成本,载体的再生利用至关重要。对此,Xiong等[34]通过光引发自由基聚合反应在玻璃微芯片内合成了多孔的温度敏感性聚(N-异丙基丙烯酰胺)整体柱,当温度高于该聚合物的低临界溶液温度(LCST),聚合物发生收缩并呈疏水性,葡萄糖氧化酶(GOx)通过疏水作用被吸附固载到整体柱上;相反,当温度小于LCST,聚合物发生溶胀并呈亲水性,固载的GOx被释放。因此,通过对外界温度的控制可实现酶的可控固载和释放,从而实现载体的再生利用。研究者将整体柱固载酶芯片与碳纤维微电极联用,通过电化学法检测葡萄糖浓度,检测限为0.05~5 mmol/L。
3 有机-无机杂化整体柱固定化酶
有机聚合物整体柱的优点是具有大的贯穿孔道,在酶催化过程中有利于为底物和产物提供快速的对流传质性能,同时具有良好的热稳定性和化学稳定性,但缺点是比表面积较小、酶的负载量低。无机整体柱的优点是比表面积大,酶的负载量高,缺点是化学稳定性差。为充分结合二者的优点,研究者提出了有机-无机杂化整体柱的合成。
中国科学院大连化学物理研究所的张丽华和邹汉法课题组对有机-无机杂化整体柱固载酶微反应器的设计进行了系统深入的研究,其主要的应用是固载胰蛋白酶实现蛋白质组学分析。例如,Wu等[35]采用3-环氧丙氧丙基三甲氧基硅烷为功能单体(GLYMO)、硅酸乙酯(TEOS)为交联剂制备整体柱,对环氧基团水解后获得邻二醇,通过邻二醇与氨基的反应实现胰蛋白酶的固载,该固载酶微反应器在47 s内完成对牛血清蛋白的酶解,多肽片段覆盖率为35%。Ma等[36]选用四乙氧基硅烷水解溶胶、亚氨基二乙酸、3-环氧丙氧丙基三甲氧基硅烷合成杂化整体柱,Cu2+活化整体柱后,通过金属螯合作用对胰蛋白酶进行固载,在150 s内可实现对5 μg小鼠肝脏提取物的高效酶解,同时利用金属螯合作用的可逆性实现了整体柱载体的再生利用。Yuan等[37]通过四甲氧基硅烷和乙烯基三甲氧基硅烷的缩聚反应合成硅胶整体柱,再以甲基丙烯酸为功能单体、过硫酸铵为交联剂在硅胶整体柱上原位聚合制备杂化整体柱,利用碳二亚胺/N-羟基琥珀酰亚胺(EDC/NHS)反应对整体柱修饰键合聚乙烯亚胺,再进一步共价固载胰蛋白酶。该固载酶反应器与二维HPLC-MS/MS联用对低转移率的肝癌细胞蛋白萃取物进行酶解和蛋白组学分析,可识别检测3 000种蛋白质。Chen等[38]采用3-(甲基丙烯酰氧)丙基三甲氧基硅烷和正硅酸甲酯合成整体柱,将胰蛋白酶的二硫键还原为巯基,利用整体柱表面双键和巯基的“thiol-ene”点击化学反应实现酶的固载,反复使用100次后,残余酶活仍为87.5%。
除对胰蛋白酶进行固载外,Zhou等[39]利用双[3-(三乙氧基硅烷)丙基]硫代氨基甲酸为功能单体,与硅烷偶联剂反应合成了层状有机-无机杂化整体柱,对辣根过氧化物酶(HRP)的固载量为126 mg/g,催化活性是游离酶的3倍。
4 纳米材料与整体柱相结合固定化酶
多孔整体柱虽然能为酶和底物提供良好的对流传质性能,提高酶解反应速率,但是使用过程中仍然存在两个问题:一是整体柱由于具有连续的贯穿大孔,其比表面积较小,因此酶的固载量较低;二是传统的固载酶方法存在一定的弊端,不利于提高酶的稳定性和使用寿命。纳米材料由于其独特的小粒径效应、表面效应和界面效应,作为载体用于酶的固定化有利于保持酶的活性和稳定性,大大提高酶的固载量和催化效率[40]。然而,纳米颗粒尺寸太小、吸附性太强、极易团聚,单独作为载体固定化酶时,不利用后续与产物的分离。若将整体柱与纳米材料相结合,可以解决传统固载酶生物反应器传质速度慢、固载量低和催化效率差等问题,大大提高固载酶的稳定性、使用寿命、催化速率和效率。
由于纳米金具有良好的分子识别特性和生物相容性,笔者在毛细管内成功构建了高密度纳米金多孔聚合物整体柱[41]。合成聚甲基丙烯酸缩水甘油酯毛细管整体柱骨架材料,其环氧基团与胱胺反应,再通过三(2-羰基乙基)磷盐酸盐(TCEP)打开二硫键获得巯基,利用巯基与纳米金的亲和作用,在整体柱上成功地键合了一层排列规则、致密、连续的纳米金(图4),键合40 nm纳米金的键合量高达60%,为目前所有文献报道中的最大值。以纳米金作为中间配体,通过Au-S可逆亲和作用固载脂肪酶(图5),成功催化了玉米油和大豆油的酯交换反应生产生物柴油。对催化反应动力学的研究表明,该纳米金整体柱固载酶微反应器的最大反应速率是游离酶催化的1 000倍。该固载酶微反应器具有良好的使用寿命,连续催化1 760个反应器体积后,固载酶的残余酶活仍为80%。同时,纳米金与酶的亲和作用力可逆,作用条件温和,固载酶连续多次使用后失活,利用巯基乙醇破坏纳米金与酶的亲和作用,可以洗脱失活酶,重新固载新酶后可以再生利用,再生后的固定酶催化性能与新合成的催化性能相当。

图4 纳米金整体柱的扫描电子显微镜照片[41]Fig.4 Scanning electron micrograph of a nanogoldmonolithic column[41]
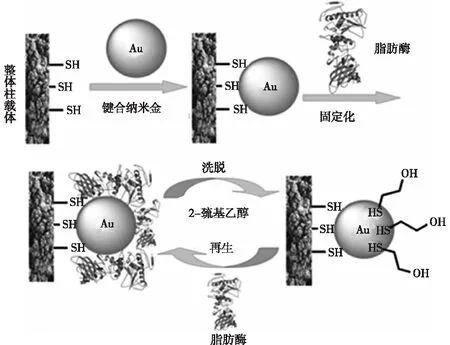
图5 纳米金整体柱固载酶微反应器的设计过程[41]Fig.5 Design process for a nanogold monolithiccolumn-loaded enzyme microreactor[41]
除纳米金外,Shangguan等[42]在合成有机-无机杂化整体柱时加入了SBA-15纳米颗粒,增大了整体柱的比表面积,分别通过戊二醛交联和金属螯合作用对酶进行固载,构建了胰蛋白酶微反应器和胰蛋白酶/糜蛋白酶双酶反应器,与单酶反应器相比,双酶反应器可鉴定的多肽片段数目增加1倍,提高了大鼠肝脏膜蛋白的总体功能分析。Xu等[43]研发了一种新的介孔二氧化硅纳米颗粒,与甲基丙烯酸缩水甘油酯(GMA)和乙二醇二甲基丙烯酸酯(EDMA)原位共聚制备整体柱,对胃蛋白酶进行固载,实现了药物的手性拆分,研究发现,硅纳米颗粒的引入大大增加了结合位点的数量,增大了酶的固载量,提高了手性拆分的效率。Hong等[44]提出了氧化石墨烯硅胶整体柱固载胃蛋白酶,研究了氨水、乙二胺和聚乙烯亚胺等不同修饰方法和间臂分子对氧化石墨烯负载量的影响。
5 结论与展望
整体柱具有制备简单、力学强度高和通透性好等独特优势,已被广泛应用于酶的固定化。本文中,笔者总结了硅胶整体柱、有机聚合物整体柱、有机-无机杂化整体柱和纳米材料整体柱固载酶的构建方法、应用及各自的优缺点,为提高酶催化的性能提供了新的思路和方法。在今后的研究中,仍然需要开发简单易控的整体柱制备技术,或对现有制备技术的工艺条件进一步优化,改善整体柱形貌和孔道的均匀性,提高整体柱的重现性和稳定性,继续发展新型高效的固定化酶方法,实现整体柱固载酶的工业化应用。

