原子力显微镜在测定颗粒与细胞相互作用中的应用
宋 翠,张 潇,魏 炜,马光辉
(1. 中国科学院 过程工程研究所 生化工程国家重点实验室,北京 100190;2.中国科学院大学,北京 100049)
近年来,纳微颗粒凭借其特殊的尺寸效应和物理化学性质,在医药、物理、光学和电学等领域应用越来越广泛,尤其是在生物医药领域,纳微颗粒被广泛用作缓释制剂、靶向制剂和疫苗佐剂等[1]。颗粒在体内输运过程中,其与体内细胞接触并相互作用,相关研究表明这种相互作用会对细胞的生长、迁移和细胞因子的分泌等生理过程产生重要影响,从而调控颗粒携带的生物药剂的药效发挥、靶向性以及颗粒的佐剂免疫效果等[2]。因此,研究颗粒与细胞的相互作用对于促进纳微颗粒在生物医药领域的应用有着重要的意义。
已有研究表明,颗粒与细胞的相互作用与颗粒的理化性质密切相关,颗粒的粒径、表面性质、形状等都会影响其与细胞的作用过程[3-4],并且随着微纳米制造技术的发展,定向调控颗粒的理化性质成为可能[5]。为了系统深入地研究颗粒与细胞的相互作用,定量检测作用过程的重要参数和阐明其微观作用机制,近年来发明和改进了许多先进的检测设备和技术,例如光镊[6]、磁镊[7]和原子力显微镜[8]等。其中,原子力显微镜(atomic force microscopy,AFM)由于具有高灵敏度(皮牛级)、高分辨率(纳米级)以及可在生理环境中进行实时检测等优势备受关注。虽然有研究报道原子力显微镜在生物医药中的应用[9-10],但对于原子力显微镜检测颗粒与细胞相互作用的文献综述却很少,因此,本文中笔者系统阐述AFM在研究颗粒与细胞相互作用的原理及应用,以期为后续的研究提供参考。
1 原子力显微镜的基本介绍
1.1 力学测量原理
自从1986年Binnig等[8]发明原子力显微镜以来,AFM 已成为获取材料表面原子级分辨率图片和检测力学性能的有力工具。AFM可以在真空、大气或者溶液环境中操作,检测对象可以是导体、半导体或者绝缘体,克服了之前扫描隧道显微镜只能对导电样品表面进行检测的局限。其工作原理如下:将一个弹性微悬臂的一端固定,另一端有一微小的针尖与样品表面相互作用,使悬臂发生位移,悬臂的位移通过激光和四象限检测器来进行记录监控,在扫描过程中,悬臂垂直方向的位移被转换成样品表面形貌,同时通过测定悬臂的弹性系数也可获得力与位移的曲线,如图1所示,包括靠近曲线和远离曲线。样品的力学性质(如黏附力、杨氏模量等)可以从力曲线中获得。黏附力可以直接从远离曲线中读取,杨氏模量需要先把力曲线转换为力与压痕深度的曲线,然后再选择合适的理论模型(Hertz模型或Sneddon 模型)来拟合计算[11]。
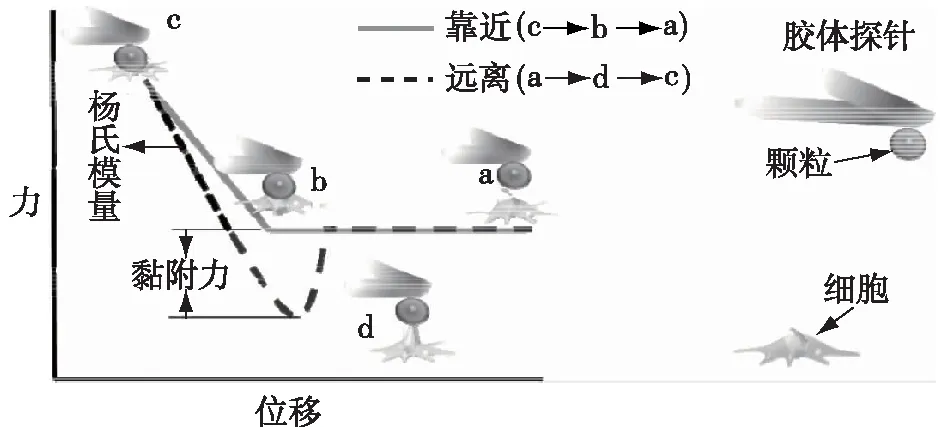
图1 AFM检测颗粒与细胞之间的相互作用力曲线Fig.1 Interaction forces between particle and cellmeasured by AFM
1.2 探针
探针是AFM最核心最重要的元件,它一般包含两个部分:悬臂和针尖。探针悬臂的材质通常是Si或者Si3N4,形状有矩形或V字形。为了提高反射率,悬臂的背面会镀有一层薄薄的金属层(一般为Au),这对于AFM在液体中进行检测是非常必要的,因为在液体中Si3N4的反射率会明显下降。悬臂的核心参数是其弹性系数,在进行力曲线测量时需要首先对其标定和校正,目前最常用的校正方法是Thermal Tuning法[12-13]和Sader法[14-15]。
探针针尖主要由Si或Si3N4材质制造,但是为了满足特殊的应用需求,钻石、碳或者矿物单晶等[16-17]也可用做探针针尖,形状通常是三角锥形,半径分布在十到几十纳米。
1.3 胶体探针
通过对探针表面修饰化学分子或目标蛋白,AFM可以检测不同分子之间或分子与细胞之间的相互作用[18-19]。为了进一步测量颗粒与细胞的相互作用,需要将微纳米级的颗粒黏附在探针悬臂末端,将其作为探针针尖与细胞接触来进行测量,这种探针被称为胶体探针[20](图1)。与传统探针相比,胶体探针有以下优点:首先,颗粒与细胞接触面的曲率半径大,这增加了颗粒与细胞的接触面积,减少了锥形探针对细胞局部应力过大的伤害;其次,接触面积变大使得细胞局部的硬度波动变小,因此只需较少的实验次数便可获得更可靠的数据;最后,将胶体探针与细胞表面接触的几何形状视为球形,细胞的杨氏模量就可以选用简单的Hertz 模型直接拟合得到[11],无需进行繁杂的公式推导,这极大地提高了数据处理效率。
胶体探针的出现为AFM的应用开拓了新的领域,研究者们进一步对胶体探针进行修饰[21-22],从而进行一系列特定相互作用力大小和作用机制的研究。自从Ducker等[20]和 Butt 等[23]在1991年报道了胶体探针制备技术后,已经涌现出各种各样的胶体探针的制备方法[24-25]。研究者们可以根据颗粒的性质、操作环境和特殊的设备要求等来选择合适的方法进行胶体探针的制备。
1.4 样品制备
AFM的样品不需要染色、标记或喷涂,因此分子、细胞等生物样品可以直接在生理环境中进行观察。然而生物样品的制备也是限制AFM在生物领域应用的主要原因,因为测量时需要保证生物样品牢牢地固定在基底上以避免被探针刮走或者发生结构改变。对于活细胞,特别是哺乳动物细胞,它们具备良好的贴壁生长性能,不会轻易被探针干扰或移动,因此可以直接在培养皿中进行扫描。而对于悬浮细胞或者细菌,就需要在扫描时使用特殊的实验方法将其固定,比如固定在滤膜膜孔中[26],或者通过修饰基底表面将样品固定[27]等。不管选择何种样品制备方法,在检测时都要尽量选择较小的力和合适的扫描模式以降低探针对样品的影响。
1.5 力学测量技术的发展
随着AFM的不断创新和优化,其检测模式和测量方法也不断被优化。在AFM现有的测量方法中,已经实现了细胞的表面形貌信息和相关力学性能的同步测量,避免了之前对力曲线的后续手动拟合环节,极大地提高了测量效率。其中的一种技术是力体积成像技术(force volume imaging)[28-29],这种技术可以对样品选定范围进行逐点力测定,并以图像中相应像素点的明暗程度表示作用力的大小,从而直观地反映出样品表面的整体特征,避免了单点力测定的一些局限性,然而其线性分辨率较低,且扫描速度较慢,因此获得一幅完整的表面图需要很长的时间。最新开发的一种技术叫定量纳米力学成像技术(peak force quantitative nanomechanical property mapping,PFQNM)[30-31],该技术不仅易操作,而且可以在轻敲模式下快速地获得高分辨率的样品表面力学图像,极大地提高了AFM力学测量的效率。
2 AFM测量颗粒与细胞相互作用在生物医药领域的应用
颗粒与细胞的相互作用会受到颗粒理化性质的影响,包括颗粒的大小、形状、表面电荷和官能团等,利用颗粒制备技术,比如物理性质优化、化学修饰或者生物合成等,可以制备需要的颗粒,从而满足其在生物医药领域的应用。利用AFM检测颗粒与细胞之间的相互作用,获得相应的力学性能,这些力学性能和体系中的生理现象相结合有助于解释颗粒在生物医药领域应用,如药物递送、免疫响应和细胞力学等涉及深层次的作用机制,包括颗粒进入体内后,影响其作为药物递送系统靶向性、高效性的因素和对细胞毒性的影响;颗粒与免疫细胞相互作用从而介导炎症反应的机制以及作为疫苗佐剂的免疫响应机制;颗粒与细胞相互作用对细胞结构以及力学性能的影响等。
2.1 药物递送
随着生物技术的发展,越来越多的生物药物得到发明和开发,例如,蛋白质、多肽、抗体和核酸等。然而生物药物存在体内易降解、半衰期短、患者必须接受频繁注射、血药浓度波动大、药效不理想或产生毒副作用等问题,特别是抗肿瘤药物存在瘤内渗透困难和细胞摄取不足的难题,这些都会导致实际治疗效果不佳。为了提高生物药物的利用率、靶向性并减少毒副作用,研究者们进行了大量药物递送系统的研究工作[32-33]。药物递送最基本的原则是直接将药物输送到目标组织或细胞以获得最好的治疗效果和最小的毒性影响,而阻碍治疗效果的原因主要是药物递送系统与各种生理和病理环境的复杂相互作用。生物纳米技术的应用使得纳微级颗粒的药物递送系统得以快速发展并备受关注[34-35],这些载体可包裹靶向细胞或组织的表面受体的成分,并具有膜内外运输的能力。
药物递送到指定位置时首先是载体颗粒与生物膜接触发生相互作用,如果要将更多的药物递送到靶向细胞,那么载体与细胞膜之间强烈的相互作用可能会引起细胞膜的不稳定,从而产生细胞毒性。AFM成像能在时空尺度上对细胞膜接触药物分子、纳米颗粒或药物复合物后产生的结构变化和膜重组过程进行监测。Banaszak研究组的Hong等[36]、Leroueil等[37-38]利用AFM成像揭示了具有氨基末端的聚酰胺(PAMAM)聚合物与细胞膜相互作用对细胞膜的影响,研究发现,带正电的PAMAM会引起细胞膜的无序排列,在磷脂双分子层区域形成直径约30 nm的孔,且会使膜变薄甚至发生膜扰动,而在这些无序排列的部位发现了药物递送系统的聚集,然而不带电的颗粒却不会产生这些变化。
通过胶体探针AFM,可以检测影响药物递送系统与细胞作用的各种影响因素,比如细胞、颗粒的性质和生理环境等。Pyo等[39]利用AFM研究了不同的细胞及细胞培养密度对纳米硅药物递送系统与细胞相互作用的影响,结果显示不同的细胞培养密度以及细胞表面的褶皱形貌都会对相互作用产生影响。Shinto 等[22]利用胶体探针研究了不同条件下聚乳酸微球(PLLA)与小鼠黑色素瘤细胞的相互作用,研究表明,微球表面包裹了羟磷灰石(HAp)纳米颗粒后,相较于光滑的PLLA颗粒,其与细胞的黏附力增大,并且在有血清的环境中比在无血清环境中黏附力也会增大,这可能是由于HAp/PLLA颗粒表面呈正电并会吸附较多血清中黏附蛋白的原因。Pyrgiotakis等[40]研究了功能化的纳米颗粒CeO2和Fe2O3在不同的生理环境中与肺的上皮细胞之间的相互作用,结果表明,它们之间的相互作用力很大程度上依赖于生理环境,在生理液中蛋白冠的存在减弱了颗粒与细胞之间的相互作用,另外,这种作用也受颗粒大小和材质的影响。
上述研究表明:要减少药物递送系统对正常细胞的毒性并且提高对于靶向细胞的靶向效率,其理化性质以及所处的生理环境等都会产生重要的影响。因此,构建高效安全的药物递送系统,需要评价各种因素,从而进行筛选。传统的筛选方法费时费力,而利用AFM测量药物递送系统与细胞之间的相互作用,通过测量黏附力,可以快速准确地评价各因素对相互作用的影响,这为设计和制备更加高效安全的药物递送系统提供了直观准确的理论依据。
2.2 免疫响应
免疫反应可分为非特异性免疫反应和特异性免疫反应。非特异性免疫反应对抗原反应迅速,是人体的第一道防线[41]。特异性免疫反应,是通过免疫细胞的选择和扩增来激活T细胞和B细胞,从而获得永久性免疫记忆[42]。非特异性免疫可以协同和参与特异性免疫反应。颗粒可以作为佐剂或半抗原激活免疫反应[43],当颗粒进入身体时,它们与免疫细胞的相互作用方式可能是多种多样的[44],它们可以与中性粒细胞、巨噬细胞和其他效应细胞作用从而引发炎症反应,也可以与树突细胞(DC 细胞)相互作用而被内吞噬从而发生抗原反应。而颗粒的物理化学性质会影响其与免疫细胞的相互作用和随后的免疫反应,所以检测颗粒与免疫细胞的相互作用对研究免疫反应、揭示免疫机制具有重要的意义。
为揭示颗粒激活免疫细胞,介导炎症反应的机制,Ng等[45]利用AFM研究了尿酸钠晶体与DC细胞膜的相互作用,结果发现,在没有受体的情况下,晶体颗粒能直接作用于细胞膜上特别是胆固醇部分,从而激活DC细胞内SyK激酶介导的信号传递。为研究最原始的免疫细胞吞噬颗粒的作用机制,Mu等[46]使用AFM联合荧光显微镜,通过AFM将聚苯乙烯颗粒置于DC细胞上与细胞接触,实时记录细胞膜上磷脂酰肌醇4,5-二磷酸(PIP2)和膜突蛋白的荧光图像,结果发现,在没有受体时,固体颗粒接触细胞膜引起质膜变形,使得PIP2蛋白聚集,从而结合膜突蛋白,进一步激活SyK激酶并引起细胞的吞噬作用。
颗粒佐剂作为一种重要的疫苗佐剂,其免疫效应也备受关注,其中铝佐剂被广泛应用,但其免疫机制尚不明确。为揭示铝佐剂的免疫作用机制,Flach等[47]将铝佐剂粘于AFM探针上,并实时检测铝佐剂与树突细胞的相互作用,结果发现,两者之间有很强的作用力,但铝佐剂一直停留在细胞膜上时并不会被吞噬,与铝佐剂相互作用后的DC细胞随后被激活。他们研究发现可能是由于细胞膜磷脂层结构的转变激活了DC细胞,从而提出了一种关于铝佐剂的新的免疫机制。
抗原提呈细胞(antigen-presenting cells,APCs)特别是DC 细胞的激活是引发机体免疫应答的第一关,DC 细胞表面表达多种受体,进入体内的抗原通过与受体识别、结合而激活免疫细胞是目前研究比较成熟的一种激活途径。另外,免疫细胞也可以在无受体参与的情况下被颗粒激活,但其激活的机制与途径等的相关研究却很少。研究者们通过AFM检测颗粒与免疫细胞之间的相互作用,为揭示无受体情况下颗粒激活APCs、介导炎症反应以及细胞吞噬等免疫作用机制提供了一种新的研究思路和方法。
2.3 细胞力学
细胞力学主要研究活细胞的行为、力学性能以及它们与细胞功能的关系。组成细胞的结构包括细胞膜、细胞骨架、细胞器和细胞质,它们的力学和动态行为以及如何相互作用从而影响细胞的整体性质是细胞力学研究的重点[48]。研究表明,细胞对于外界刺激的力学响应对于细胞的行为有重要的影响,例如,细胞的迁移、扩增、分化和凋亡等[49]。颗粒技术的快速发展使得颗粒成为研究细胞力学的理想工具,因为颗粒能与细胞直接接触,通过一定的方法可检测颗粒是如何改变细胞硬度和力学性能的。AFM在检测细胞力学方面有独特的优势,特别是胶体探针的应用使得AFM成为目前利用颗粒进行细胞力学性能测量尤其是细胞表面力学测量的主要工具。
利用胶体探针AFM,可检测细胞骨架的力学性能,从而对肌动蛋白在调节细胞的黏弹性及力学行为上的作用进行研究。Watanabe-Nakayama等[50]用粘有玻璃小球的AFM 探针,第一次定量检测了细胞对于循环拉伸和压缩的响应,结果表明,由于细胞黏弹性,细胞张力开始增加然后在1 min内减少;超过几分钟后,这种松弛度会缓慢增加,张力的恢复在几次往复施加力后逐渐消失;当细胞内的肌动蛋白被抑制后,张力的恢复也被抑制,表明这种行为是由肌动蛋白驱动的。利用胶体探针,还可比较细胞不同部分的力学性能,Babahosseini等[51]使用了粘有玻璃小球的探针比较了非浸润性人乳腺细胞(MCF-10A)和浸润性乳腺癌细胞(MDA-MB-231)内部区域的生物力学性能。他们把细胞从上到下分为三层结构:质膜和肌动蛋白层(上层)、胞质和细胞核层(中层)以及细胞核和整合素层(底层),利用广义麦克斯韦模型比较了2种细胞不同层的硬度,结果表明,无论哪种细胞越往下其硬度和黏性越大,并且发现非浸润性细胞的硬度和黏性要比浸润性细胞大。现在的AFM还可以通过联合其他先进技术(如荧光成像技术等)来拓展它的应用[52-53],这种集成多种功能的AFM可以实时检测力作用时细胞的反应。例如Shi等[54]将AFM与荧光显微镜联用,对牙周韧带细胞进行了形貌微结构表征,并利用胶体探针对细胞施加一定的力,通过荧光显微镜实时观察细胞受到力后其结构的变化与反应,最后发现该细胞具有很强的力纤维和杨氏模量,所以它能很好地抵消外力的影响。
细胞的黏弹性和力学性能也可作为疾病诊断的依据,比如癌症、关节炎、骨质疏松症和心血管病等[55]。Cross等[56]提取了肺、胰腺和乳腺癌细胞并用AFM对它们的硬度进行分析发现,癌细胞比良性的细胞都要软,说明力学性能可以作为区别癌细胞与正常细胞的一个判断依据。Nguyen等[57]通过使用微米级的球形探针,表征了良性人乳腺细胞MCF-10A和人乳腺癌上皮细胞(MCF-7)的黏弹性,结果发现,两者有明显的区别,MCF-7细胞比MCF-10A 细胞更软,经过细胞松弛素处理的MCF-10A,由于细胞骨架排列被扰乱其松弛度会增加。这与Li等[58]对细胞MCF-7和MCF-10A的研究结果一致。
胶体探针AFM 在细胞力学领域取得了许多突破性的进展,通过AFM 可以检测单个细胞和细胞膜等细胞组分的力学性能,得到包括细胞膜杨氏模量、细胞骨架和细胞核黏弹性等特征参数。利用AFM 研究力对细胞性质和功能的影响,是揭示组织、器官生物力学特性的基础,也是进一步研究细胞内生物大分子力学性能的出发点。同时,有助于深入研究细胞的生理、病理行为,为疾病的快速诊断和鉴别提供了一种有效的技术手段。
3 展望
颗粒与细胞的相互作用因为具有重要的生理意义和广泛的应用前景受到越来越多的重视,先进的颗粒制备技术提供了颗粒的多样性,检测技术的发展也使得结果更加准确可靠。AFM经过几十年的发展,已成为表征和研究活细胞的主要工具之一,特别是在力学性能测量方面,凭借其独特的检测优势,AFM成为了检测颗粒与细胞相互作用的重要工具。但AFM也有待改善的地方:首先,由于实验设备限制,现在每次实验是通过一根探针对单一目标进行测量,为了提高效率,未来可以开发多探针并行系统。其次,目前AFM主要对颗粒与细胞膜表面的相互作用进行检测,对于细胞内部的检测还存在困难,这有望通过制造更加细长的探针比如纳米针来实现[59],这种探针可以在减少损伤细胞的情况下刺入细胞内部进行操作,从而对细胞核、细胞质等进行原位力学性质测量。为了更好地研究颗粒与细胞之间的相互作用,研究者们利用光镊、磁镊等技术直接通过激光或磁场操纵颗粒进行相互作用的研究,两种技术能实现同时检测多个颗粒并可在细胞内操纵颗粒,弥补了AFM 的不足,三种技术各有优势,在研究时可以相互补充。
目前,将 AFM与其他的先进技术进行联用,比如荧光显微镜、激光共聚焦显微镜以及单分子荧光显微镜等已经成为新的研究热点,通过联用可以在获得力学性能数据的同时获得荧光图像等信息,直接观察到力学性能对细胞行为及功能的影响等,当然现在的联用技术还不太完善,未来还需要进行更多的探索工作。

