青刺果种子和油粕中的营养成分对比及酚类物质组成和抗氧化活性分析
高凡丁,张成庭,蔡圣宝
(昆明理工大学,云南省食品安全研究院,云南 昆明,650500)
自由基在人体系统中是必不可少的,适量的自由基可以维持健康和生理平衡;然而,一旦自由基没有及时清除、超出正常范围,就会攻击体内一些正常的重要分子,对一些健康细胞造成损伤,使细胞老化、病变,甚至会增加心血管疾病、神经性退行疾病和癌症等疾病的发病率[1-2]。因此,现在许多研究都致力于寻找天然抗氧化剂来清除体内过量的自由基。
青刺果是一种多年生的木本油料植物,大多数生长在中国和北印度高原地区,属于特色经济作物,也是被广泛使用的一种食疗药物。其解毒、抗炎的特性,可缓解肛门及牙龈相关的疾病。此外,青刺果的嫩茎和叶都可以食用,一些少数民族还将青刺果视为“吉祥物”或“花之王”[3]。由于青刺果的种子经常被用来榨油,因此,目前青刺果的相关报道主要集中在对其果油的研究。青刺果油在市场上已经开始大规模生产及销售,食用青刺果果油能减轻肌肉和身体疼痛,并能够预防一些疾病的发生[4],所以青刺果正逐渐引起我们的重视。但目前对青刺果种子的研究仍然较少,特别是对其营养成分、酚类物质组成及含量和抗氧化活性等方面的研究仍不够全面。油粕是种子提取油后的副产品,少有人关注,目前报道的只有青刺果油粕提取物抗菌作用的研究[5],而关于青刺果油粕的营养成分等相关研究未见报道,这严重限制了青刺果的开发与综合利用。
因此,本研究的目的是评估和比较青刺果种子和油粕中的营养物质、酚类成分和以及抗氧化活性,为青刺果的进一步研究和发展成为功能食品或保健品提供一定的相关数据和应用基础。
1 材料与方法
1.1 材料与试剂
青刺果的种子,购买于云南省丽江市;油粕,购自当地榨油厂。Folin Ciocalteu试剂购自默克(Darmstadt,德国);2,2 -二苯基-1-三硝基苯肼(DPPH)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、三氯乙酸(TCA)均购自Sigma(Sigma-Aldrich,上海,中国);标准氨基酸溶液均在Wako公司(日本)购买;本研究中使用的所有标准品均购自成都曼斯特生物科技有限公司(成都,中国);所用的其他化学品和溶剂均为分析纯。
1.2 原料前处理
将买来的种子和油粕冻干、粉碎,放于-20 ℃储存,以便后续进一步进行营养成分的检测。取5 g干燥后的种子和油粕干粉分别加入25 mL的80%甲醇,利用超声辅助提取30 min,然后过滤取上清;在相同条件下再重复提取2次,以确保充分提取。合并滤液,用旋转蒸发仪除去有机溶剂并浓缩,浓缩液冻干放于-20 ℃保存,用以后续总酚和总黄酮含量的测定、酚类成分分析和清除DPPH和ABTS自由基能力的实验。
1.3 总酚含量测定
用福林酚法[6]测定青刺果种子和油粕中的的总酚含量。分别取种子和油粕提取物10 mg溶于5 mL 80%甲醇作为样品溶液。然后取0.5 mL样品溶液,加入0.25 mL的福林酚试剂,静置几分钟。随后加入0.75 mL 质量浓度为200 g/L 的Na2CO3溶液,并用蒸馏水定容至5 mL。混匀后,在70 ℃水浴中孵育10 min。随后用酶标仪测定其在765 nm处的吸光值。总酚的标准曲线是以没食子酸为当量,将没食子酸稀释成5个浓度,按照以上步骤,测定反应后的吸光值并绘制标准曲线。
1.4 总黄酮含量测定
青刺果种子和油粕中总黄酮的测定方法是参照以往报道的文献并进行了细微的改动[7]。分别取种子和油粕提取物10 mg溶于20 mL 80%(体积分数)的甲醇制成样品溶液,然后取制好的样品溶液0.5 mL,先后加入2.5 mL 70% 的乙醇,0.15 mL 5% 的NaNO2以及0.15 mL 10% 的Al(NO3)3。6 min后,加入1 mL 1 mol/L的NaOH,最后加入70% 的乙醇使反应液总体积达到5 mL。混匀,室温反应30 min,用酶标仪测定500 nm处的吸光值。总黄酮的标准曲线是用芦丁作为参照物,将芦丁稀释成5个不同浓度,按照以上步骤测定并绘制标准曲线。
1.5 营养物质分析
1.5.1 基本营养物质组分分析
基本营养物质组分的分析包括对青刺果种子及油粕中粗脂肪、粗蛋白和粗纤维含量的测定。参照AOAC中的方法960.39[8]测定粗脂肪含量;粗蛋白含量按照AOAC中的方法976.05[9]测定;总膳食纤维和可溶性膳食纤维按照AOAC方法985.29和AOAC方法993.19进行测定[10-11]。
1.5.2 氨基酸成分分析
参照KIM等的方法[12]对游离氨基酸进行分析。即分别取0.1 g的种子和油粕加入10 mL 5%(体积分数)的三氯乙酸(TCA)。在室温放置1 h,然后以转速n=10 000 r/min离心10 min,收集上清液,用0.45 μm的滤头过滤,滤液用于游离氨基酸分析。样品经过110 ℃、6 mol/L HCl的条件进行氨基酸水解,处理24 h后,在L-8900高速氨基酸分析仪(Hitachi,日本)进行分析,以5% 的乙醇和茚三酮溶液为流动相,游离氨基酸和水解氨基酸分别用# 2622 SC-PF和# 2622 SC-PH两种柱子进行分析。
1.5.3 脂肪酸成分分析
样品中的脂肪酸用GC-MS-QP2010仪器(岛津,日本)进行分析。采用索氏提取法对种子和油粕进行提取,首先将提取物进行甲基化,即加入300 μL己烷,700 μL 1 mol/L酸化甲醇,85 ℃的条件下水浴,待样品温度降至室温后,于-20 ℃下放置20 min后取出,再向混合液中加入375 μL 0.9% 的KCl和100 μL的正己烷。
取0.6 μL样液,使用OV-1柱(30 m×0.25 mm id)进行气相色谱分析,进样温度设为280 ℃。温度梯度为130~180 ℃,升温速度为10 ℃/min,180 ℃保持20 min;180~220 ℃,升温速度为5 ℃/min, 220 ℃保持2 min;220~250 ℃,升温速度为30 ℃/min,250 ℃保持5 min。用QP2010质谱仪进行质谱检测,氦气作为载气,进样速率为1.2 mL/min。电子碰撞电压为70 eV,检测器电压设为900 V,发射源温度200 ℃和扫描范围为m/z35~800。
1.5.4 矿物质元素分析
用AOAC中的标准[13]对样品进行矿物质元素分析,将提取物用去离子水稀释为15 mL,用火焰原子吸收光谱法进行检测(Analytikjena,novAA 400P)。
1.6 酚类物质的定性定量分析
用高分辨液质联用仪(Thermo Fisher Ultimate 3000 UHPLC system)检测青刺果种子和油粕的酚类物质组成。采用Reprospher 100 C18柱(1.8 mm×100 mm, 2 μm, Dr. Maisch, Germany),以0.1%甲酸水为流动相A,乙腈为流动相B,流动相的浓度梯度为:0~5 min, 10% B; 5~15 min, 10%~15% B; 15~25 min, 15%~35% B; 25~30 min, 35%~50% B;30~32 min, 50%~100% B。进样量为3 μL,流速为0.2 mL/min,柱温设为30 ℃。
ESI-HRMS/MS检测时使用模式为阴离子模式,扫描范围150m/z~2 000m/z。种子和油粕中酚类化合物的二级谱图信息是由Q-Exactive Orbitrap mass spectrometer (Thermo Fisher Scientific, Germany)检测器检测得到。其余质谱参数设置如下:分辨率为70 000;鞘气流速为32 L/min;辅助气体流速为8 L/min;喷射源电压为3.3 kV;S-lens射频水平为50%;辅助气体加热器温度为350 ℃;毛细管温度为320 ℃。
根据液质分析鉴定出的种子和油粕中的酚类化合物,准确称取相应或结构相似的酚类物质标准品,分别配成5个浓度梯度,然后用相同的液相液质条件进行分析,得到标品各浓度的峰面积。以标品的浓度为横坐标,峰面积为纵坐标绘制出标准曲线。然后,根据种子和油粕中各酚类物质的峰面积,进行定量分析。
1.7 DPPH自由基清除能力测定
种子和油粕对DPPH自由基的清除能力的实验参考DUDONNE等的方法[14]进行测定。用甲醇溶解提取物的干粉,并按照提取率计算,将样品浓度分别稀释为400、600、800、1 000、1 200 μg干重/mL,各取0.5 mL,分别加入2 mL 0.1 mmol/L DPPH的甲醇溶液;对照组加入0.5 mL甲醇和2 mL DPPH。混合均匀,室温放置30 min,于517 nm波长下测定吸光度。样品组和对照组均设立空白对照。
1.8 ABTS自由基清除能力测定
参照已有文献[15]对样品清除ABTS自由基的能力进行测定。ABTS工作液配置如下:取 7 mmol/L ABTS 5 mL加入88 μL 40 mmol/L的过硫化钾溶液,室温放置12~16 h,混合后用乙醇稀释,于734 nm处测定吸光值,工作液的吸光值应为0.7±0.02。样品前处理同DPPH相同,0.5 mL样品,加入ABTS工作液4 mL:对照组为0.5 mL甲醇和ABTS工作液4 mL,混匀。于734 nm处用酶标仪测定吸光值。样品组和对照组均设立空白对照。
1.9 数据分析
所有数据以平均值±标准误差表示,每组实验进行3次平行。采用Turkey单因素方差分析(P<0.05)。所有数据均用Origin 8.5(OriginLab, MA, USA)进行数据处理。
2 结果与分析
2.1 青刺果种子和油粕中总酚总黄酮含量
青刺果种子和油粕酚类物质的提取率如表1所示,油粕的提取率略高于种子,但没有显著性差异(P>0.05)。根据提取物得率,青刺果种子和油粕的总酚和总黄酮含量以原料干重表示并进行比较分析,结果如表1所示。

表1 青刺果种子和油粕中总酚总黄酮含量(n=3)Table 1 Total phenolic and flavonoids contents in seeds and pomace of Prinsepia utilis Royle(n=3)
注:结果是以原料(种子或油粕)干重计,并且数值均带有SD值。表中的不同字母表示显著差异(P<0.05)。
从表1可知,种子中的总酚含量显著高于油粕(P<0.05),这可能是由于榨油过程中种子中的一些酚类物质发生了氧化分解,或是一些极性较低的酚类物质在榨油后溶于油中所致。有研究发现,橄榄在经过榨油加工后,其油粕的总酚含量比橄榄中下降了约73%[16]。植物果实或种子往往富含酚类物质,对高生灌木的浆果CoriandrumsativumL.种子的研究发现其总酚含量为410 mg/100g干重[17],这与青刺果种子中总酚的含量相当。但是,SURVESWARAN等[18]研究了133个植物样本的总酚含量,如大蒜种子(150 mg/100 g干重)、鹰叶刺种子(130 mg/100 g干重) 和黄瓜种子中(70 mg/100 g干重),这些植物中的总酚含量均低于青刺果种子和油粕。种子中的总黄酮含量也显著高于油粕(P<0.05),其原因可能与总酚含量变化相同。种子和油粕中总黄酮含量与生姜的叶子和根茎中的含量相近[19]。有报道研究番茄中总黄酮的含量为80 mg/100 g干重[20],而本研究中青刺果种子的总黄酮含量比其高了5倍多。当前的研究结果说明青刺果种子和油粕的酚类物质含量较为丰富,可以作为膳食酚类物质的良好来源。
2.2 营养物质分析结果
2.2.1 基本营养物质组分分析结果
青刺果种子和油粕中粗脂肪、粗蛋白和膳食纤维的含量如表2所示。

表2 青刺果种子和油粕中粗脂肪、粗蛋白和膳食纤维含量(n=3) 单位:g/100 g干重Table 2 Crude fat, protein, and fiber contents in seeds and pomace of Prinsepia utilis Royle in seeds and pomace(n=3)
注:结果均带有SD值并且结果是以干重计。列中的不同字母表示显著差异(P<0.05)。
2.2.2 氨基酸组成成分结果
表3表示种子和油粕中氨基酸的组成。由表3可知,比起种子,油粕中含有更多的游离氨基酸,这可能是炼油的过程造成的。种子和油粕中都没有检测到色氨酸、天冬酰胺、谷氨酰胺和脯氨酸。在这些游离氨基酸中,精氨酸的含量在种子中占了一半,油粕中含量最高的是谷氨酸。水解之后的氨基酸组成如表4所示,水解之后在种子和油粕中都检测到了包括脯氨酸在内的17种氨基酸,包括除色氨酸外的,人体和动物自身所不能合成的8种必需氨基酸[26]。天冬酰胺和亮氨酸的含量在水解之后都增加了。种子中天冬酰胺和精氨酸的含量最高,甲硫氨酸含量最低,油粕中谷氨酸含量最高的,甲硫氨酸的含量同样最低(P<0.05)。
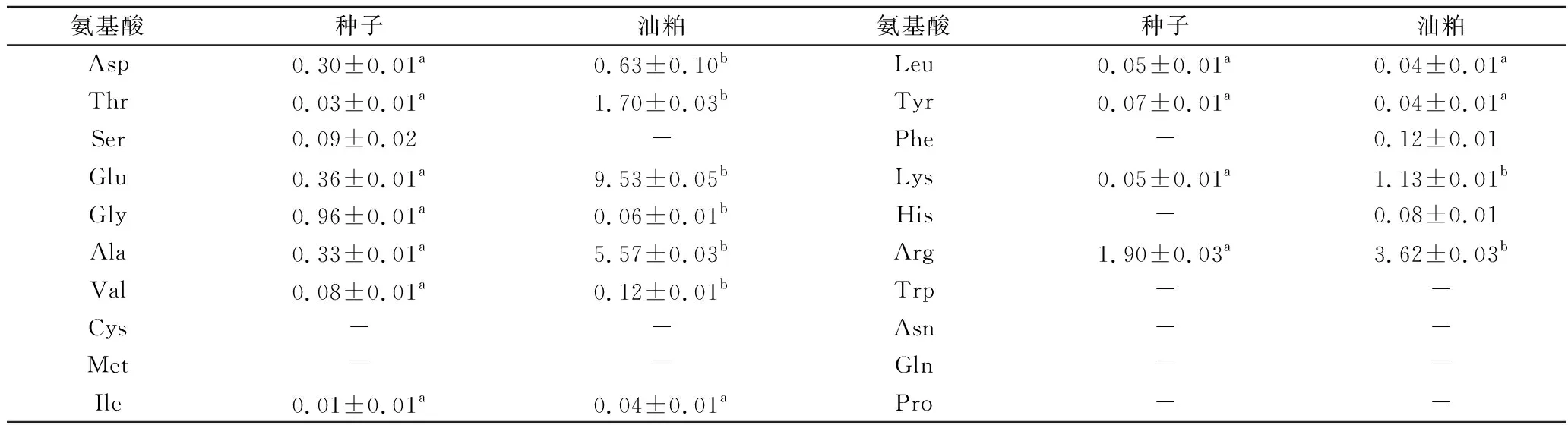
表3 青刺果种子和油粕中游离氨基酸含量(n=3) 单位:g/100 g干重Table 3 Free amino acid in seeds and pomace of Prinsepia utilis Royle (n=3)
注:结果均带有SD值并且结果是以干重计。种子和油粕中的不同字母表示显著差异(P<0.05)。
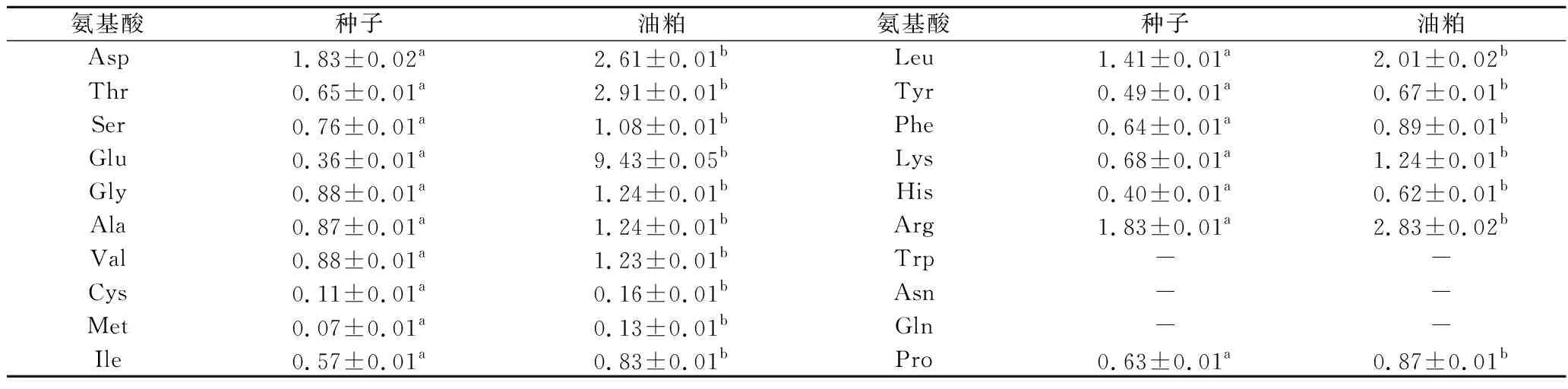
表4 青刺果种子和油粕中水解氨基酸含量(n=3) 单位:g/100 g干重Table 4 Hydrolytic amino acid in seeds and pomace of Prinsepia utilis Royle (n=3)
注:结果均带有SD值并且结果是以干重计。种子和油粕中的不同字母表示显著差异(P<0.05)。
2.2.3 脂肪酸含量结果
青刺果种子和油粕中脂肪酸组成的结果如表5所示,共检测出了14种脂肪酸,包括7种不饱和脂肪酸。不饱和脂肪酸对人体具有重要的生理功能,尤其是亚麻酸和亚油酸。而在青刺果的种子和油粕中也检出了有较多的不饱和脂肪酸,如油酸和亚油酸。种子中C18∶0的含量几乎等于椰子油中的含量(2 g/100g干重),而C16∶0含量与花生油中的含量接近(6 g/100g干重)[27]。说明青刺果种子和油粕含有比较丰富的脂肪酸。
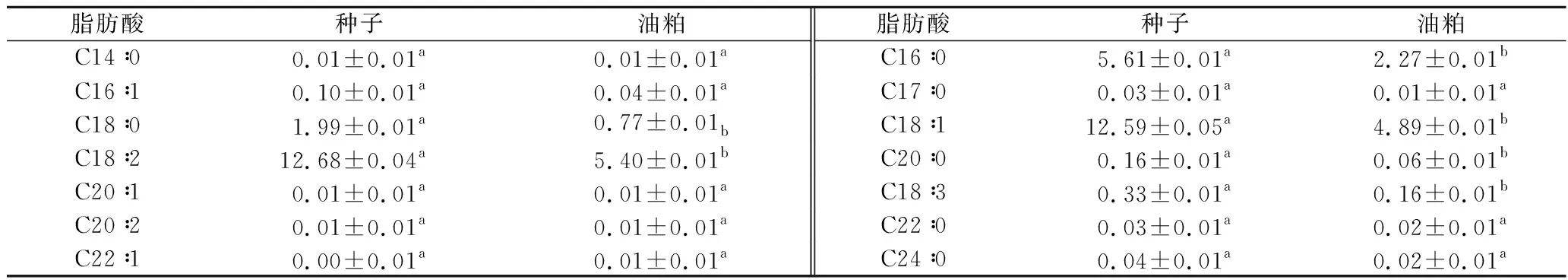
表5 青刺果种子和油粕中脂肪酸含量(n=3) 单位:g/100 g干重Table 5 Fatty acid composition in seeds and pomace of Prinsepia utilis Royle (n=3)
注:结果均带有SD值并且结果是以干重计。种子和油粕中的不同字母表示显著差异(P<0.05)。
2.2.4 矿物质含量检测结果
青刺果种子和油粕中的矿物质含量如表6所示。在矿物质含量的分析中,一共检测出了6种元素,其中钾和钙含量最高,锌元素的含量最低(P<0.05)。过量的氯化钠摄入或由于不良饮食引起的钾/钠比值过低都会引起高血压,而实验发现青刺果种子和油粕的钾/钠分别为2.94和3.06,与水果和蔬菜以及人类健康的膳食标准一致(钾/钠比>2)。钙是骨骼生长、肌肉和神经功能的重要元素,而青刺果种子和油粕中含有较多的钙元素,其含量分别为384.6和553.2 mg/100 g,甚至显著高于原鳟鱼(632 mg/kg)[28]中钙的含量。二价镁离子是许多酶活性的辅助因子,青刺果种子和油粕中也含有大量的镁,其含量与草莓中的镁含量相近[29]。矿物质含量分析表明,青刺果的种子和油粕可以作为一个很好的矿物质元素的来源。

表6 青刺果种子和油粕中矿物质含量(n=3) 单位:g/100 g干重Table 6 Mineral contents in seeds and pomace of Prinsepia utilis Royle (n=3)
注:结果均带有SD值并且结果是以干重计。列中的不同字母表示显著差异(P<0.05)。
2.3 青刺果种子和油粕中酚类物质定性定量结果
采用高分辨液相质谱联用技术对青刺果种子和油粕中酚类化合物的性质进行分析。青刺果种子和油粕液质分析的总离子流图如图1所示。
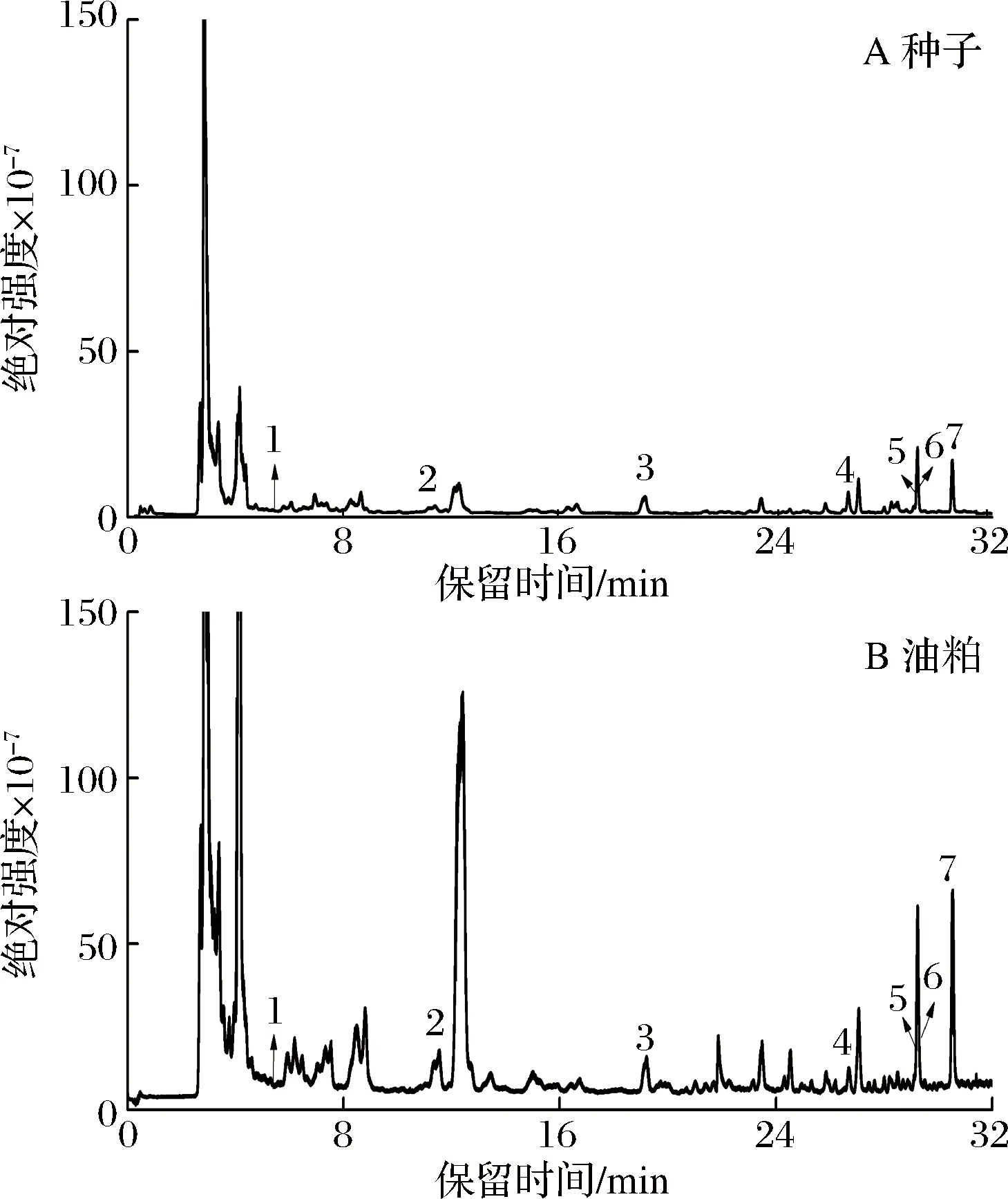
图1 青刺果种子和油粕的总离子流图Fig.1 The total ion chromatogram of seeds and pomace of Prinsepia utilis Royle
其酚类物质的定性定量结果如表7所示。种子和油粕中共检测出7种相同的酚类物质,其中原儿茶酸([M-H]-=m/z153.018 0)为酚酸类化合物,其余6种均为黄酮类化合物。水仙苷又名异鼠李素-3-O-芸香糖苷,失去芸香糖苷其二级特征产物离子为m/z315.051 0,山奈酚-7-O-葡萄糖苷和芦丁的二级特征产物离子分别为m/z284.031 8和300.026 9,这也是由于失去相关糖苷部分所致。原儿茶酸的二级为[M-CHO2]-m/z128.020 1,槲皮素的特征离子为[M-C8H6O3]-m/z151.002 2,而芹菜素和圣草酚的二级碎片均是[M-C7H4O4]-,其碎片分子质量分别为m/z117.033 0和m/z135.043 7。对这7种酚类物质的定量结果表明(表7),种子和油粕之间的含量存在显著差异(P<0.05),其中山奈酚-7-O-葡萄糖苷和芹菜素在种子中的含量高于油粕,其而他5种酚类物质的含量,油粕要高于种子。但总的来说,水仙苷在种子和油粕中的含量都较高。
2.4 抗氧化性结果分析
青刺果种子和油粕对DPPH自由基清除结果如图2-A所示。其对DPPH自由基的清除能力随着样品浓度的增加而增强。相同浓度下,种子清除DPPH自由基的能力显著高于油粕(P<0.05)。青刺果种子和油粕对DPPH自由基清除的IC50值分别为871.31和1 131.98 μg原料干重/mL。在同一反应体系下,阳性对照Vc清除DPPH自由基的IC50值为3.41 μg/mL。青刺果种子和油粕对ABTS自由基清除能力如图2-B所示,ABTS自由基清除率也与样品浓度呈现一定的剂量效应。结果表明,种子与油粕对ABTS自由基的清除能力存在显著差异(P<0.05)。在相同浓度下,种子清除ABTS自由基的能力显著强于油粕。在1 200 μg原料干重/mL时,种子和油粕对ABTS自由基清除率分别为94.27%和55.07%。其IC50值分别为496.86和1 100.92 μg原料干重/mL,阳性对照Vc清除ABTS自由基的IC50值为3.47 μg/mL。种子和油粕对ABTS自由基清除率的IC50值低于其清除DPPH自由基的IC50值,特别是种子,几乎少了一半,这表明相较于清除DPPH自由基,种子和油粕可能有更强的清除ABTS自由基的能力。总体来看,青刺果种子的抗氧化能力(包括对DPPH和ABTS自由基的清除能力)强于其油粕,推测可能是由于在榨油的加工过程中一些加工因素导致种子中的还原性物质发生氧化分解,使其抗氧化能力减弱,正如表1所示,油粕中的总酚总黄酮含量均显著少于青刺果种子。
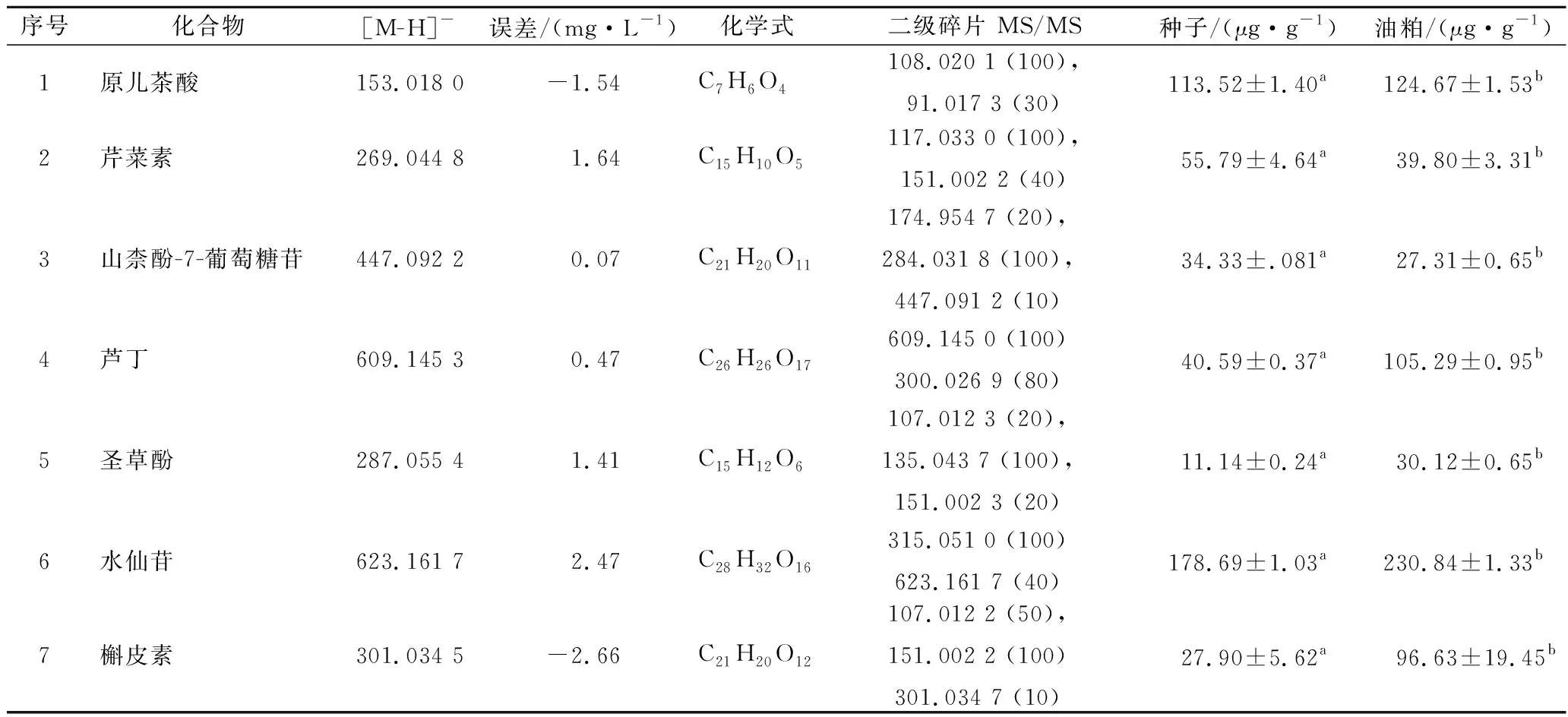
表7 青刺果种子和油粕中多酚类物质定性定量结果* (n = 3)Table 7 Phenolic compositions detected and characterized in seeds and pomace of Prinsepia utilis Royle*
注:*所有分类物质用标准品鉴定,序号按出峰时间排列,如图1所示;数据以原料(种子或油粕)干重计,表示为平均值±SD值;每行中的不同字母表示存在显著差异(P<0.05)。
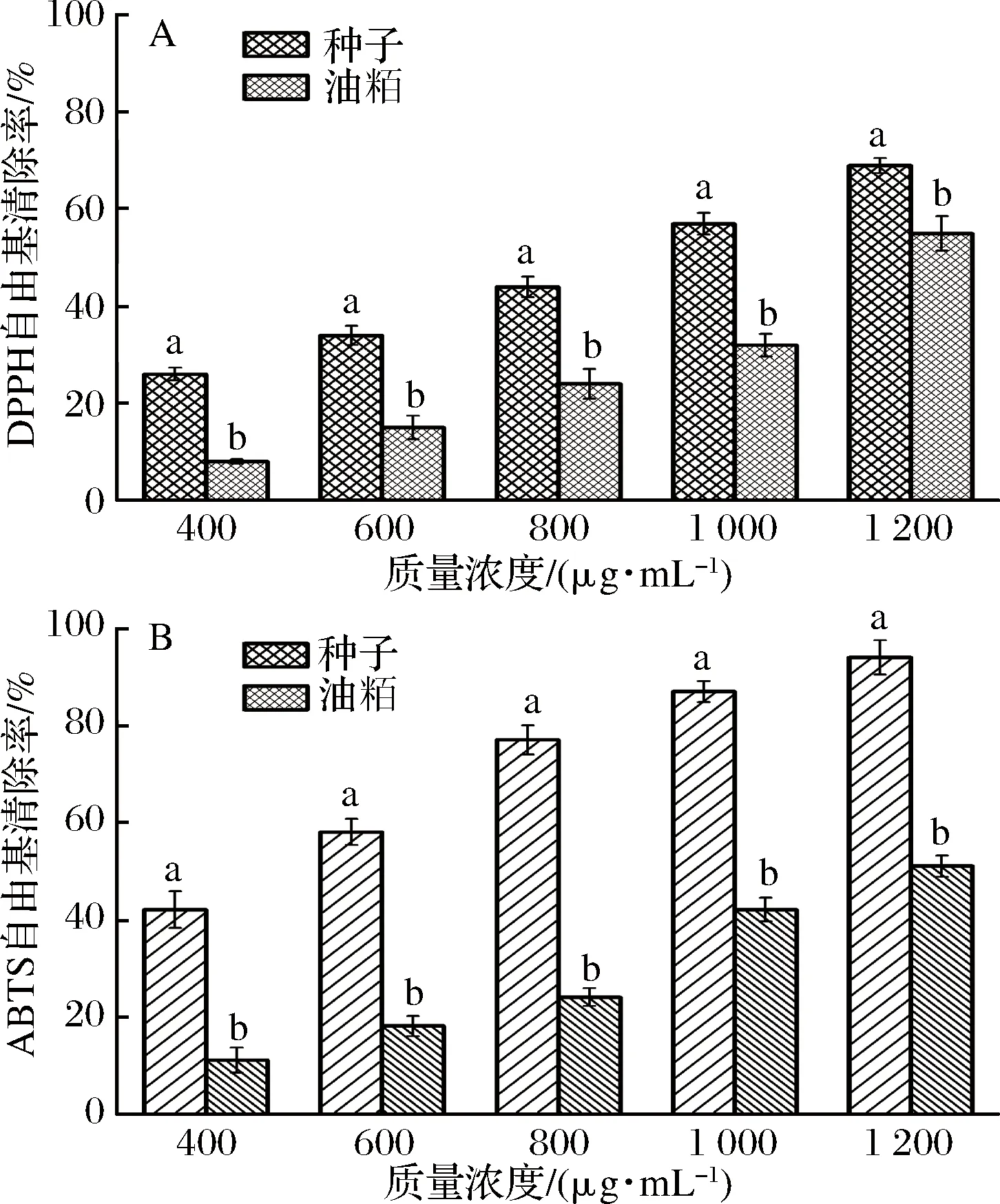
图2 青刺果种子和油粕对DPPH自由基清除率(A)和ABTS自由基的清除率(B)Fig.2 DPPH radical scavenging ratio (A) and ABTS radical scavenging ratio (B) of seeds and pomace of Prinsepia utilis Royle注:结果均带有SD值并且结果是以干重计。同一浓度下不同字母表示显著性差异(P<0.05)。
GOLDSMITH等[16]研究了橄榄在榨油过程中酚类物质的变化,发现榨油过程中橄榄的酚类物质及抗氧化能力均出现下降。刘琴等[30]对油菜籽多酚在加工过程中变化的研究也发现,高温榨油会导致其抗氧化能力显著下降。抗氧化活性结果表明,青刺果种子和油粕都具有良好的清除自由基的能力,可能有助于减少氧化应激相关疾病的发病率。另外,通过总酚含量和抗氧化数据分析,可以看出,随着酚类物质浓度的升高,其抗氧化能力加强,呈现量效关系,推测可能是酚类物质在样品抗氧化中发挥重要作用。
3 结论
在本次研究中,研究了青刺果种子和油粕中的营养成分、酚类物质组成及其抗氧化活性。青刺果种子和油粕的总酚总黄酮含量存在显著差异。种子中的总酚总黄酮相对于油粕含量较高。营养成分的分析结果表明,种子中粗脂肪含量明显高于油粕,而粗蛋白,总膳食纤维和可溶性膳食纤维的含量在种子榨油后显著增加,尤其是总膳食纤维的含量提升最为明显。种子和油粕中还含有丰富的氨基酸,包括12种游离氨基酸和17种水解氨基酸。在青刺果种子和油粕中均检出了14种脂肪酸,含量最高的为油酸和亚油酸。在种子和油粕中还检出了6种矿物质元素,其中钾和钙含量最高。此外,在种子和油粕中检出了7种酚类物质,其中水仙苷是主要的酚类化合物。青刺果的种子和油粕都具有较强的清除自由基的能力,种子和油粕对DPPH自由基清除的IC50值分别为871.31、1 131.98 μg原料干重/mL,而对ABTS自由基清除的IC50值分别为496.86、1 100.92 μg原料干重/mL。总的来说,青刺果种子和油粕中均含有较多的营养物质,并具有较强的清除自由基的能力,说明了青刺果种子作为营养食品和功能性食品原材料的可能性;同时也为青刺果油粕的进一步回收利用提供理论基础。

