豌豆低聚肽硒螯合物的稳定性研究
秦修远,刘文颖,张静波,朱少新,鲁军,谷瑞增,蔡木易*,张春乐*
1(中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京,100015)2(广东中食营科生物科技有限公司,广东 东莞,523122)
硒作为人体必须从外界摄入的微量元素之一,对于维持人的生命活动发挥着重要的作用。已有研究表明缺硒会导致人免疫力低下[1]。上世纪60年代,人们发现克山病的产生与缺硒有关[2]。目前常用的动物补硒方法有口服亚硒酸钠,或在饲料中添加富硒酵母等[3-5]。但研究表明,有机态的硒比无机态的硒毒性更小,并且对于机体来说有更高的吸收率[5]。
豌豆低聚肽是豌豆蛋白酶解后得到的小分子肽物质。过去的代谢模型指出,生物机体不能够直接吸收和利用蛋白质大分子。只有经过水解后得到氨基酸小分子才能在体内发挥作用。但近年来研究表明,动物对蛋白质的需要也依赖于一定数量的小分子活性小肽[6]。已有报道指出豌豆低聚肽具有抗菌[7]、抗氧化[8]、ACE抑制[9]等活性,是一种常见的生物活性肽。
豌豆低聚肽硒螯合物是一种将无机硒转化为有机硒的新型补硒制品。已有前人研制出大豆肽硒螯合物[10]、灵芝肽硒螯合物[11]、鱼头蛋白肽硒螯合物[12]。但有关豌豆低聚肽与硒螯合却鲜有报道。本文以分子质量分布和硒含量为指标,探究豌豆低聚肽硒螯合物对温度、pH和消化方式的稳定性,为最终其在保健品市场中的应用提供理论依据。
1 材料和方法
1.1 材料和仪器
1.1.1 材料
豌豆低聚肽,广东中食营科生物科技有限公司(1407WDSC001);五水亚硒酸钠(分析纯),天津市大茂化学试剂厂;3′3-二氨基联苯胺(DAB 4HCl)(试剂级)、乙二胺四乙酸二钠(EDTA-2Na)(生物技术级)、Biotopped Amresco;氢溴酸(分析纯),天津市福晨化学试剂厂;其他常规试剂(分析纯),北京化工厂;胃蛋白酶、胰蛋白酶,南宁庞博生物有限公司;三氟乙酸(分析纯),Alfa Aesar公司;乙腈(色谱纯),Fisher公司;透析袋(截留分子质量8 000~14 000 u),Biotopped;超纯水,实验室自制。
1.1.2 仪器
EL20 pH计,Mettler Toledo;KQ-250E超声波振荡器,昆山市超声仪器有限公司;1204007恒温水浴锅,苏州珀西瓦尔实验设备有限公司;酶标仪,Dynex Spectra Mr;DHG-9075A电热恒温鼓风干燥箱,北京陆希科技有限公司;万用电炉,北京科伟永兴仪器有限公司;LC-20AD型高效液相色谱仪,日本岛津公司;F30200150 凯氏定氮仪,Velp Scientifica公司。
1.2 实验方法
1.2.1 豌豆低聚肽硒螯合物的制备
取5 g豌豆低聚肽溶于100 mL超纯水中,制备成5%的豌豆低聚肽水溶液。加入2.5 g五水亚硒酸钠,于超声波振荡器中充分混合片刻。调节pH为9.0,在恒温水浴80 ℃条件下螯合30 min。趁热迅速倒入约4倍体积的95%乙醇。封口后静置过夜。将上清液倒出,于35 ℃恒温鼓风干燥箱中烘干,得到豌豆低聚肽硒螯合物样品。
1.2.2 豌豆低聚肽硒螯合物得率和螯合率计算公式

(1)
其中:m1,螯合物中硒元素的质量;m2,加入螯合体系硒元素的质量。

(2)
其中:m3,螯合产物质量;m4,加入螯合体系总物质的质量。
1.2.3 豌豆低聚肽硒螯合物的分子质量分布测定
采用高效凝胶过滤色谱法测定样品分子质量。选用乙氨酸-乙氨酸-乙氨酸(分子质量为189 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量为451 Da)、杆菌酶(分子质量为1 450 Da)、抑肽酶(分子质量为6 500 Da)、细胞色素C(分子质量为12 500 Da)5种肽标准品分别配制浓度为0. 1%溶液,选用聚四氟乙烯(孔径为0.2 μm)过滤膜,将样品过滤后再进样。经高效凝胶色谱过滤后可绘制相对分子质量校正曲线。
流动相体积比为V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1,进样体积: 10 μL;流速: 0.5 mL /min;柱温度:20 ℃,检测波长: 220 nm。利用紫外检测器和GPC软件进行采集和处理数据。将样品测得的数据代入相对分子质量校正曲线方程中可得到样品的肽分子质量和分布情况。用峰面积归一化法可计算得不同分子质量范围肽的相对百分比。
1.2.4 豌豆低聚肽硒螯合物指标的测定
配制1μg/mL的硒标准溶液,精确量取0.0、2.0、4.0、6.0、8.0、10.0 mL硒标准溶液,以超纯水加至10 mL。加10 mL混酸(V(硝酸)∶V(高氯酸)=4∶1)电加热炉上消解至澄清淡黄色状态。添加5 mL 1∶1盐酸,电加热炉上继续消解至1 mL。后加入10 mL EDTA-2Na溶液,10 mL 10%盐酸羟胺溶液,混合后以1∶1盐酸调节pH值为2~3。然后加入质量浓度为0.5%的DAB溶液,遮光静置30 min。以40%NaOH调节溶液pH至6.8~7.0,以10 mL甲苯萃取反应产物。取有机层溶液,在420 nm处检测吸光值。以硒浓度为横坐标,以吸光值为纵坐标,绘制硒标准曲线。
将经过不同的温度、pH值和消化方式处理后的豌豆低聚肽硒螯合物分别取3 mL转移至透析袋。经60 h透析后,采用上述方法进行消解和检测吸光度,对应标准曲线,确定样品硒含量。
1.2.5 豌豆低聚肽硒螯合基础物理化性质的测定
参照国标法GB 5009.3—2010,测定豌豆低聚肽硒螯合物的水分含量。参照国标法GB 5009.5—2010 测定豌豆低聚肽硒螯合物的总氮(蛋白质)含量。参照国标法GB 22729—2008,测定豌豆低聚肽硒螯合物中酸溶蛋白的含量。
1.2.6 热稳定性实验
将豌豆低聚肽硒螯合物样品溶于超纯水,配制成浓度为3 mg/mL的溶液,取20 mL溶液置于离心管中,分别在25、40、60、80、100 ℃下恒温水浴2 h,其中25 ℃为室温对照组。后冷却至室温,检测其分子质量分布,经透析60 h后检测硒含量。
1.2.7 酸碱稳定性实验
将豌豆低聚肽硒螯合物样品溶于超纯水,配制成浓度为3 mg /mL的溶液,取20 mL溶液置于离心管中,分别用1 mol /L HCl和1 mol /L NaOH调节各管pH至3、5、7、9,11于37 ℃恒温水浴锅中放置2 h,同时设置一未处理的对照组,后冷却至室温,检测其分子质量分布,经透析60 h后检测硒含量。
1.2.8 体外模拟胃肠消化道实验
1.2.8.1 胃蛋白酶消化实验
将豌豆低聚肽硒螯合物样品溶于超纯水,配制成浓度为3 mg/mL的溶液,取30 mL溶液置于离心管中。以1 mol/L HCl调节溶液pH=2.0,在37℃恒温水浴中孵育20 min。后添加0.6%(物料比,质量分数)的胃蛋白酶,充分混匀,迅速取出其中15 mL于沸水浴中处理20 min以终止酶解反应,作为消化前对照。剩余部分置于37 ℃恒温水浴中处理4 h,然后于沸水浴中处理20 min以终止酶解反应。室温下冷却后检测其分子质量分布,透析60 h后检测硒含量。
1.2.8.2 胰蛋白酶消化实验
将豌豆低聚肽硒螯合物样品溶于超纯水,配制成浓度为3 mg/mL的溶液,取30mL溶液置于离心管中。以10% NaOH调节溶液pH=7.5,在37 ℃恒温水浴中孵育20 min。添加0.2%(物料比,质量分数)的胰蛋白酶,充分混匀,迅速取出其中15 mL于沸水浴中处理20 min以终止酶解反应,作为消化前对照。剩余部分置于37 ℃恒温水浴中处理6 h,然后于沸水浴中处理20 min以终止酶解反应。室温下冷却后检测其分子质量分布,透析60 h后检测硒含量。
1.2.8.3 先胃蛋白酶消化实验再胰蛋白酶消化实验
按照1. 2. 7. 1的方法进行胃蛋白酶消化后,用10% NaOH调节pH为7.5,在37 ℃恒温水浴锅中孵育20 min,加入0.2%(物料比,质量分数)胰蛋白酶,充分混匀,迅速取出其中15 mL于沸水浴中处理20 min以终止酶解反应,作为消化前对照。剩余部分置于37 ℃恒温水浴中处理6 h,然后于沸水浴中处理20 min以终止酶解反应。室温下冷却后检测其分子质量分布,透析60 h后检测硒含量。
1.2.9 统计学处理
采用SPSS v20 软件对实验数据进行统计学处理,数据结果采用单因素方差分析,若t检验,P<0.05,则证明有显著性差异。
2 结果与讨论
2.1 豌豆低聚肽的基础理化成分
豌豆低聚肽中总蛋白含量为88.30%,酸溶蛋白含量为84.20%,水分含量4.46%,灰分含量5.04%,游离氨基酸含量(以干基计)2.93%,水解氨基酸含量66.82%,肽含量(以干基计)81.27%。
2.2 豌豆低聚肽螯合硒产物指标和理化性质
豌豆低聚肽硒螯合物的产物螯合率为(57.23±0.36)%,得率为(27.87±0.26)%,与相似工艺的肽硒螯合物[12]相比,具有更高的硒螯合率。已有大量文献[13-14]指出,肽与某些元素螯合时,主要微量元素的离子形式与多肽中NH2+以及—COO—形成配位键,也存在少部分的物理附着。也有文献[12]具体指出肽硒螯合物的螯合机制为Se4+与—NH2配合,羧基以共价键方式也与Se形成配合。推测豌豆低聚肽硒螯合物中,由Se4+提供4d空轨道,N、O能够提供孤对电子,可分别占据空轨道形成配位键。
经检测,豌豆低聚肽硒螯合物的酸溶蛋白含量为(23.22±0.12)%,总氮含量为(23.87±0.30)%,酸溶蛋白占粗蛋白的97.28%。说明豌豆低聚肽硒螯合物中的蛋白分子质量都较低。而较低分子质量的蛋白则更利于人体吸收。
水分活度对于食品的储藏具有参考价值。经检测,豌豆低聚肽硒螯合物的水分含量为(14.17±1.12)%。此水分含量相当于含水15%~17%的小麦粉,相应的aw值是0.80~0.87,文献指出,在此范围内,大多数霉菌和葡萄球菌都可被抑制[15]。
经检测,豌豆低聚肽硒螯合物分子质量分布如表1所示。有超过76%的分子质量分布在1000 u以下,含量最高的是小于500 u的小肽,约占58.87%,此类小肽更易于在生物体内发挥作用[16]。

表1 豌豆低聚肽硒螯合物分子质量分布Table 1 Molecular weight distribution of selenium-chelating pea oligopeptide
2.3 豌豆低聚肽硒螯合物的热稳定性
豌豆低聚肽硒螯合物经过40、60、80、100 ℃处理2 h后,观察其水溶性、溶液颜色基本维持不变,经检测其分子质量分布如表2所示。分子质量在1 000 Da之下的部分所占比例都在93%左右波动,大于1 000 Da的分子质量所占比例变化低于2%。整体上看,温度的影响使得140~1 000 Da的比例增加。不同温度处理后,豌豆低聚肽硒螯合物硒含量如图1所示。与对照相比,豌豆低聚肽硒螯合物的硒含量无显著性差异(a=0.05)。说明经过不同温度处理后,螯合物的硒含量无变化,豌豆低聚肽硒螯合物具有良好的热稳定性。可能是由于豌豆低聚肽只具有蛋白质的一级结构,对温度的耐受能力较强[16]。

表2 不同温度下豌豆低聚肽硒螯合物分子质量分布Table 2 Molecular weight distribution of selenium-chelating pea oligopeptide at different temperature
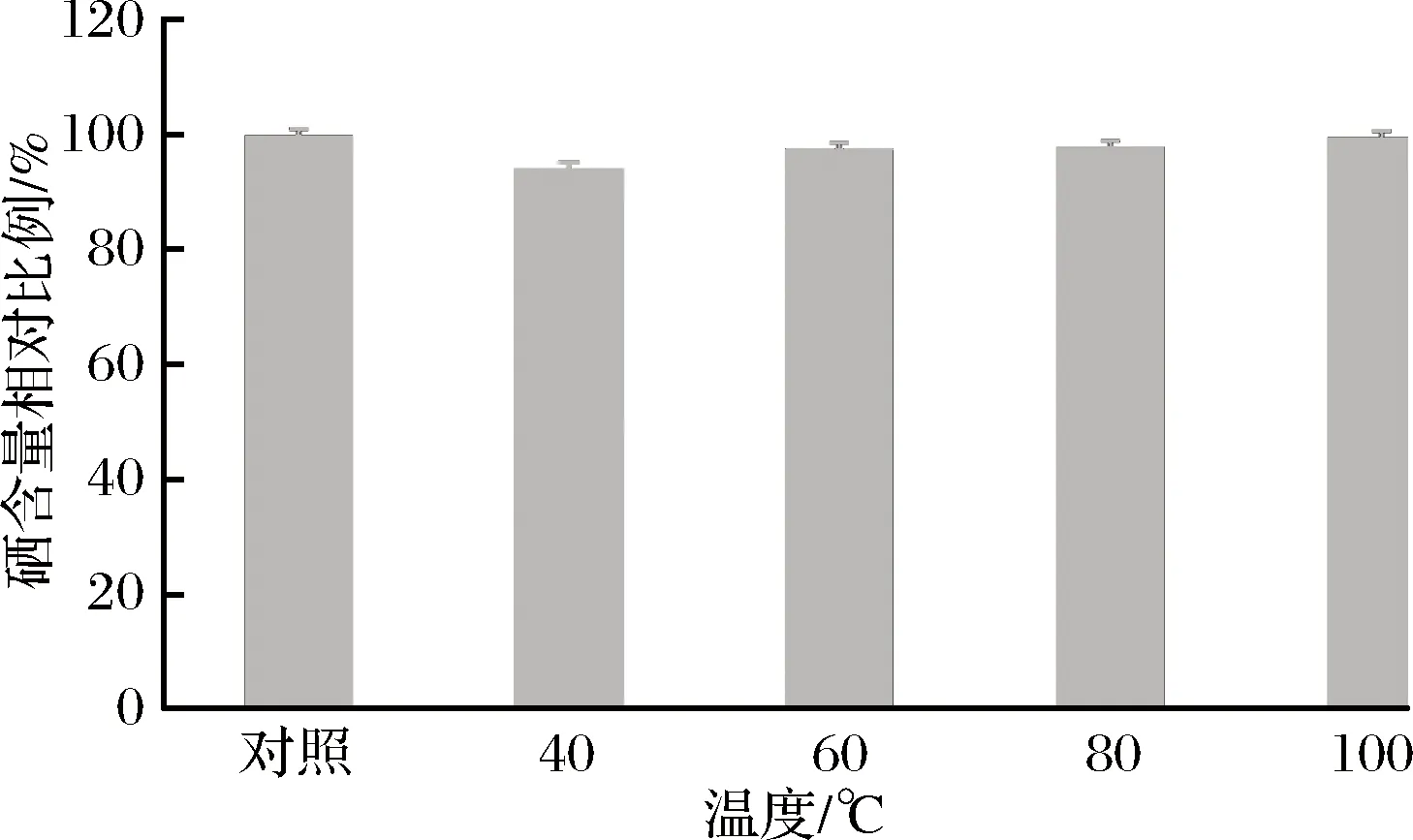
图1 不同温度下豌豆低聚肽硒螯合物硒含量(*P<0.05)Fig.1 Selenium content of selenium-chelating pea oligopeptideat different temperature (*P<0.05)
2.4 豌豆低聚肽硒螯合物的酸碱稳定性
豌豆低聚肽硒螯合物在不同pH值条件下处理后,其分子质量分布如表3所示。在中性条件下,小于140 Da分子质量所占比例增加约10%,同列变化最大。可能是此类小肽(尤其是分子质量小于500 Da)耐受酸碱环境,反而在中性条件下易断裂。分子质量在1 000 Da之下的比例变化不大,最大变化率不超过3%。可进一步证明肽链耐受酸碱环境。图2中显示了经过不同pH处理后硒含量的变化。在偏酸性和中性环境下,硒含量都显著降低(a=0.05),变化率在20%左右。在碱性环境中,硒含量变化较小。但在pH 3~11,硒含量仍在78%以上,说明豌豆低聚肽与硒螯合的产物对于酸碱环境仍具有很强的稳定性。

表3 不同pH值下豌豆低聚肽硒螯合物的分子质量分布Table 3 Molecular weight distribution of selenium-chelating pea oligopeptide at different pH
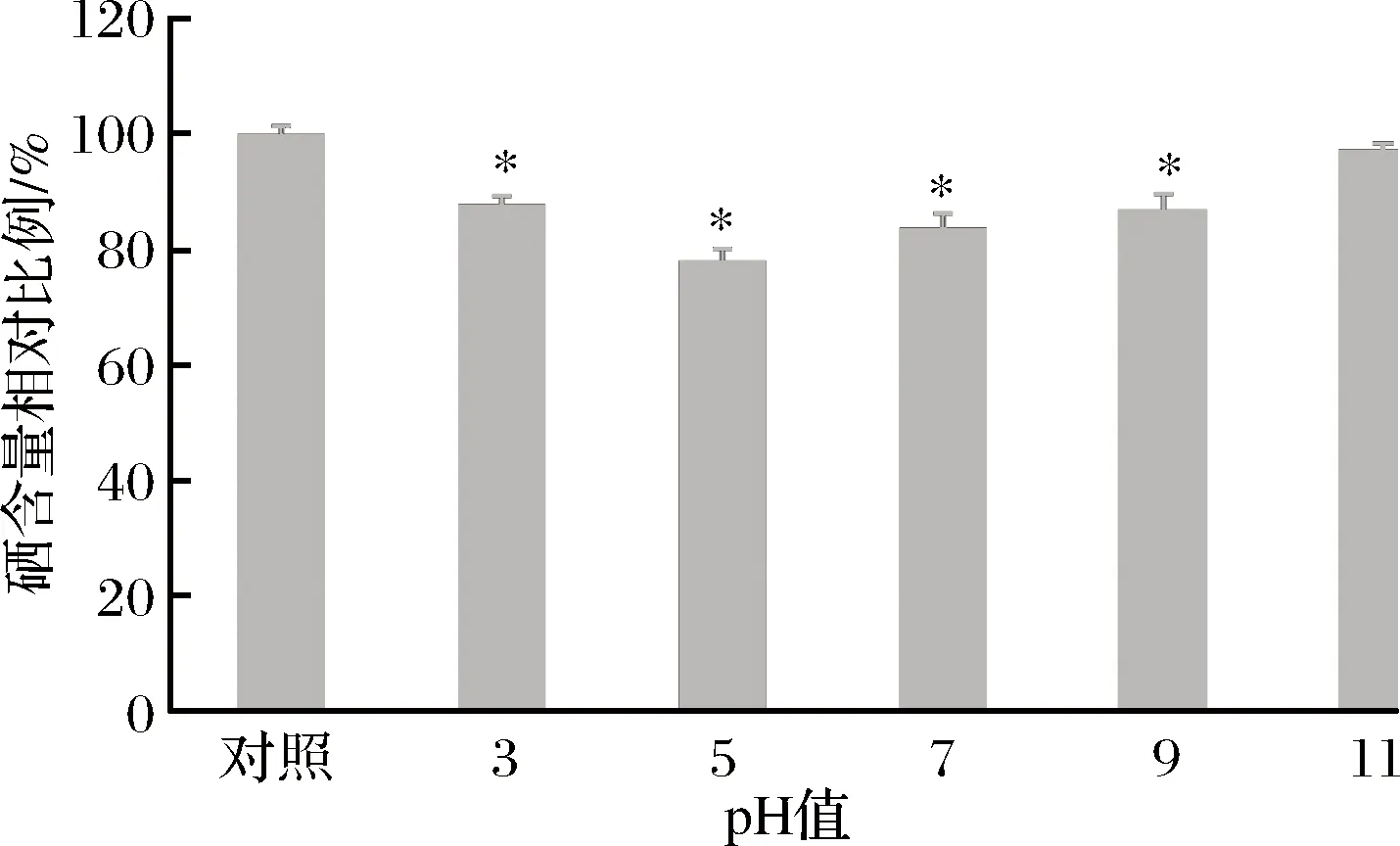
图2 不同pH下豌豆低聚肽硒螯合物硒含量(*P<0.05)Fig.2 Selenium content of selenium-chelating peaoligopeptide at different pH (*P<0.05)
2.5 豌豆低聚肽硒螯合物的体外消化稳定性
豌豆低聚肽硒螯合物分别经过胃蛋白酶、胰蛋白酶、先胃蛋白酶再胰蛋白酶处理,分子质量分布结果如表4所示。豌豆低聚肽硒螯合物经过不同的体外消化方式处理后,分子质量在1 000 Da之下的部分所占的比例增加,其中,经过胃蛋白酶处理后的增加了约7%,经胰蛋白酶处理后的增加了约9%,先胃蛋白酶处理再胰蛋白酶处理后的增加了约12%。这证明了豌豆低聚肽经过酶的消化处理,分解成更小分子质量的肽段。经过酶解后,1 000 Da以下所占的比例都在90%以上,小分子肽段,特别是二肽、三肽更利于人体吸收[17。经过不同的消化方式处理后,豌豆低聚肽硒螯合物中硒含量变化较小。结合分子质量分布的变化表,豌豆低聚肽硒螯合物在经过酶的消化后,虽然被水解成小肽段,但是并没有完全破坏硒与肽的配位结构,可以推测,豌豆低聚肽与硒的配位键较为稳定,不随肽链的断裂而破坏。则硒可随小肽段稳定的经过胃液和肠液,最后在肠道中通过小肠黏膜对肽的吸收[18-19]而被间接吸收。

表4 不同消化方式下豌豆低聚肽硒螯合物的分子质量分布Table 4 Molecular weight distribution of selenium-chelating pea oligopeptide at different digestion mode
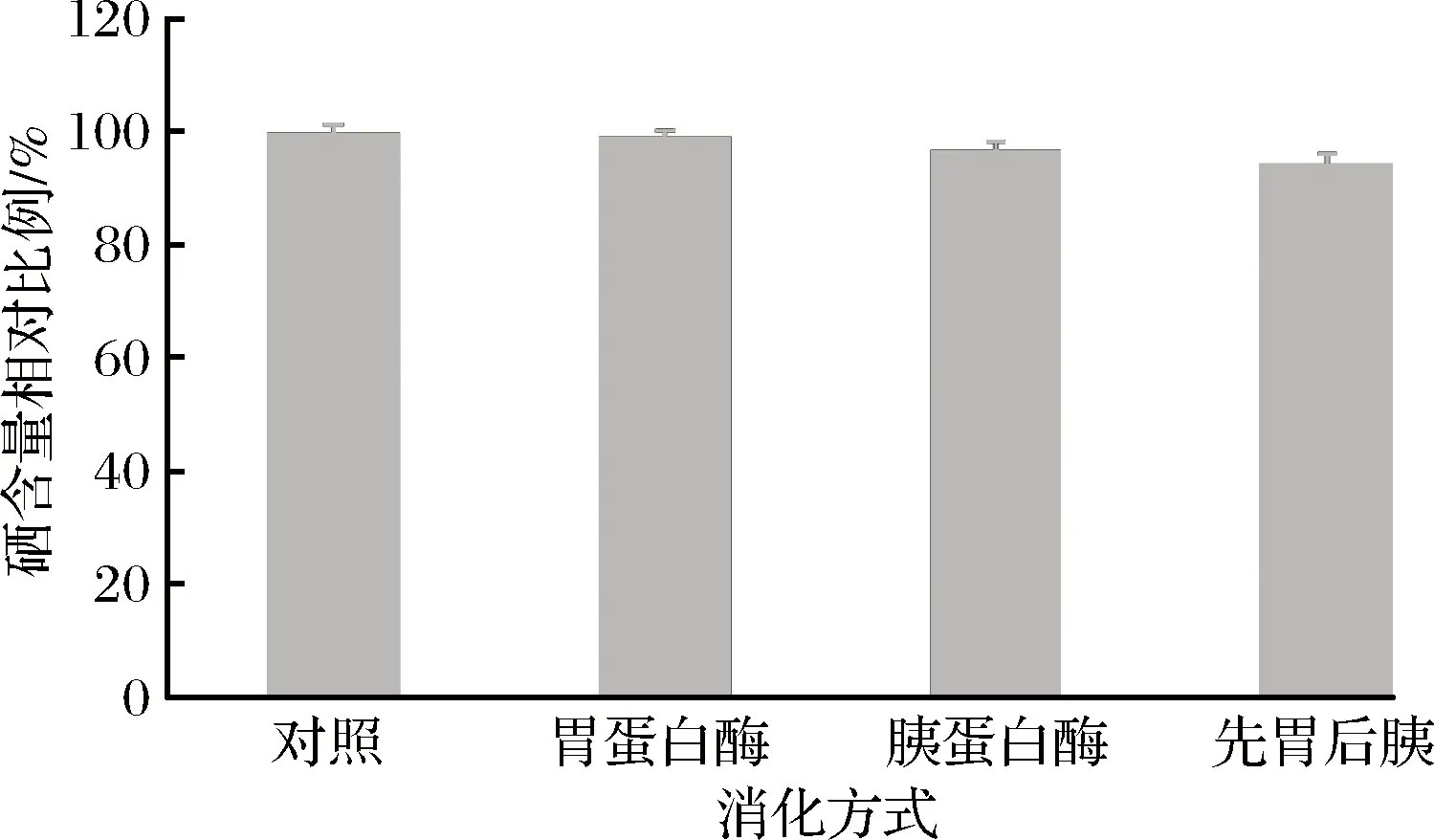
图3 不同消化方式下豌豆低聚肽硒螯合物硒含量(*P<0.05)Fig.3 Selenium content of selenium-chelating pea oligopeptideat different digestion mode (*P<0.05)
3 结论
本研究以豌豆低聚肽和亚硒酸钠为原料,制备出豌豆低聚肽硒螯合物,并对其基础理化性质、热稳定性、酸碱稳定性和消化方式稳定性进行了探究。实验结果表明,豌豆低聚肽硒螯合物水分含量为(14.17±1.12)%,水分含量较低,能够抑制大多数霉菌和葡萄球菌。酸溶蛋白含量为(23.22±0.12)%,总氮含量为(23.87±0.30)%,酸溶蛋白占粗蛋白的97.28%。分子质量分布在1 000 Da以下的占比超76%。小分子肽占比较大,利于人体吸收。
豌豆低聚肽硒螯合物对于热处理具有良好的稳定性,经过不同温度处理后,分子质量在1 000 Da以下的部分比例变化都低于2%,硒含量变化不显著。对于酸碱环境也具有稳定性,经过酸或碱处理过后,分子质量在1 000 Da以下部分的比例变化低于3%,硒含量虽有一定变化,但仍在78%以上。对于不同消化方式也具有一定的稳定性,经过酶解后,分子质量在1 000 Da以下部分的比例都在90%以上,而硒含量变化较小。硒可进入肠道,通过黏膜对肽的摄入而被间接吸收,从而达到补充硒的功效。豌豆低聚肽硒螯合物可作为一种新型的补硒制剂,开发成适用于缺硒人群的营养与功能食品。

