乙肝病毒S基因Pre-S区突变的人肝癌细胞HepG2稳定株构建及其生物学行为变化
郑羽飘,钱宝鑫,覃琴,骆莹,朱争艳,高英堂,王凤梅
(1 天津医科大学三中心临床学院,天津300170;2 天津市第三中心医院)
乙肝病毒(HBV)的慢性感染与肝细胞肝癌(简称肝癌)的发生密切相关[1],抑制HBV复制对于预防肝癌意义重大。临床研究发现,多数慢乙肝患者经过抗病毒治疗实现了HBV-DNA阴转,但如果HBsAg阳性仍将发生肝癌[2]。更多研究表明,编码HBsAg的S基因可以发生突变,而含有突变S基因的肝细胞更倾向于发生癌变[3~6]。因此,我们假设S基因Pre-S区突变是独立于HBV-DNA复制引发肝癌的风险因素。2017年12月~2018年8月,我们拟构建人肝癌细胞HepG2 HBV S基因pre-S1缺失突变及pre-S2缺失突变的稳定株,观察pre-S区缺失突变后细胞增殖及迁移能力变化,为探讨肝癌的进展机制提供参考。
1 材料与方法
1.1 主要材料 带有FLAG标签的pLVX慢病毒质粒载体(pLenti-CMV-3FLAG-PGK-Puro)以及pLVX-Pre-S/S、pLVX-Pre-S1 mut/S、pLVX-Pre-S2 mut/S的慢病毒液由上海和元公司合成构建。限制性内切酶EcoR Ⅰ及BamH Ⅰ购自Termo公司。HepG2细胞由本实验室储存,DMEM高糖培养基及特级胎牛血清购自BI公司,胰酶购自Gibco公司,Polybrene购自合生基因公司。鼠源FLAG一抗购自Sigma公司,HMP标记的羊抗鼠二抗购自Cell Signaling Technology公司,RIPA蛋白裂解液及ECL化学发光底物购自碧云天公司。
1.2 HBV S基因Pre-S区野生型及突变型设计 以NCBI数据库中JX661479.1的序列为HBV基因模板(全长3 215 bp),明确编码Pre-S/S的核苷酸序列(1 027~2 230 bp),确定Pre-S1突变及Pre-S2突变的缺失位点(Pre-S1/S:1 220~1 291 bp;Pre-S2/S:1 397~1 450 bp,G1387A),最终确定野生型Pre-S/S和突变型Pre-S1 mut/S、Pre-S2 mut/S的核苷酸序列信息。将信息提交上海和元公司,通过全基因合成获取带有EcoR Ⅰ及BamH Ⅰ酶切位点的目的片段,并构建慢病毒核心质粒及相应的慢病毒液。
1.3 重组质粒的PCR扩增、双酶切验证及Sanger测序 利用PrimeSTAR DNA Polymerase分别以构建好的重组质粒为模板行PCR扩增,PCR产物用于琼脂糖凝胶电泳,并通过凝胶成像系统检测条带;利用限制性内切酶EcoR Ⅰ及BamH Ⅰ对重组质粒进行双酶切鉴定,重组质粒交付金唯智公司测序。
1.4 HepG2细胞培养、分组、感染及稳定株筛选 将肝癌细胞HepG2接种于含10% FBS的DMEM高糖培养基(完全培养基)6孔板中,于37 ℃ 5% CO2培养箱中培养。待细胞生长至融合度约70%时,随机分为5组。空白对照组不处理,pLVX-vector组、野生型组、Pre-S1突变组、Pre-S2突变组分别感染pLVX-vector、pLVX-Pre-S/S、pLVX-Pre-S1 mut/S、pLVX-Pre-S2 mut/S慢病毒液;36 h后弃含有病毒液的完全培养基,无菌1×PBS清洗2次;更换为含2.0 μg/mL嘌呤霉素的完全培养基继续培养,筛选至空白对照组HepG2细胞全部死亡,其余各组继续加嘌呤霉素筛选48 h;于倒置显微镜下观察细胞存活情况,更换为完全培养基常规培养,筛选完毕。
1.5 HepG2细胞内FLAG-HBV-S蛋白检测 将pLVX-vector组、野生型组、Pre-S1突变组、Pre-S2突变组细胞接种到6孔板中,待细胞融合率达90%时,用RIPA裂解液冰上提取样品蛋白;离心取上清液,用BCA法测蛋白浓度,用Western blotting法检测细胞中的FLAG-HBV-S蛋白。
1.6 HepG2细胞稳定株增殖活性观察 采用克隆形成试验。取pLVX-vector组、野生型组、Pre-S1突变组、Pre-S2突变组细胞各1×103个,均匀接种于直径6 cm培养皿中,常规培养7、14 d。当出现肉眼可见的单细胞克隆点时,行结晶紫染色;于高倍显微镜下观察10个不连续视野中的克隆点个数,并计算平均值。
1.7 HepG2细胞稳定株迁移能力观察 采用细胞划痕试验。当pLVX-vector组、野生型组、Pre-S1突变组、Pre-S2突变组细胞融合率达95%时,接种于6孔板培养皿中;用10 μL的无菌白枪头在细胞表面进行划痕,PBS清洗2次,更换无血清培养基培养,分别于0、72 h用倒置显微镜观察细胞迁移情况。选取4个视野尺寸进行拍照,根据显微镜下线性距离计算相对迁移距离,相对迁移距离即72 h距离-0 h距离。重复3次实验,并计算平均值。
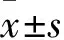
2 结果
2.1 构建重组表达质粒的验证结果 构建的pLVX-Pre-S/S、pLVX-Pre-S1 mut/S、pLVX -Pre-S2 mut/S重组表达质粒PCR产物电泳检测约为1 300 bp,与理论值(1 203、1 131、1 149 bp)相符,见图1;经EcoR Ⅰ和BamH Ⅰ双酶切后电泳检测为1 300 bp,与理论值(1 203、1 131、1 149 bp)相符,见图2;Sanger测序结果显示,pLVX-Pre-S/S碱基序列与GenBank (JX661479.1)上序列完全相同,pLVX-Pre-S1 mut/S、pLVX -Pre-S2 mut/S突变型除突变序列外,其他序列与HBV S基因野生型序列完全相同。

图1 各质粒PCR扩增目的片段
2.2 HepG2细胞稳定株FLAG-HBV S蛋白的表达 在野生型组、Pre-S1突变组、Pre-S2突变组43 kD分子量位置检测到目的条带表达,而pLVX-vector组无法检测到相应条带的表达。见图3。
2.3 HepG2细胞稳定株增殖活性比较 与pLVX-vector组同时点比较,其余各组克隆形成数增加(P均<0.05);与野生型同时点比较,Pre-S2突变组克隆形成数增加(P均<0.05)。见表1。
2.4 HepG2细胞稳定株迁移能力比较 pLVX-vector组、野生型组、Pre-S1突变组、Pre-S2突变组细胞相对迁移距离分别为(89.97±7.14)、(114.18±7.81)、(126.21±12.18)、(196.49±17.16)μm,Pre-S2突变组>野生型组、Pre-S1突变组>pLVX-vector组(P均<0.05),野生型组、Pre-S1突变组相对迁移距离差异无统计学意义。

图2 各质粒EcoR Ⅰ及BamHⅠ双酶切得到的片段

图3 各组细胞FLAG-HBV-S蛋白表达情况(Western blotting法)

组别克隆形成数(个)第7天第14天Pre-S2突变组94.67±11.55∗#205.33±31.64∗#Pre-S1突变组69.33±7.76∗148.67±13.20∗野生型组60.67±6.02∗113.67±6.03∗pLVX-vector组23.67±4.5165.33±4.73
注:与pLVX-vector组同时点比较,*P<0.05;与野生型同时点比较,#P<0.05。
3 讨论
肝癌是世界第五大恶性肿瘤性疾病,病毒性肝炎始终是肝硬化、原发性肝癌的主要病因[7]。尤其在我国,慢性HBV感染仍是导致肝癌的首位病原学因素。目前临床研究表明,抑制HBV复制对于延缓HBV相关性肝癌的发生起到非常重要的作用。但不可否认的是,尽管临床上已有众多的患者通过核苷或核苷酸类似物成功抑制HBV的复制,依然有相当一部分HBV-DNA阴性患者发生了肝恶性肿瘤,提示我们乙肝相关性肝癌的发生,还可能与HBV其他因素存在内在的联系。乙肝S基因编码HBsAg,HBsAg的阴转一直是乙肝抗病毒治疗的痛点。既往研究表明,S基因可以在Pre-S区发生缺失突变,该突变会导致HBV表面抗原大蛋白(LHBs)过度表达;LHBs可聚集于肝细胞内质网上形成毛玻璃样肝细胞(GGH),GGH与肝硬化及肝癌高度相关[8~11]。Pre-S区缺失突变包括Pre-S1缺失突变及Pre-S2缺失突变。其中,Pre-S2区包含T细胞和B细胞识别位点,因此Pre-S2突变使T细胞和B细胞表位丢失;针对Pre-S2特异性T、B细胞免疫不能产生足够的细胞因子和中和性抗体清除,导致HBV复制和疾病加重[12],进而导致HBV逃逸机体的免疫监控或减少主要组织相容性类似物的亲和力[13]。同时,Pre-S区突变可影响HBV母婴传播免疫阻断的免疫应答,从而导致免疫失败。一项对来自亚洲国家和地区的儿童肝癌样本研究发现,亚洲儿童肝癌患者中Pre-S区缺失变异率高达90%(27/30)[14]。
既往对于Pre-S区突变的研究尚不够深入,现有的认识包括Pre-S区变异可通过核因子κB和p38丝裂原活化蛋白激酶途径上调环氧化酶[15],或通过血管内皮生长因子激活蛋白激酶B (Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号等通路引起内质网应激,并通过氧化应激和DNA损伤促进基因组不稳定性,促进癌症发生[9,14]。一些横断面研究,将发生肝癌患者进行基因测序,发现与对照组相比,肝癌患者有更高的Pre-S区缺失突变;但是,此研究忽略了HBV 基本核心启动子(BCP)区A1762/T1764双突变也是公认肝癌独立危险因素。本研究在前人的研究基础上,准确设计了乙肝病毒S基因Pre-S1、Pre-S2缺失突变的突变位点,并将目的片段定向导入到慢病毒载体中,通过慢病毒感染的方式筛选获得了能够稳定过表达HBV-S蛋白的HepG2稳定株;并发现Pre-S2缺失突变的确可影响HepG2的细胞生物学行为,使HepG2获得更强的增殖及迁移能力,提示恶性细胞表型增强。
综上所述,我们成功构建了HBV Pre-S1、Pre-S2缺失突变的肝癌细胞HepG2稳定株,其中Pre-S2缺失突变的HepG2稳定株增殖活性、迁移能力更强。这为后续进一步研究Pre-S缺失突变导致肝癌发生的下游信号通路及分子机制,以及深入研究Pre-S突变导致的免疫逃逸现象等奠定了细胞学基础。

