《中国药典》与ICH Q4B检测方法差异对比评估
文/张震 徐昕怡 刘贞 通讯作者/洪小栩
一、ICH 转化实施背景
国际人用药品注册技术协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)于1990年由欧、美、日三方药品监管机构和以研发为主的国际性药企协会发起成立,旨在保证药品的安全性、有效性,实现药品注册技术要求在全球范围内更好地协调一致,以应对药品开发日益全球化的迫切需要[1]。目前,ICH 已组织制定了70 多项技术原则,被40 多个国家和地区的药品监管机构认可并转化实施,已成为药品注册领域重要的国际规则[2]。
2017年6月,中国药品监管机构正式成为ICH 成员,进一步推动了我国药品注册技术要求与国际接轨[3]。2018年6月,国家药品监督管理局当选为ICH 管理委员会成员,全面参与ICH 相关指导原则的制修订。推进ICH 指导原则在国内的转化实施,对提升我国药品注册审批技术要求与国际保持一致、提升药品批准上市准入门槛、提升我国药品研发和质量控制水平、确保人民群众用药安全性和有效性具有积极意义。
ICH 指导原则分为药品质量(Quality)、安全性(Safety)、有效性(Efficacy)和多学科类(Multidisciplinary)4 个系列。Q系列包括化工、医药、质量保证相关的44 个指导原则;S 系列包括动物实验等临床前研究相关的16 个指导原则;E 系列包括人类临床研究相关的30 个指导原则;M 系列内容交叉涉及以上分类,包括12 个指导原则和49 个其他概念文件、工作计划及相关规范性文件等[4]。ICH Q4 为药典相关技术指南,包括Q4A 药典协调和Q4B 指导原则及16 个已协调的药典检验方法(表1)。

表1 ICH Q4B 检验方法附录
Q4B 专家工作组(EWG)负责ICH Q4B 指南的制定。EWG可依据概念文件和业务计划讨论形成指导原则草案的基础内容,也可接受药典讨论工作组(Pharmacopoeia Discussion Group,PDG)、一方或两方药典机构提出的药典协调建议。EWG从协调的角度对三方药典存在的差异进行研究评价,递交指导委员会(SC)讨论并公开征求意见,最终由SC 发布实施[5]。目前ICH Q4B 所收载的附件均由PDG 提供。ICH 希望通过Q4B EWG 对药典的评价和推荐程序,促使各国和地区药品监管机构之间达成共识,使各药典在ICH Q4B 执行上统一协调和互换[6]。
ICH Q4B 所涵盖的检验方法,是有关药物安全性及有效性的重要通用性质控方法。在我国,《中国药典》是强制性标准,是药品生产经营者的基本遵循,是药品监管的准绳。在我国申请上市和上市后药品均应遵守《中国药典》收载的检验方法通则及相关技术要求。因此,ICH Q4 指导原则在中国的转化实施,需对《中国药典》与ICH Q4B 所涉方法的制定、标准适用性以及实施后对上市产品的影响等方面进行全面分析和评估,稳步推进我国药典相关方法逐步与ICH Q4B 的协调与统一。
二、差异对比和分析评估
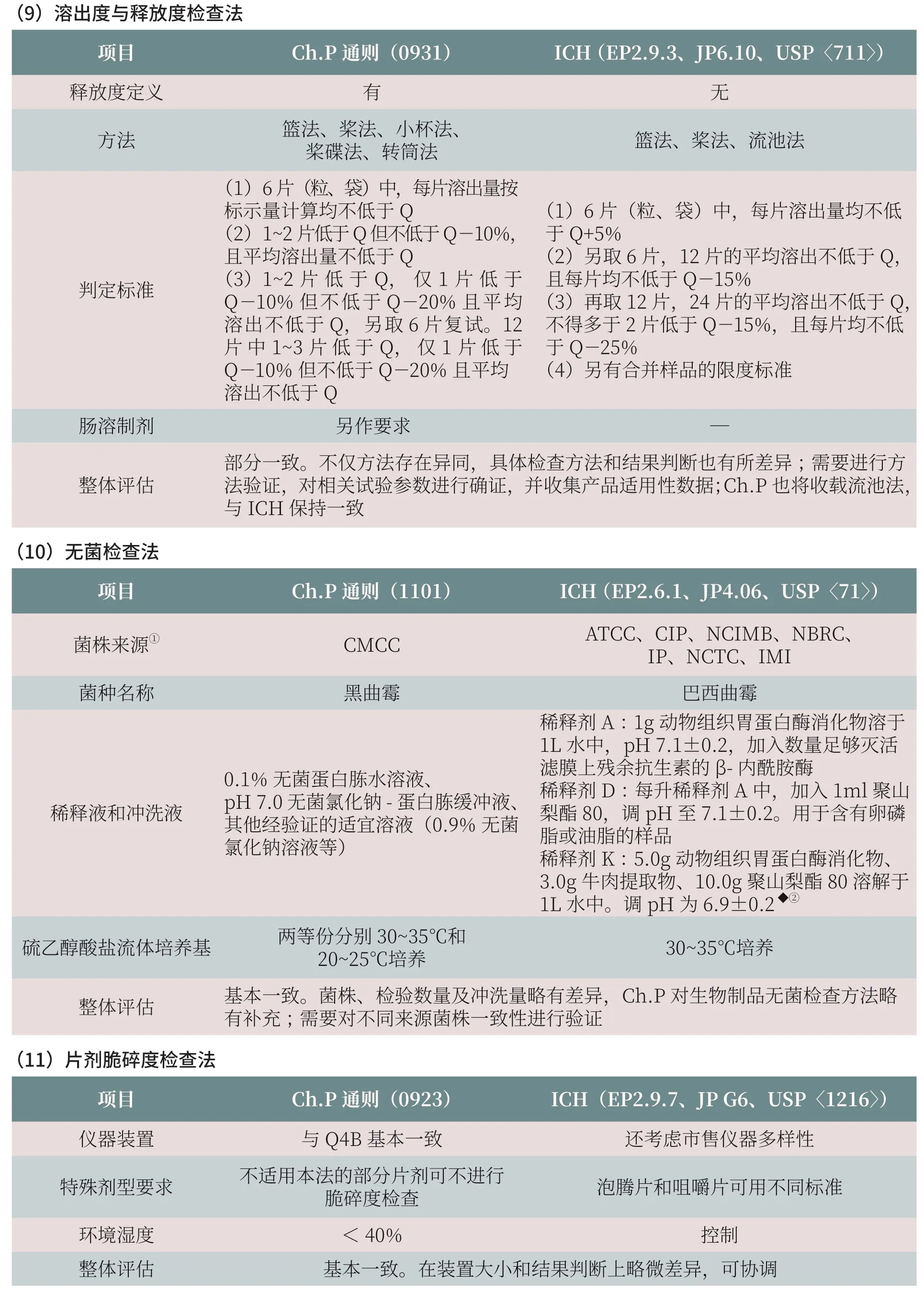
以下就《中国药典》和ICH Q4B 收载的15 个检测方法进行全面比对, 列出两者之间的主要差异,并对存在差异对标准协调的影响进行评估(表2)。
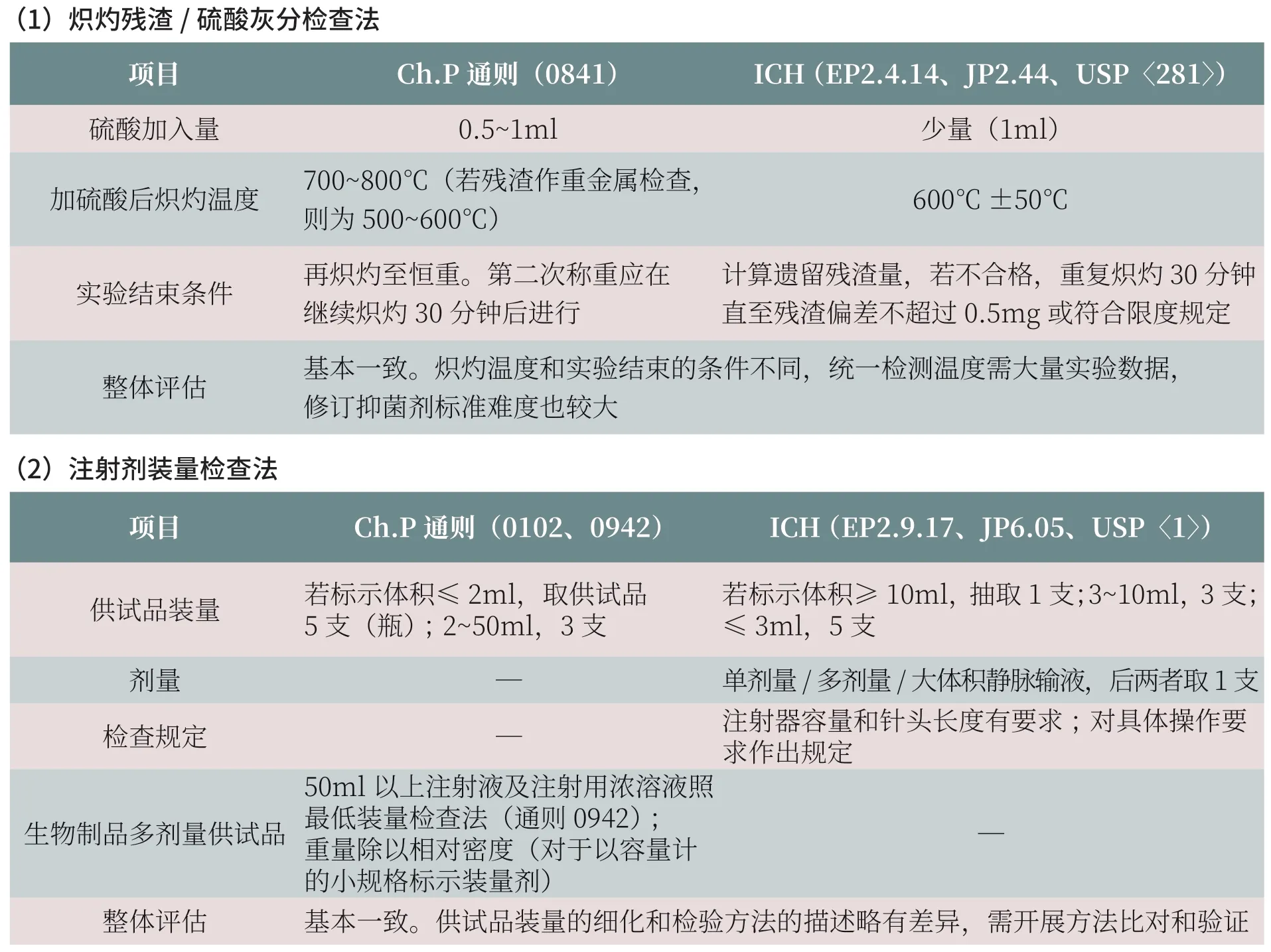
表2 Ch.P 与ICH Q4B 检验方法差异对比

续表
续表

续表

续表
历版《中国药典》制修订过程中,始终注重与国外药典收载检测方法的方法学比对研究,加强与国际通用检测方法的统一。通过对15 个检测方法的差异对比和分析评估可以看出,《中国药典》与ICH Q4B 相关检测方法的技术应用和检测要求整体趋于一致。其中,非无菌产品微生物计数法、控制菌检查法、原料药及其制剂的判定标准、无菌检查法、细菌内毒素检查法和片剂脆碎度检查法的技术要求基本一致。对于非无菌产品微生物计数法和控制菌检查法,尽管研究认为《中国药典》与ICH 规定所用的菌种CMCC 和ATCC 高度同源,但仍需通过相应的检测方法进一步评估和确证其一致性,并实现检验用控制菌互认和互换。筛分法、聚丙烯酰胺凝胶电泳法、毛细管电泳法、注射剂装量检查法、不溶性微粒检查法、崩解时限检查法在检测技术参数要求和结果判定有所差别,需要通过方法之间的检测差异比对,进一步评估检验设置参数的不同对检验结果的影响。溶出度与释放度测定法中篮法、桨法基本一致,结果判定要求稍有差异,《中国药典》2020年版拟增订流池法,该法在制定时参照了ICH Q4B 的指南,原则上与之保持一致。含量均匀度检查法具有基本相同的总体结构,但结果判定的计算判别式与统计学参数完全不同,需系统性地调整。炽灼残渣检查法的最大差异在于炽灼温度的设定,《中国药典》规定为700~800 ℃,ICH 规定为600℃±50℃,如要实现标准的统一而变更现有《中国药典》炽灼温度,势必将影响已上市药品标准的适用性。
三、协调策略
随着医药产业国际化,作为保障药品安全有效性的质量标准和控制方法,进行国际协调显得尤为重要,也是未来药品质量控制发展的必然趋势。《中国药典》标准在逐步提升的过程中,不断采纳和借鉴国际成熟的药品标准的成果和经验,同时,通过方法学验证和标准适用性研究不断推进我国药品检验方法与国际的协调和统一。ICH Q4 指南的转化实施应基于《中国药典》在国家药品标准中的法定地位,不同历史时期上市产品的适用性,我国已经形成的药品标准、产品的类别以及医药产业发展现状。根据ICH Q4A 药典协调的原则,借鉴各国药监机构转化实施ICH Q4指导原则的经验,研究制定我国ICH Q4B 相关指南转化实施的方法策略。
(一)直接采纳
对于《中国药典》尚未收载的ICH Q4B 方法,如溶出度检查法中拟收载的流池法以及堆密度和振实密度测定法,在我国药典标准制修订时,参照ICH 的相关要求进行方法学验证研究,通过直接转化收载的方式纳入药典标准,实现ICH Q4B 指导原则直接转化实施。
(二)文字规范
对于文字表述存在差异但没有本质差异的检测方法,在产生表述歧义的情况下,可结合Q4B相关内容进行规范。
(三)研究转化
对于相关参数、检验结果判定方面存在差异的检测方法,可开展方法比对研究,组织药品检定机构和药品生产企业开展更广泛的验证工作,并对上市后产品的适用性进行全面的评估,积累相关数据,待成熟后进行方法的协调统一。
(四)标注差异

美国、欧洲、日本药典在实施ICH Q4B 程中,对于难以统一的部分内容仍执行了本国药典的相关要求,另外,各国药典对已经协调后的检验方法更新的内容无法统一的,通过在内容项加注标识作为提示。《美国药典》通则编号在〈1000〉以上的,如SDS-聚丙烯酰胺凝胶色谱法〈1056〉、毛细管电泳法〈1063〉等均为指导原则,非强制执行。因此, 我国在转化实施过程中也可参考国际惯例,在整体协调的基础上,对部分难以协调或者协调后对上市后产品影响较大的,可通过加注标识的方式加以区别。
ICH Q4 的实施关键在于使用各国药典药品检验方法进行结果判定时的“可互换性”。在遵循“可互换性”的前提下,各国药典采纳ICH Q4B 指导原则时都有着本国视角的特殊考虑,增加了方法补充性说明、注意事项和仪器校准部分,充实收载内容。
(五)平行收载
可考虑建立多种方法并列收载药典,分别适用于已上市产品和新批准上市的产品,针对已上市产品的标准协调可逐步过渡。
四、小结
ICH Q4 的实施关键在于使用各国药典药品检验方法进行结果判定时的“可互换性”。在遵循“可互换性”的前提下,各国药典采纳ICH Q4B 指导原则时都有着本国视角的特殊考虑,增加了方法补充性说明、注意事项和仪器校准部分,充实收载内容。另外,正如《美国药典》收载的部分方法为非强制执行的指导性方法,对于ICH Q4 转化和实施可保留一定的灵活性和选择性。
ICH Q4A 特别强调,各国药品监管机构应开展协调标准在本区域内的适用性评估,得到普遍认可后方能接受和实施。从评估到稳步实施通常需要5~15年的时间。考虑到《中国药典》转化实施ICH Q4 指导原则过程中需开展大规模的试验验证研究,未经历史检验而修订现有药典检验方法可能导致的风险尚不明确,故建议ICH Q4 指导原则的转化实施应兼顾国际协调和中国特色,尽量平稳过渡,避免标准硬着陆所产生的不适用问题,给上市药品质量控制带来不可预测的风险。
ICH Q4A 也提出了通过方法互换的方式,采取双轨制,即在标准制定过程中,维持本国药典检验方法的同时,通过方法学比对研究,满足检验方法的可靠性和适用性,同时接受和认可ICH的检测方法。通过与国际接轨或并轨的方式,采取更为灵活的标准管理执行机制,实现《中国药典》与ICH Q4B 检验方法的一定程度范围的互认,也不失为ICH Q4 转化实施的有效策略。

