紫外诱变选育高产酒精及酸的酿酒酵母
王犁烨,陈新军,卢丕超,刘维兵,高 飞,马 珊,张 颖,武 运*
(1.新疆农业大学 食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆中信国安葡萄酒业有限公司,新疆 昌吉 832200;3.新疆维吾尔自治区科技项目服务中心,新疆 乌鲁木齐 830011;4.吐鲁番市质量与计量检测所,新疆 吐鲁番 838000)
酵母菌是泛指能发酵糖类的各种单细胞真核微生物,主要分布在含糖质较高的偏酸性环境[1]。酵母菌与人类关系密切,是人类实践中应用较早的一类微生物,被运用于酿造、食品、医药等方面[2]。通常从自然界分离得到的野生菌株在发酵性能和功能上都具有一定的局限性,因此研究人员通过对已知菌株进行诱变,从基因层面上改变酵母菌的性质及功能,从而达到生产需要[3-6]。
目前,常用的诱变方式包括物理方式和化学方式,紫外线诱变(ultraviolet mutagenesis,UV mutagenesis)是常见的物理诱变方式,广泛用于微生物菌种的诱变处理,并且有着悠久的历史[7-8]。紫外线能量低,对核酸造成的伤害比较单一,具有操作简便、效率高、安全性好、诱变效率高等优点,在避光条件下诱变结束后已产生突变的性状不易恢复,因此应用较广泛[9-10]。
新疆地区生态环境独特,区位优势明显,是发展酿酒葡萄的理想产区[11]。但由于新疆夏季光照时间长,光照强度大,所以葡萄酸度低,对葡萄酒的品质产生一定影响。试验以从葡萄表面筛选的酿酒酵母(Saccharomyces cerevisiae)菌株Y6为出发菌,通过紫外诱变对其发酵性能进行改造,以期获得高产酒精及酸且发酵性能稳定的目标酿酒酵母菌株,通过微生物代谢来增加葡萄酒的酒精度和酸度,以期提高新疆葡萄酒品质。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
出发酿酒酵母(Saccharomyces cerevisiae)菌株Y6:新疆农业大学食品科学与药学学院微生物实验室提供。
1.1.2 化学试剂
酵母浸粉、蛋白胨、琼脂粉:北京奥博星生物技术有限责任公司;葡萄糖、无水乙醇:天津市致远化学试剂有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC):上海蓝季生物科技发展有限公司;溴甲酚绿:天津市北联精细化学品开发有限公司;马铃薯葡萄糖琼脂:青岛高科园海博生物技术有限公司;磷酸二氢钾(KH2PO4)、硫酸镁(MgSO4·7H2O):天津市光复科技发展有限公司;实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
TTC上层培养基:0.05 g TTC,0.5 g葡萄糖,2 g琼脂,100 mL蒸馏水,121℃灭菌15min。
TTC下层培养基:10 g/L葡萄糖,2 g/L蛋白胨,5 g/L酵母浸粉,1 g/L KH2PO4,0.4 g/L MgSO4·7H2O,20 g/L琼脂,1 000 mL蒸馏水,调pH值为5.5~5.7,121℃灭菌15 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:6 g/L马铃薯浸粉,20 g/L葡萄糖,20 g/L琼脂,1 000 mL蒸馏水,调pH值为5.6~5.8,115℃灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母浸粉,20 g/L琼脂,1 000 mL蒸馏水,121℃灭菌15 min。
溴甲酚绿培养基:6 g/L马铃薯浸粉,20 g/L葡萄糖,20 g/L琼脂,0.1 g/L溴甲酚绿,1 000 mL蒸馏水,调pH值为6.0,115℃灭菌20 min。
1.2 仪器与设备
FA2014N分析天平:北京东南仪诚实验室设备有限公司;LDZX-50KBS立式高压灭菌器:上海申安医疗器械厂;HR40-A2生物安全柜:青岛海尔特种电器有限公司;MJX-160-Z霉菌培养箱:上海博讯实业有限公司医疗设备厂;TU-1810紫外可见光光度计:北京普析通用仪器有限责任公司;FE20 PLUS pH计:梅特勒-托利多仪器(上海)有限公司;PAL-1型手持糖度计:北京阳光亿事达科技有限公司;Y15全自动分析仪:美国Biosystem公司。
1.3 试验方法
1.3.1 酵母菌的活化和菌悬液的制备
将菌株Y6接种于YPD液体培养基中,于28℃条件下培养24 h;然后以2%的接种量接入YPD液体培养基中,于28℃条件下培养24 h后,接种到YPD固体培养基中;其次挑选出菌落大,表面光滑,呈乳白色的单菌落为出发菌,接种到YPD固体培养基斜面上,在冰箱中保存;最后将斜面上的出发菌接种到YPD液体培养基,在28℃条件下培养24 h,重复两次制得菌悬液。
1.3.2 Y6酵母生长曲线的测定
将在YPD液体培养基中活化好的菌株Y6菌悬液以5%的接种量接种到YPD液体培养基中,在28℃条件下培养,每间隔2 h取一次样,在波长600 nm处测定吸光度值,以空白培养基为对照,根据测得的吸光度值绘制菌株Y6的生长曲线,确定菌株Y6的生长对数期。
1.3.3 紫外诱变试验
吸取4 mL处于对数生长期的菌悬液放入培养皿中,将培养皿放在距30 W的紫外灯30 cm处进行照射,照射时间分别为40 s、60 s、80 s、100 s、120 s、140 s、160 s,同时做空白对照组。照射结束后,分别将每个平板中的菌悬液稀释1011倍并涂布在3个YPD固体培养基上,在28℃避光条件培养48 h,防止光复活,平板计数,计算致死率,并随机选取诱变后的酵母菌斜面保藏,进行发酵实验[12]。致死率计算公式如下:
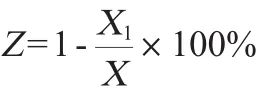
式中:Z为致死率,%;X1为紫外线处理后的菌落数,个;X对照
组的菌落数,个。
1.3.4 诱变菌株产酒精产酸能力初筛
(1)TTC培养基筛选[13-15]
采用划线法将挑选出的突变菌株接种于TTC下层培养基中,在28℃条件下培养48 h后,在TTC下层培养基上覆盖一层TTC上层培养基,并于28℃条件下培养3 h,观察培养平皿中的显色情况,从中筛选出产酒精能力强的突变菌株。
(2)溴甲酚绿培养基筛选[16]
先在培养皿中倒入一层刚好可以覆盖培养皿底部的溴甲酚绿培养基,待其凝固后放入牛津杯,再在牛津杯外围倒入一层溴甲酚绿培养基,培养基凝固后取出牛津杯,将TTC培养基筛选出的颜色较深的酵母菌株进行活化,吸取0.1 mL菌液环接种于牛津杯空洞内,在28℃条件下培养24 h,观察黄色圈,选择菌落周围出现较大黄色圈的菌株进行发酵能力试验。
(3)菌株发酵能力测试[17]
将前两步筛选出的突变酵母菌株,以5%的接种量分别接种于装有10 mL YPD液体培养基的试管中后,放入杜氏小管,并确保杜氏小管内无气泡,在28℃的条件下培养,每12h观察一次突变菌株产气情况,记录杜氏小管内的填充度,了解诱变菌株的发酵性能。
1.3.5 诱变菌株产酒精产酸能力复筛
将葡萄汁于115℃灭菌20 min,分装在5个三角瓶中,每瓶150 mL,测定葡萄汁的糖度为23.6°Bx,总酸为4.94 g/L。将上述筛选的诱变菌株和出发菌株同时以5%的接种量接种于葡萄汁中,在25℃条件下培养10 d,测定菌株产酒精和产酸能力,确定目标菌株。
1.3.6 遗传稳定性试验[18]
将目标菌株连续传代培养5次,将每一代菌株以5%的接种量接种于糖度为23.6°Bx,总酸为4.94 g/L的葡萄汁中,在28℃条件下培养10 d,测定突变菌株的产酒精和产酸能力,从而验证菌株的突变性能是否能够稳定遗传。
2 结果与分析
2.1 菌株Y 6的生长曲线
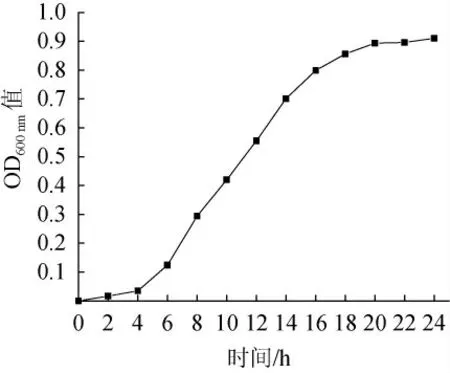
图1 菌株Y6的生长曲线Fig.1 Growth curve of strain Y6
微生物所处的生理状态对诱变效果有很大影响,酵母菌处于对数生长期时,其个体之间的形态、化学组成和生理特性等基本一致,数目以稳定的几何指数增长且对环境因素的作用十分敏感[19-20]。在此阶段进行紫外辐照,可以增加基因突变、稳定遗传的几率[21]。如图1所示,菌株Y6在前4 h OD600nm值基本保持不变,此时菌株处于迟缓期;在4~16 h OD600nm值急速上升,菌株处于对数生长期,在16 h后酵母菌进入稳定期。因此,选择在10 h对菌株Y6进行紫外诱变。
2.2 最佳紫外诱变时间的确定
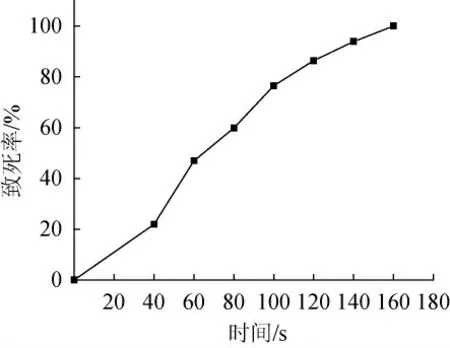
图2 不同辐照时间对菌株Y6致死率的影响Fig.2 Effect of different irradiation time on the lethality rate of strain Y6
由图2可知,菌株Y6的致死率随着紫外灯照射时间的延长而急速上升,这表明照射时间对酵母菌株的致死率有重要影响。紫外线具有较强的杀菌能力和诱变能力,较高的致死率有利于优良菌株的筛选,但如果照射时间过长,会使得一些高活性菌株致死,不利于筛选。通常正向突变一般都出现在70%~80%致死率中[22],因此试验选择的最佳辐照时间为100 s,此时菌株致死率为76.52%,较符合酵母菌正向突变的理想致死率。
2.3 诱变菌株产酒精产酸能力初筛
2.3.1 TTC培养基筛选结果
将紫外诱变100 s后的20株酵母菌株接种到TTC培养基上,显色情况如表1所示。

表1 20株紫外诱变酵母菌株在TTC培养基的筛选结果Table 1 Screening results of 20 yeast strains by ultraviolet mutation on the TTC media
TTC作为一种显色剂,能对酵母的代谢产物发生显色反应,并且通过反应颜色的深浅来判断酵母中呼吸酶活力大小,即酵母产酒精能力的高低,通常情况下,产酒精能力越强的酵母菌株在显色培养基上显现的颜色越深。采用划线法诱变菌株接种到TTC培养基上,结果如表1所示。由表1可知,菌株Y6-5、Y6-6、Y6-13、Y6-14、Y6-15、Y6-17、Y6-20显色最为明显,为深红色,比出发菌株Y6的颜色更深,这说明酵母菌株经过紫外照射后,产酒精能力确实增强了。因此,将筛选出的菌株Y6-5、Y6-6、Y6-13、Y6-14、Y6-15、Y6-17、Y6-20进行溴甲酚绿培养基筛选试验。
2.3.2 溴甲酚绿培养基筛选结果
将菌液注入牛津杯孔洞中,在溴甲酚绿培养基上培养24 h,结果如图3所示。

图3 7株突变菌株在溴甲酚绿培养基筛选结果Fig.3 Screening results of 7 mutant strains on the bromocresol green media
由图3可知,菌株Y6-6、Y6-15、Y6-20牛津杯周围的黄色圈明显小于菌株Y6,这说明菌株Y6-6、Y6-15、Y6-20这三株菌的产酸能力不如出发菌株Y6,而菌株Y6-5、Y6-13、Y6-14这三株菌牛津杯周围的黄色圈明显大于菌株Y6,表明这三株菌的产酸能力明显大于菌株Y6。菌株Y6-17牛津杯周围的黄色圈和菌株Y6大致相同,因此也做备选。将挑选菌株Y6-5、Y6-13、Y6-14、Y6-17菌株进行后续的发酵试验。
2.3.3 菌种发酵能力测试结果
将杜氏小管排气倒置放入接有菌株Y6-5、Y6-13、Y6-14、Y6-17的试管中,产气结果如表2所示。
由表2可知,当培养12 h时,菌株Y6-5、Y6-13、Y6-14产气速度较快,CO2气体充满1/3杜氏小管;当培养24 h时,菌株Y6-13、Y6-14产生的CO2充满50%杜氏小管,而菌株Y6-5已经将杜氏小管充满;当培养36 h时,菌株Y6-5、Y6-13已经充满整个杜氏小管且在培养48 h时,接有菌株Y6-5试管中的杜氏小管离开底部漂浮在试管中,而菌株Y6-14、Y6-17仍不能充满整个小管,但四支试管底部均存在大量菌体沉淀,说明这四株诱变酵母的起酵能力为菌株Y6-5>菌株Y6-13>菌株Y6-14>菌株Y6-17。
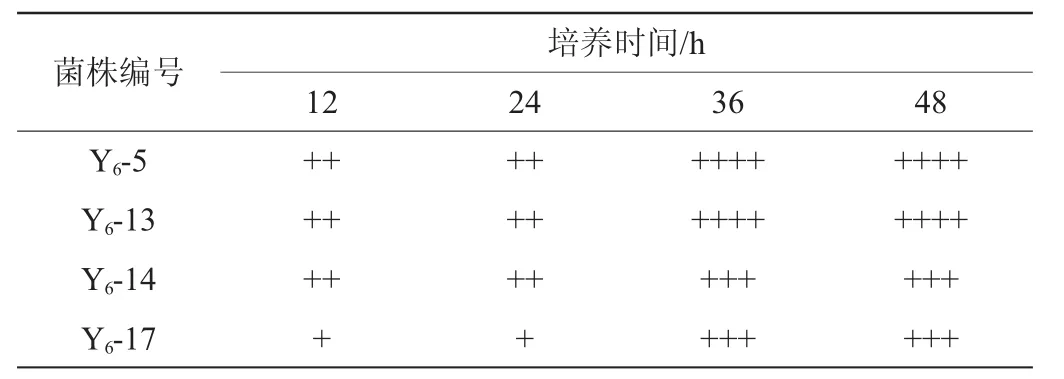
表2 4株突变酵母菌株杜氏小管试验结果Table 2 Results of Duchenne tubule tests for 4 mutant strains
2.4 诱变菌株复筛结果
将5株菌株分别接种到葡萄汁后,其产酒精及产酸情况如表3所示。
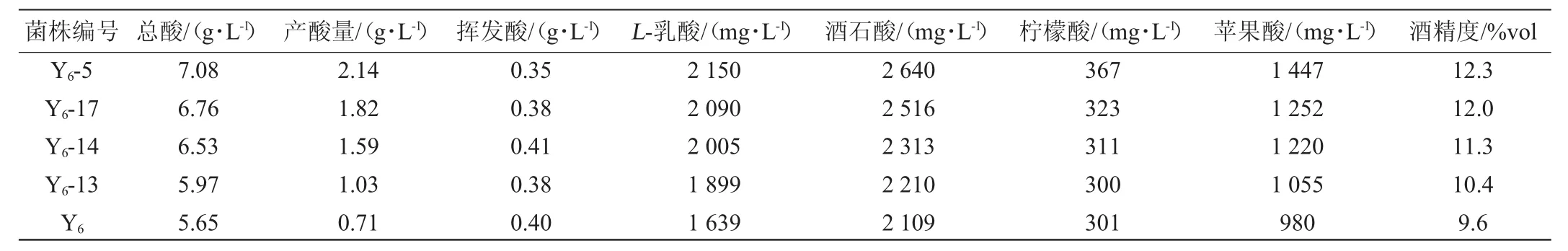
表3 4株突变酵母菌株与出发菌株Y6产酒精及产酸情况Table 3 Production of alcohol and acid by 4 mutant yeast strains and original strain Y 6
由表3可知,与出发菌株Y6相比,诱变菌株的产酸产酒精能力明显增强,与初筛结果一致。4株诱变菌株产酒精能力依次为菌株Y6-5>菌株Y6-17>菌株Y6-14>菌株Y6-13;4株诱变菌株的产酸情况也存在差别,其能力强弱依次为:菌株Y6-5>菌株Y6-17>菌株Y6-14>菌株Y6-13,但菌株产主要有机酸种类基本一致,为L-乳酸、酒石酸以及苹果酸。由此可以猜测菌株经过紫外照射后,虽然改变了菌株产酸能力的强弱,但产主要有机酸种类不会发生改变。在国标GB 15037—2006《葡萄酒》中限定葡萄酒中挥发酸≤1.2 g/L,以上菌株均符合要求。因此,将菌株Y6-5确定为目标菌株。
2.5 遗传稳定性试验结果
将突变菌株Y6-5培养5代,把每一代菌液接种到葡萄汁中发酵10 d,发酵液的酒精度和总酸分析结果见图4。
由图4可知,第四代菌株产酒精能力最强为12.33%vol,第二代菌株产酸能力最强为2.15 g/L。虽然5代菌株的产酸和产酒精能力存在差距,但产酸能力都维持在2.1 g/L左右且挥发酸含量在0.35 g/L左右,产酒精能力都维持在12%vol左右。结果表明,突变菌株Y6-5的高产酸和酒精性能可以稳定地遗传。
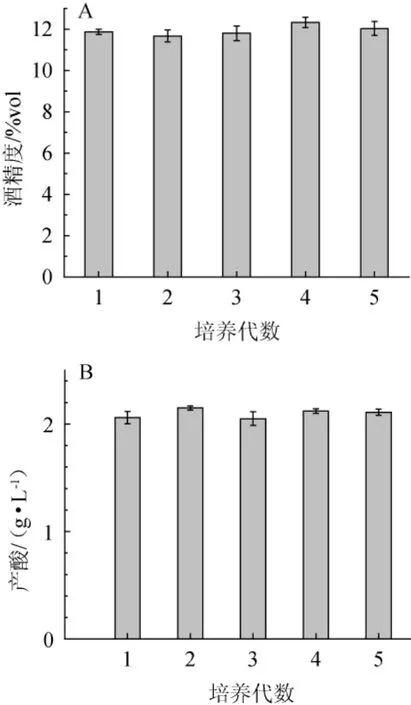
图4 突变菌株Y6-5产酒精(A)及产酸(B)能力遗传稳定性试验结果Fig.4 Genetic stability tests results of mutant strain Y 6-5 with the capacity of producing alcohol(A)and producing acid(B)
3 结论
本研究以在葡萄表面筛选出的酿酒酵母菌株Y6为出发菌,在确定了照射功率为30 W和照射距离为30 cm的基础上,通过单因素试验确定最佳照射时间为100 s。利用TTC培养基试验、溴甲酚绿培养基试验以及杜氏小管试验将照射后挑选的20株突变菌株进行筛选,最后再经葡萄汁发酵试验获得一株突变菌株Y6-5,其产酸能力和产酒精能力都明显高于出发菌株的Y6。将突变菌株Y6-5培养5代,分别接种到葡萄汁中待发酵结束后,该突变菌株产酸2.1 g/L,产酒精12.3%vol,较出发菌株Y6分别提高了201.41%和28.13%,并且遗传性能稳定,可以用来提高新疆葡萄酒品质。

