利用PCR扩增快速筛选天麻萌发真菌小菇属Mycena sp.的研究*
杨志平 ,秦丽媛 ,王玉川 ,陈 林 ,3,4,杨明挚 ,张汉波 ,4**
(1.云南大学生命科学学院,云南 昆明 650091;2.昭通市天麻研究院,云南 昭通 657000;3.云南大学生态与环境科学学院,云南 昆明 650091;4.云南大学省部共建云南生物资源保护与利用国家重点实验室,云南 昆明 650091)
天麻(Gastrodia elata) 是高度退化的兰科多年生、腐生草本植物,全株无绿叶,无叶绿素,不能进行光合作用,地下有肉质块茎,长扁形,大小不一。其种子如粉尘般细小,无胚乳和其他营养贮备部位,仅由胚和种皮构成,胚组织无器官分化,在没有可供给种子萌发的外源营养条件下,其正常发芽需依靠小菇属(Mycenasp.)为主要类群的真菌促进。目前已经确定了部分天麻利用萌发菌,完成自身萌发的相关代谢通路及抗性相关基因和蛋白的表达[1]。天麻种子利用紫萁小菇(M.osmundicola) 获得养分的方式为种子的原胚体细胞消化、吸收菌丝使胚体长大突破种皮发芽[2]。
在实际的应用和研究工作中,小菇属真菌分离过程中存在一定的困难,除了刚萌发的原球茎,很难直接判断其他材料上是否存在萌发菌,这一问题限制了一些有可能存在萌发菌的材料的发掘,进而导致某些萌发菌的物种很难被人们发现并利用。云南省昭通市一直以来就有麻农用蕨草须根来促进天麻种子萌发,但这种方法会造成很大程度的空塘率。之后麻农从山东、北京、陕西等省市引入“两菌”,部分新的引入种确实能提高产量,但也存在引入菌种退化、不纯等问题,这不仅未能促进当地天麻产业的发展,还带来众多问题,例如感染有杂菌、病毒、害虫的两菌会引发天麻块茎腐烂病和虫蚀等。同时市面上的萌发菌,大多来源不明确,菌株与大多数食用菌菌落形态相似,真假难辨,甚至有不良商家用食用菌充当萌发菌进行销售,造成部分种植户的重大经济损失。
因此,快速定位天麻萌发菌在“环境”中的存在,对于找到并分离天麻萌发菌非常有意义。虽然近几年出现的高通量测序方法也可以快速检测出样本中是否存在小菇属真菌,但此方法用于检测大量样本将导致较高的经济成本和时间成本。所以本试验根据MacDonald&Sarre提出的适用于设计检测“环境DNA”中某种物种的引物的验证框架[3],并结合运用Primer Premier 5.0进行引物设计的方法[4],设计适用于小菇属真菌DNA快速检测的特异性引物。这种用“环境DNA”样品检测目标DNA存在的方法提供了一个定位小菇属真菌相对简单、快速而又经济的方法。为研究、分离更多小菇属真菌奠定良好的前期基础。
1 材料与方法
1.1 材料
1.1.1 菌株
本研究所用的小菇属真菌菌株(Mycenasp.)BZZ由昭通市天麻研究院提供。用于检验设计引物的特异性试验所用菌株囊括了子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌 (Zygomycota) 门三个门的黑盘孢科 (Amphisphaeriaceae)、梨孢假壳科 (Apiosporaceae)、葡萄座腔菌科(Botryosphaeriaceae)、壳斗科 (Capdiaceae)、革盖菌科(Coriolaceae)、新球腔菌科(Davidiellaceae)、间座壳科(Diaporthaceae)等45个科,拟盘多毛孢属(Pestalotiopsis)、葡萄座腔菌属 (Botryosphaeria)、枝孢属(Cladosporium)、炭疽菌属(Colletotrichum)、附球(真) 菌属(Epicoccum)、伪壶担菌属(Pseudolagarobasidium)、柄锈菌属 (Puccinia) 等 125个属,合计125种真菌。
1.1.2 主要试剂和仪器
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):去皮马铃薯100 g,切成小块,加水煮沸30 min,用4层纱布过滤,在滤液中加葡萄糖10 g、琼脂10 g,加去离子水补足至500 mL。
5×TBE:Tris 碱 54 g、 硼 酸 27.5 g、0.5 mol·L-1EDTA-Na 20 mL,用800 mL无菌去离子水溶解,混匀后加无菌去离子水用容量瓶定容至1 L(pH为8.0)。dNTP Mix(大连 TaKaRa公司),Ex Taq酶(大连TaKaRa公司),DL2000 DNA Marker(大连TaKaRa公司),Golden view核酸染料、TIANGEN TIANamp Soil DNA Kit土壤基因组DNA提取试剂盒、TIANGEN Plant Gemic DNA Kit植物基因组DNA提取试剂盒。
土壤筛、分析天平,Model CPA26P,德国;Gering组织细胞破碎仪TissuePrep,北京中创先锋科技有限责任公司;VeritiTM梯度PCR仪,Applied Biosystems,美国;核酸电泳仪,Bio-Rad,美国;紫外凝胶成像分析系统,Bio-Rad,美国。
1.2 方法
1.2.1 引物设计
在 NCBI(National Center for Biotechnology Information) 网站上查询、下载小菇属和口蘑科(Tricholomataceae)其他属真菌的部分基因序列,如表1所示。接着将序列导入DNASTAR Lasergene v7.1软件包中的SeqMan中,然后将所有序列合并为一个FASTA格式文件。使用软件Clustal X v2.1将序列文件的多个序列进行两两比对构建距离矩阵[5],观察距离矩阵找出小菇属序列中一致的,但不同于同科中其他属真菌序列的区域,记下位点和此位点的序列区。使用MrBa v3.2构建系统发育树[6]。使用jModel-Test v2.1.4选择最适合的核苷酸取代模型[7-8]。结合找出的位点和区域,选取与小菇属真菌相近但与其他属真菌较远的序列,用Primer Premier v5.0进行引物设计。

表1 设计引物用序列信息Tab.1 Information of downloaded sequences from NCBI used for design primers
1.2.2 引物特异性检测
在进行引物验证前,采用实验室现有小菇属真菌菌株BZ的DNA作为阳性对照测试引物,测试能否成功扩增出小菇属真菌序列。成功扩增出小菇属真菌序列后,采用实验室其他种属的真菌DNA验证引物特异性。验证时首先利用引物合成公司给的退火温度扩增DNA序列。若特异性差(出现非特异性条带)可适当提高退火温度;若目标条带太暗,可适当增加DNA浓度或增加扩增反应循环数;若非特异性条带出现在100 bp~200 bp区间,则应该考虑降低引物浓度。
1.2.3 引物实际运用灵敏度检测
在昆明西山森林公园采集林下土壤,采用60目土壤筛过筛后,收集土壤分装在20支离心管中,每管装2.5 g,进行土壤湿热灭菌,3次灭菌完成后待用,灭菌条件为121℃,60 min,每次灭菌后取出于室温放置24 h再进行下一次灭菌;在贴有玻璃纸的PDA培养基上接种阳性小菇属真菌菌株BZZ,待其长满培养基后,用无菌9 mm菌落打孔器打孔截出圆菌片,再用无菌镊子将圆菌片取50片置于灭菌且装有滤纸的培养皿中(在放入圆菌片前先称量此培养皿重量并记下数值),装完后称量总重量;将单个圆菌片面积分别为1/8、1/4、1/2和1个、5个、10个圆菌片在无菌操作条件下加入上述准备好的离心管中,接着将离心管置于快速组织细胞破碎仪中研磨,直至圆菌片与土壤进行充分混匀。接下来,按TIANamp Soil DNA Kit的提取方法进行总DNA提取;先用通用引物ITS(ITS4:TCCTCCGCT TATTGATATGC; ITS5: GGAAGTAAAAGTCGTAA CAAGG)[13]扩增验证DNA提取质量,再用筛选出的特异引物和扩增条件进行扩增。
引物灵敏度定义为圆菌片质量占土壤质量的百分比(土壤质量远远大于菌盘重量),其数值越小,说明该引物灵敏度越高。计算公式(S,%)为:

注:m1表示圆菌片质量(g);m2表示土壤质量(g)。
1.2.4 PCR扩增
反应体系:10×扩增缓冲液5μL,dNTP混合物5μL,正反引物各1μL,DNA模板1μL,Taq DNA聚合酶0.25μL,加双蒸水至50μL。扩增条件:94℃变性4 min;94℃反应 1 min;适当退火温度(X) 反应1 min;72℃反应1 min,35个循环。72℃延伸10 min。其中退火温度(X)根据各对引物退火温度调整。
1.2.5 琼脂糖凝胶电泳检测
制备1%的琼脂糖凝胶。将加热溶解的胶体稍稍冷却至50℃~60℃后加入DNA显色剂(0.05%Golden view)混匀,倒入插好梳子的胶槽,完全冷却后拔下孔梳,把胶置于盛有1×TBE缓冲液的电泳槽备用。
吸取PCR产物5μL与1μL 6×Loading Buffer混匀后点入点样孔,以DL2000的DNA Marker为参照,在121 V恒压下电泳30 min。电泳结束后,将胶块在紫外凝胶成像系统中拍照观察。
1.2.6 实际检测能力验证
采用采自昭通小草坝的天麻种子萌发菌塘土壤和天麻原球茎验证所设计引物的实际检测能力。将天麻原球菌用无菌水冲洗3次,按照TIANGEN Plant Gemic DNA Kit的方法提取总DNA。采集的土壤经60目土壤筛筛选,采用TIANamp Soil DNA Kit提取总DNA。利用筛选出来的引物对这些环境样本总DNA进行PCR扩增,扩增DNA片段送生工生物工程(上海)股份有限公司测序,检验能否从样本中快速检测出小菇属真菌。
2 结果与分析
2.1 ITS基因引物设计
共设计了5对引物,引物位置见图1,引物信息见表2。
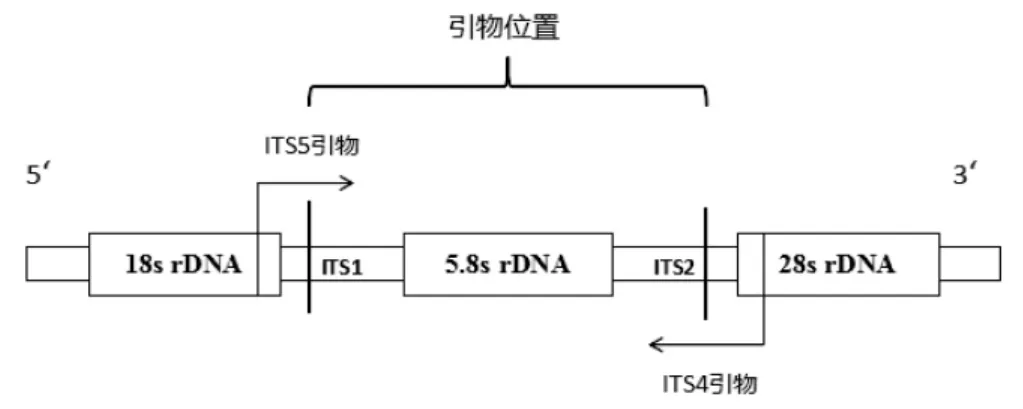
图1 设计引物位置图Fig.1 Position diagram of designed primers in this study
2.2 PCR扩增阳性验证
PCR扩增阳性验证结果见图2。
由图2可知,所有引物都成功扩增出实验室小菇属真菌BZZ的DNA片段,PCR产物的实际大小均在设计理论片段大小范围内,且测序后比对结果均为小菇属真菌,说明所有引物均能扩增实验室的小菇属真菌序列。
2.3 真菌菌株DNA的PCR扩增特异性验证
通过分析3个门、45个科、125个属的125株真菌的PCR扩增结果可知,M52-1特异性不强,测试菌株均能扩增出条带;M52-2在退火温度为63℃时,除阳性外被扩增出来的菌株还有肉座菌科(Hypocreaceae) 的脐孢木霉菌(Trichoderma brevicompactum)、Gmoniaceae科的Ophiogmonia apiospora、小丛壳科 (Glomerellaceae) 的小丛壳属真菌(Glomerellasp.),占到测试菌株的2.4%;M22-3在退火温度为61℃时,除阳性外被扩增出来的菌株还有新球腔菌科 (Davidiellaceae) 的枝孢菌 (Cladosporiumsp.)、黑盘孢科(Amphisphaeriaceae)的拟盘多毛孢(Pestalotiopsis neglecta)、小双腔菌科(Didymellaceae) 的巨腔茎点霉(Phoma macrostoma)、小丛壳科 (Glomerellaceae) 的胶孢炭疽菌(Colletotrichum gloeosporioides)、黑腐皮壳科 (Valsaceae)的拟茎点霉(Phomopsissp.)、格孢腔菌科(Pleosporaceae) 的甘蔗双孔孢菌(Bipolaris sacchari)、炭角菌科(Xylariaceae)的座坚壳菌(Roselliniasp.)、丛赤壳科(Nectriaceae)的水生镰孢(Fusicolla aquaeductuum),占到测试菌株的6.4%;M11-4在退火温度为58℃时,除阳性外被扩增出来的菌株还有炭角菌科(Xylariaceae) 的中碳垫菌属菌(Nemaniasp.)、丛赤壳科(Nectriaceae)的玛利亚霉(Mariannaeasp.)、口蘑科(Tricholomataceae)的杯伞属菌(Clitocybesp.)、隔孢球壳科(Didymosphaeriaceae) 的Paraphaeosphaeria neglecta、蛇形虫草科 (Ophiocordycipitaceae) 的Chaupycnissp.,占到测试菌株的4.0%;BZZ-5在退火温度为63℃时,除阳性外被扩增出来的菌株还有发菌科(Trichocomaceae)的青霉菌(Penicilliumsp.)、伞形霉科(Umbelopsidaceae)的伞状霉属菌(Umbelopsissp.)、荚孢腔菌科 (Sporormiaceae) 的光黑壳属菌(Preussiasp.)、葡萄座腔菌科(Botryosphaeriaceae)的小新壳梭孢(Neofusicoccum parvum)、炭角菌科(Xylariaceae) 的Xylaria venustula、小丛壳科(Glomerellaceae) 的博宁炭疽菌(Colletotrichum boninense)、丛赤壳科 (Nectriaceae) 的燕麦镰刀菌(Fusarium avenaceum)、肉座菌科 (Hypocreaceae)的枝顶孢霉属菌(Acremoniumsp.)、小丛壳科(Glomerellaceae) 的朱顶红炭疽菌 (Colletotrichum cliviae),占到测试菌株的7.2%。

表2 设计引物信息Tab.2 Information of designed primers in this study

图2 PCR扩增阳性验证胶图Fig.2 Electrophoretic gel for PCR amplification as positive control
2.4 土壤中的小姑属真菌DNA扩增灵敏度验证
土壤中的小姑属真菌DNA扩增灵敏度验证结果见图3和图4。
图3 各个浓度土壤总DNA经ITS引物扩增的PCR产物胶图Fig.3 Electrophoretic gel for PCR amplification of different concentrations of Mycena sp.DNA in soil by ITSprimer
由图3和图4的引物ITS4和ITS5检验可知,试验成功提取了按比例加过菌丝的土壤总DNA,目标片段出现在750 bp指示带附近,符合理论长度即700 bp左右,如图3所示。用特异性良好的4对引物,即M22-3、BZZ-5、M52-2和M11-4,进行灵敏度验证后,结果如图4所示。通过胶图,可以看出M22-3、BZZ-5灵敏度较好,在测试范围内能检测到的菌丝最小浓度为0.033%,而根据其条带的亮度,M22-3灵敏度最好;M52-2、M11-4灵敏度相较于其他两对较差,在测试范围内能检测到的最小浓度为1.292%。
2.5 实际土壤环境和生物组织检测能力验证
用4对均成功来自天麻原球茎和天麻种子萌发菌塘土壤样本的引物的总DNA扩增出相应片段,大部分片段测序峰图良好,少数几条片段为双重峰。扩增片段经过序列测定,在NCBI上经BLAST比对,发现特异DNA片段序列与分离自日本的日本赤箭(Gastrodia nipponica)的小菇属真菌菌株序列(Gen-Bank accession number:LC013373) 相似度都达到了99%。结果表明引物M22-3、BZZ-5、M52-2和M11-4都能够从环境样本DNA中快速检测出小菇属真菌,但M52-2和M11-4的DNA扩增片段测序时部分样本会出现杂峰。

图4 四对引物灵敏度检测胶图Fig.4 Electrophoretic gel of four pairs prumers.in the test of primer sensitivity
3 讨论
1980年徐锦堂和冉砚珠[14]从天麻种子发芽的原球茎中首次分离出与天麻种子具有共生作用的“京陕807-02号”,该菌株后来被鉴定为紫萁小菇[15]。随后陆续有一些新的萌发菌的相关报道,如兰小菇(M.orchidicola)、石斛小菇(M.dendrobii)、开唇兰小菇(M.aectochili)等[16]。尽管汪鋆植等[17]发现来自白栓菌属的大白栓菌(Trametes laclinea) 为一种新的萌发菌;Liu等[18]表明来自其他4个属的真菌,包括毛壳菌属 (Chaetomium)、瘤菌根菌属 (Epulorhiza)、头孢霉属(Cephalosporium)、角菌根菌属(Ceratorhiza)也可以促进天麻萌发。但这些菌株主要处于研究阶段,并未实际运用到天麻的种植生产中。相对来说,小姑属真菌仍然是目前最为有效和广泛地用于人工栽培天麻的萌发真菌类群[19-20]。利用小菇属真菌作为萌发菌,天麻种子发芽率高、营养繁殖茎和原球茎生长速度快、体积大,接上蜜环菌的几率高,天麻产量也高[21]。因此鉴定、筛选出优良的小菇属真菌,对提高天麻有性繁殖产量至关重要。
本试验针对现阶段昭通当地的天麻种植过程中萌发菌菌种退化、菌种资源单一等问题开展研究。通过对目前已经在NCBI登记的小菇属真菌DNA序列的归纳、总结,在ITS序列区间内设计并得到了4对小菇属真菌特异性良好的引物(M52-2、M22-3、M11-4和BZZ-5),均可以成功扩增出小菇属真菌。然而,设计引物时未能够找到完全扩增不出其他属真菌的引物,某些被扩增出的其他属真菌在分离测序菌株中的占比分别为木霉属(Trichodermasp.)0.8%、枝孢属(Cladosporiumsp.)0.8%、拟盘多毛孢属(Pestalotiopsissp.)5.3%、炭疽菌属(Colletotrichumsp.)0.8%、碳垫菌属(Nemaniasp.)1.5%、玛利亚霉(Mariannaeasp.)3.0%、青霉菌(Penicilliumsp.)3.0%、伞状霉属(Umbelopsissp.)0.8%、镰刀菌属(Fusariumsp.)13.5%。不过,在测试菌株内检测引物特异性时,4对引物能扩增出来的其他属真菌几乎不重叠,故在实际运用时可采用2对到多对引物同时进行扩增;当采用土壤作为检测的“环境”样本进行引物灵敏度检测时,土壤中含有0.033%的菌丝体浓度时即可成功检测出小菇属真菌的存在;同时,用天麻萌发初期组织和菌塘土壤样本总DNA检测了引物在实际生产中运用能力,有4对引物都可以检测出小菇属真菌的分布。总体来看,本文设计获取的M22-3和BZZ-5两对引物对小菇属真菌的特异性、灵敏度都较高,经过组合应用,能够达到快速筛选出小菇属真菌的目的,并可用于对环境材料中小菇属真菌的快速定位。
除天麻外,大多数兰科植物的种子萌发和幼苗生长也依赖小菇属Mycenasp.等真菌营养[22-23]。本研究利用设计的ITS引物进行PCR扩增快速筛选天麻萌发真菌的结果,也可为其他兰科植物种子萌发真菌的筛选提供借鉴,从而促进兰科植物种苗快繁途径中有性繁殖技术的发展。

