全氟己烷磺酸暴露影响小鼠肠道菌群组成的初步研究
张兴桃,王海潮,徐礼生,章志远
宿州学院生物与食品工程学院,安徽宿州,234000
全氟己烷磺酸(Perfluorohexane sulfonate,PFHxS)属于一种全氟化合物,具有疏油、疏水和极低表面张力等特殊理化性质,广泛应用于日用品的制造,如食品包装物、不粘炊具等[1]。近年来,随着人们环保意识的的提高,有关PFHxS毒理的研究受到了越来越多的关注。已有研究表明PFHxS是自然界中存在于人体代谢周期最长的全氟化合物质,且已在人血清,精液和母乳中检出,浓度有逐年增高的趋势,因此对人类存在潜在健康风险[2-3]。PFHxS具有一定的发育神经毒性和肝脏毒性[4], Iwa Lee等发现初生小鼠PFHxS暴露后对脑神经蛋白发育产生了不利影响[5];Henrik Viberg等发现PFHxS暴露与小鼠行为与认知功能紊乱相关[6];Youn 等则揭示PFHxS暴露后激活ERK1/2介导的信号通路,诱发神经细胞的凋亡[7]。
肠道菌群的变化与机体功能紊乱存在一定的相关性,已成为当前生物学研究热点之一,也是某些特定疾病研究的突破口[8]。肠道菌群是机体肠道的重要组成部分,与人体健康、疾病发生等密切相关[9]。王丽凤研究发现肠道中微生物的变化和粪便菌群构成显著相关,因此研究粪便菌群,可为研究解肠道菌群提供便利[10]。而培养基培养等传统的研究方法等局限于某些特定微生物,低估了菌群的数量和多样性,不能充分反映肠道菌群的变化[11]。目前,分子生物技术如变性梯度凝胶电泳、聚合酶链式反应、克隆文库构建等已经广泛运用到微生物群落分析中。高通量测序技术具有准确定量、实时检测等较为明显的优势[12],已广泛应用于微生物群落结构研究。本研究采用Illumina MiSeq高通量测序技术,结合生物信息学分析技术分析测序数据,旨在分析PFHxS暴露对小鼠肠道菌群结构组成、菌群多样性和丰度等变化,探索PFHxS暴露下小鼠肠道菌群的组成变化,探究肠道菌群改变与机体特定功能紊乱之间的关联性。
1 材料与方法
1.1 材料与主要仪器
1.1.1 材 料
SPF级Balb/c小鼠(购自上海思捷实验动物有限公司)、鼠粮、垫料等购于南京青龙山动物饲养场;PFHxS(Sigma-Adrich,>98.5%);FastDNA© Spin Kit for Soil(MP Biomedicals,USA) 。
1.1.2 主要仪器
PCR仪(T100,Bio-RAD)、荧光化学发光系统(FluorChem HD2,Alfa)、超微量分光光度计(NanoDrop2000,NanoDrop)、高速冷冻离心机(1-15K,Sigma)等。
1.2 实验方法
1.2.1 小鼠驯化、染毒处理
SPF级Balb/c 小鼠40只,5周龄,体重18~22 g,室温 维 持 (22±2) ℃,相对湿度为40%~60%,12 h昼夜循环,自由饮水和采食,提供Milli-Q纯水和清洁级标准鼠粮,暴露前驯化7 d。实验分4组,即对照组和实验组Ⅰ、Ⅱ、Ⅲ,每组小鼠10只,分笼饲养,每天称重后计算暴露量。实验组Ⅰ、Ⅱ、Ⅲ灌胃暴露剂量分别为PFHxS 0.02 mg/Kg·d-1,0.1 mg/Kg·d-1,1.0 mg/Kg·d-1;对照组灌胃暴露同体积去离子水,连续暴露28 d。
1.2.2 小鼠粪便的收集
暴露28 d后,收集各组小鼠新鲜粪便,放置于干燥无菌的PP离心管中, 保存于-20℃冰箱。
1.2.3 总DNA提取
采用Soil DNA Kit试剂盒提取各组小鼠粪便中菌群的总DNA,超显微紫外分光光度计法测定DNA 浓度与纯度,确定提取的DNA质量,DNA样品放置于-20 ℃冰箱中保存。
1.2.4 Illumina MiSeq测序和生物信息学分析
设计带有barcode扩增16S rDNA V3-V4的特异引物, PCR特异扩增;PCR产物经纯化后,送往江苏中宜金大分析检测公司进行MiSeq测序。测序得到的Raw Data利用Mothur软件进行DNA序列拆分处理;利用Qiime软件对数据进行拼接与初步降噪;通过Mothur软件去嵌合体等步骤后,得到fasta格式序列文件即有效数据,划分OTU (Operational Taxonomic Unit);将数据上传至RDP数据库平台,利用RDP下的细菌功能模型,对样品序列进行物种分类学分析,计算出样品的稀释性曲线(Rarefaction curves),丰富度指数(Chao1指数)、多样性指数(Shannon指数)、覆盖率指数(Coverage指数)等。
2 结果与分析
2.1 PFHxS暴露造成的小鼠体重的变化
在暴露的0~21 d中, PFHxS对小鼠体重的影响不明显。21 d后,最高浓度组小鼠体重出现下降的趋势;28 d后,最高浓度组的小鼠体重与对照组相比产生显著差异(p<0.05);而其他暴露剂量组与对照组相比,在28 d的暴露周期中均没有表现出显著体重差异(图1)。
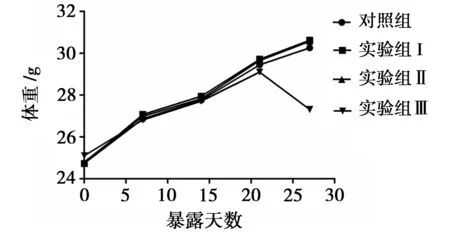
图1 PFHxS暴露造成的小鼠体重变化
2.2 肠道菌群多样性分析
通过Qiime软件计算样品的OTU(Operational Taxonomic Unit)数量 (相似水平97%以上),并利用OUT值用来衡量样品物种的丰度。测序数据的 Coverage值(测序深度,即覆盖率)均高于0.899以上,对照组在0.89以上,表明样品的测序深度满足分析要求。暴露后各组小鼠的肠道菌群的数均增加,实验Ⅱ组样品OTU数量最高,为1 087 (表1)。但Alpha多样性分析表明,暴露组小鼠肠道菌群的多样性低于空白对照组,但 PFHxS暴露浓度越高肠道菌群的多样性越低;Shannon指数越大表示群落多样性越高,4组样品中空白对照组的Shannon值较大为6.43, PFHxS浓度组次之,中、高浓度暴露组Shannon值均在3.36~4.41之间。与对照组相比,实验组Chaol值和Shannon指数差异均显著(p<0.05)。
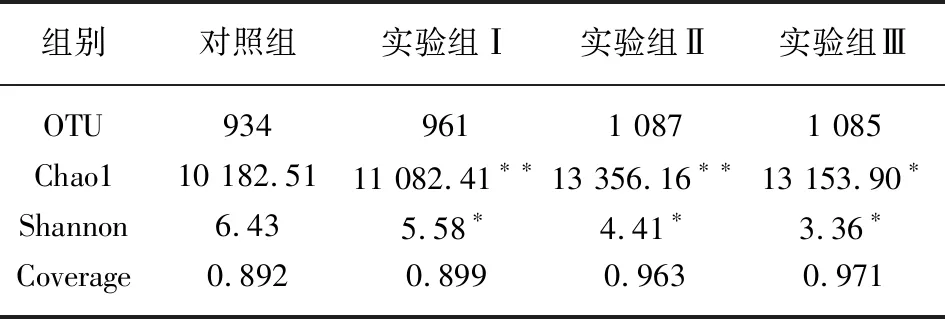
表1 各组样品肠道菌群多样性分析
注:*P<0.1,**P<0.05。
2.3 肠道菌群构成分析
分析样品群落结构(图2),结果表明门水平4组样品的菌群组成以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria) 3个门为主,所占比例高于90%。其中,厚壁菌门(Firmicutes)在所有样品中所占比例相近,占全部菌群的25%~30%;拟杆菌门(Bacteroidetes)对照组比例最低,为44.7%,暴露组比例均增加,分别达57.6%、52.4%、53.4%;变形菌门(Proteobacteria) 对照组比例最高,占18.4%,暴露组分别降低了5.37%、12.4%、9.97%;同时,PFHxS暴露也影响放线菌门(Actinobacteria)、柔壁菌门(Tenericutes)的丰度,但与对照组相比差异不显著。

图2 小鼠肠道菌群结构图(在门分类水平上)
在属水平上,对照组中的菌群主要有普氏菌属(Prevotella)、杆菌属(Odoribacter)、拟杆菌属(Parabacteroides)、类杆菌属(Bacteroides)等多个属,其中普氏菌属占菌群总量36.8%,4属菌群约占总量的79.3%(表2)。

表2 肠道菌群在属水平上的物种丰度
PFHxS暴露处理后,属水平菌群组成比例发生了明显改变,其中Prevotella比例对照组为25%,最高暴露组为51%,但中、低剂量组均未检测到;Bacteroides、乳酸杆菌属比例均随暴露剂量增加而增加,最大暴露剂量组为28.1%;Lactobacillus最大暴露剂量组为8.1%;Lactobacillus、Prevotella和Bacteroides都与机体糖脂代谢有关,其菌群比例的改变可能与机体糖脂代谢功能紊乱存在一定的联系(图3)。

图3 样品在属分类水平上丰度的热图
通过高通量分析小鼠肠道菌群结构,揭示PFHxS暴露对小鼠肠道菌群的影响。选取瘤胃球菌属(Ruminococcus)、Lactobacillus、Parabacteroides、Bacteroides、Prevotella等 5种与糖脂代谢相关的细菌,通过PFHxS暴露前后丰度的变化,初步分析PFHxS暴露下小鼠糖脂代谢功能紊乱与肠道菌群变化的关联性。暴露后,Bacteroides、Prevotella丰度变化明显,Lactobacillus高浓度暴露组与对照组差异明显(图4),初步表明PFHxS暴露可能会造成糖脂代谢功能紊乱。

图4 糖脂代谢有关的菌群丰度分布
3 结 论
本研究表明拟杆菌门、厚壁菌门和变形菌门为小鼠肠道的主要菌群;经PFHxS暴露的小鼠肠道菌群的多样性明显高于空白对照组,最高暴露组OTU数量最高,为1 087。在门的水平上,Bacteroidetes、Firmicutes和Proteobacteria等为肠道优势菌群,占比达90%以上;其中拟杆菌门在空白对照组中所占比例最低,随着PFHxS暴露剂量的提高呈上升趋势。对照组的肠道菌群主要包含Prevotella、Odoribacter、Parabacteroides、Bacteroides等多个属,但 PFHxS暴露处理后,属水平上小鼠的肠道菌群结构发生了明显改变,其中Prevotella对照组为25%,最高暴露组增加到51%,但中、低剂量组均未检测到;Bacteroides、Lactobacillus比例均随暴露剂量增加而增加,Bacteroides最大暴露剂量组最高,为28.1%;Lactobacillus最大暴露剂量组为8.1%。

