化痰活血扶正方拆方后的相关药组对肝纤维化大鼠α-SMA、FN表达的影响※
郑保平 肖 海 林唐唐 唐 杨 刘海华
(赣南医学院第一附属医院中医科,江西 赣州 341000)
各种慢性肝病进展到肝硬化必经的、共同的病理阶段是肝纤维化,它以结缔组织异常增生,细胞外基质过度沉积为病理特征。普遍认为,抗肝纤维化的治疗是延缓或阻止各种慢性肝病进展的重要手段。经过大量文献研究及临床观察,在对肝纤维化基本病机全面梳理认识的基础上,认为肝纤维化发生发展过程中“痰、瘀、虚”贯穿于疾病的始终,因此在本病的治疗上“化痰”与“活血化瘀”“扶养正气”同等重要,不可偏废。前期通过对慢性乙肝肝纤维化患者的干预研究发现,临床拟定了化痰活血扶正方有较好的临床疗效[1]。本研究拟通过动物实验研究着重探讨化痰活血扶正方及其拆方后的相关药组对肝纤维化大鼠α-SMA、FN表达的影响。
1 材料与方法
1.1 药物及试剂 本实验所用的中药饮片均购自江西省赣州市协记大药房有限公司;秋水仙碱片,云南植物药业公司生产,批号:20170101; 硫代乙酰胺 (Thioacetamide,TAA),批号 172502-500G。FN抗体,博士德,货号:BA1772;α-SMA,博士德,货号:BM0002;Masson三色染色试剂,索莱宝,货号:G1340-100。
1.2 实验动物及分组 选用 SD雄性大鼠(清洁级)120只,体质量(80+10)g,购自湖南斯莱克景达实验动物有限公司(动物许可证号:SCXK(湘) 2013-0004,合格证号:43004700022265)。随机分为空白对照组、水飞蓟宾组、模型组、化痰药低剂量组、化痰药中剂量组、化痰药高剂量组、活血药低剂量组、活血药中剂量组、活血药高剂量组、扶正药低剂量组、扶正药中剂量组、扶正药高剂量组、化痰活血扶正药低剂量组、化痰活血扶正药中剂量组、化痰活血扶正药高剂量组,每组8只。分笼饲养,每笼4只,自由摄食饮水适应性喂养7天,自然光线,湿度30%~50%,温度20~26℃。
1.3 实验方法
1.3.1 药物制备 将中药饮片按照功效及主治分为:化痰药组(白芥子、半夏、茯苓、陈皮、甘草等)、活血化瘀药组(莪术、丹参、桃仁等)、扶正药组(黄芪、党参、当归、白术等)、化痰活血扶正方组。每组药物均水浸过药面2 cm并浸泡12 h以上、第1遍,加水3 L,300℃,1 h煮开;第2遍,加水1.5 L,300℃,40 min煮开。每遍煮开后200℃续煎30 min。2次合液,旋转蒸发仪浓缩至1000 mL。置4℃冰箱备用,使用前按要求配成所需浓度。
1.3.2 造模及给药 除正常组外其余大鼠均腹腔注射 4%TAA(水为溶剂) 5 mL/kg体质量,剂量 200 mg/kg,每周2次,持续8周,复制大鼠肝纤维化模型。造模的同时各低、中、高剂量组分别按照 0.25、0.5、1.0 g/kg剂量,按1 mL/100 g体质量不同浓度的药物灌胃;正常组、模型组予以生理盐水,等体积灌胃;阳性药物组给予水飞蓟宾50 mg/kg体质量灌胃,日1次;给药8周。
1.3.3 标本采集与处理 造模及用药的第8周后取各组所有剩余大鼠,每次均禁食 12 h后称重,10%的水合氯醛腹腔注射麻醉后,冰盒上处死大鼠,取部分肝右叶组织,10%甲醛常规固定、梯度乙醇脱水、二甲苯透明、石蜡包埋。
1.3.4 病理组织学观察 石蜡包埋组织,4 μm厚切片,分别行Masson染色。光镜下观察各组肝组织病理组织学变化。
1.3.5 免疫组化检测α-SMA、FN蛋白的表达 采用免疫组化SP法,鼠抗鼠α-SMA单克隆抗体及FN抗体均以1∶100稀释,DAB显色,苏木素复染PBS代替一抗作为阴性对照,阳性组织呈棕色,阴性组织呈蓝色。在自动图像分析系统上,采用HPIAS-2000型图像分析软件进行定量分析,随视选取每张切片10个视野(×200)倍测定阳性细胞的灰度值与所占视野面积的比,即平均光密度。1.3.6统计学方法 统计学分析使用 SPSS 13.0软件。各测量指标的数据以(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 正常组大鼠食欲好、毛发光泽、活动灵敏,体质量增加明显;模型组大鼠进食少,体质量增长慢,活动少,反应迟钝,毛发干枯稀疏,部分大鼠毛发有结;其余各组大鼠较模型组相比在精神、毛发、活动、食欲方面均有不同程度的改善。
2.2 肝组织α-SMA、FN表达及胶原面积百分比的影响 免疫组化检查显示模型组α-SMA、FN的平均光度值较空白对照组显著升高,结果有统计学意义(P<0.01);各中药治疗组α-SMA、FN的平均光度值较模型组显著下降,结果有统计学意义(P<0.05),其中以化痰活血扶正全方组及活血化瘀高剂量组为优。模型组 Masson染色胶原面积百分比与空白组比较显著升高,结果有统计学意义(P<0.01);各中药治疗组的胶原面积百分比较模型组显著下降,结果差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠肝组织中α-SMA、FN表达、胶原面积百分比水平比较 (±s,8W)
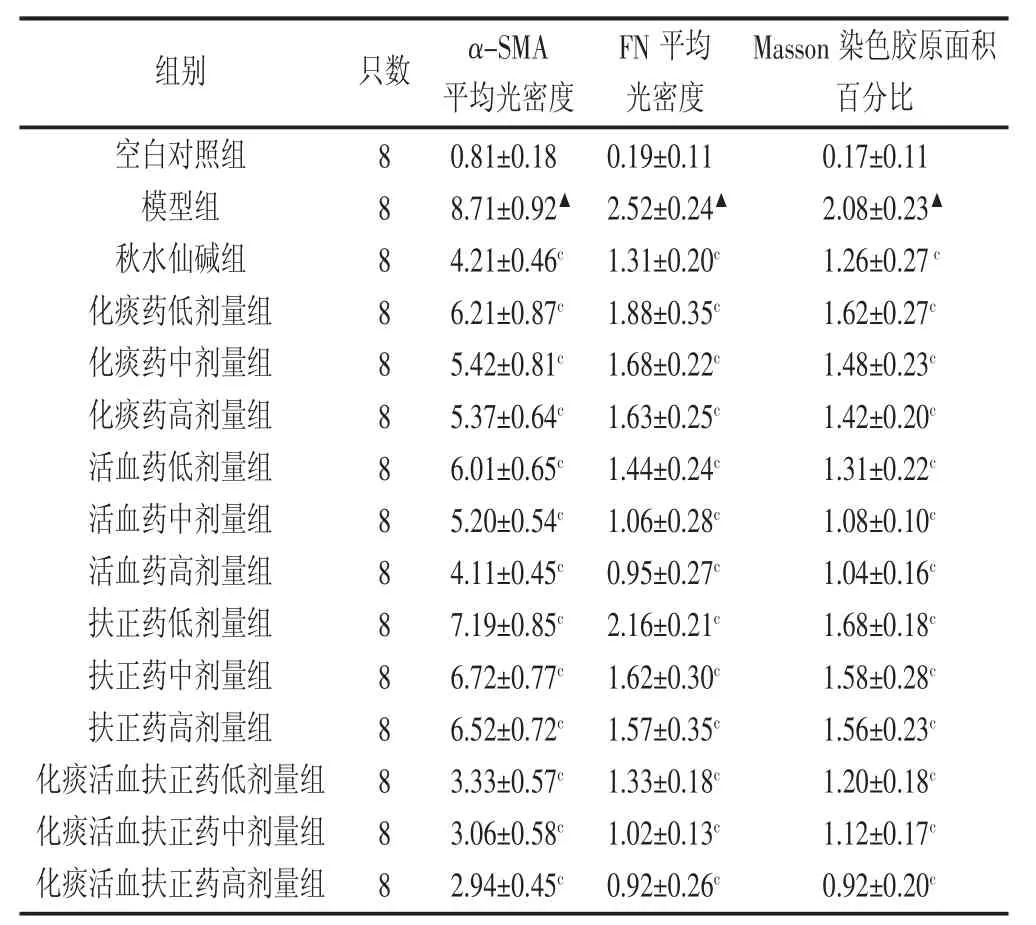
表1 各组大鼠肝组织中α-SMA、FN表达、胶原面积百分比水平比较 (±s,8W)
注:与正常组相比较,▲P<0.01;与模型组比较,cP<0.05
Masson染色胶原面积百分比0.17±0.11 2.08±0.23▲1.26±0.27c 1.62±0.27c 1.48±0.23c 1.42±0.20c 1.31±0.22c 1.08±0.10c 1.04±0.16c 1.68±0.18c 1.58±0.28c 1.56±0.23c 1.20±0.18c 1.12±0.17c 0.92±0.20c组别 只数 α-SMA平均光密度FN平均光密度空白对照组模型组秋水仙碱组化痰药低剂量组化痰药中剂量组化痰药高剂量组活血药低剂量组活血药中剂量组活血药高剂量组扶正药低剂量组扶正药中剂量组扶正药高剂量组化痰活血扶正药低剂量组化痰活血扶正药中剂量组化痰活血扶正药高剂量组8 8 8 8 8 8 8 8 8 8 8 8 8 8 8 0.81±0.18 8.71±0.92▲4.21±0.46c 6.21±0.87c 5.42±0.81c 5.37±0.64c 6.01±0.65c 5.20±0.54c 4.11±0.45c 7.19±0.85c 6.72±0.77c 6.52±0.72c 3.33±0.57c 3.06±0.58c 2.94±0.45c 0.19±0.11 2.52±0.24▲1.31±0.20c 1.88±0.35c 1.68±0.22c 1.63±0.25c 1.44±0.24c 1.06±0.28c 0.95±0.27c 2.16±0.21c 1.62±0.30c 1.57±0.35c 1.33±0.18c 1.02±0.13c 0.92±0.26c
2.3 病理组织学改变 Masson染色后光镜观察,对照组汇管区及小叶间隔见少量蓝色胶原纤维,模型组蓝色胶原纤维明显增多,汇管-中央静脉区纤维间隔增宽,包绕、分隔肝小叶明显,部分形成假小叶。化痰活血扶正方及拆方后的各组及秋水仙碱组与模型组相比:肝细胞变性、坏死,纤维组织增生、炎细胞浸润程度等减轻明显(见图1~15)。
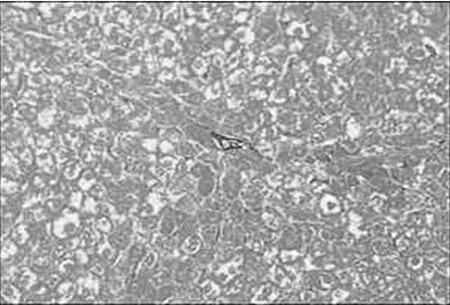
图1 正常组
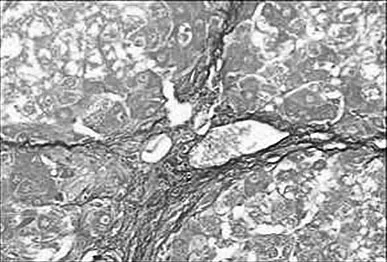
图2 模型组
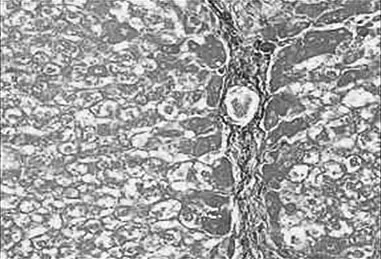
图3 水飞蓟宾组
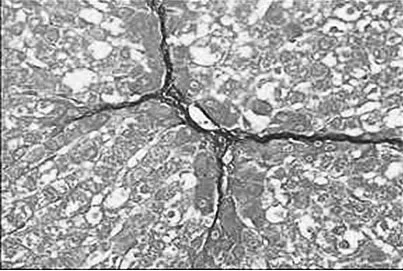
图4 化痰低剂量组
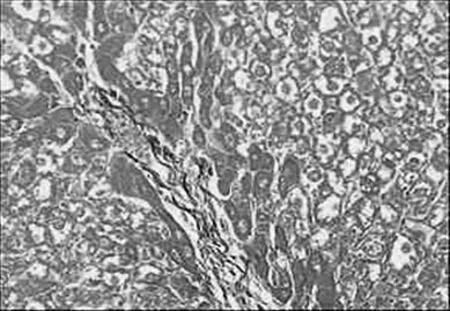
图5 化痰中剂量组
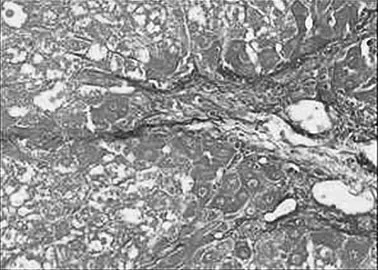
图6 化痰高剂量组
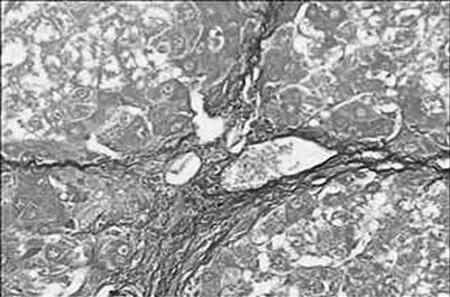
图7 活血化瘀低剂量组
图8 活血化瘀中剂量组
图10 扶正低剂量组

图11 扶正中剂量组
图12 扶正高剂量组
图13 化痰活血扶正低剂量组
图14 化痰活血扶正中剂量组
图15 化痰活血扶正高剂量组
3 讨论
虽然学者们一致认为早期有效地干预肝纤维化的进程便能阻断肝硬化的形成,但尚无安全有效的治疗药物。中医药长期防治“黄疸”“胁痛”“积聚”“臌胀”等(多与现代医学的“肝炎”“肝硬化”等疾病相关)理论总结和处方用药经验,为当今中医药抗肝纤维化研究提供了线索和捷径。肝纤维化的主要形成机制为肝细胞和内皮细胞的慢性炎症损伤,使得肝星状细胞活化、增殖、过度分泌,最终合成大量细胞外基质参与到肝纤维化的发生和发展之中[2]。α-SMA作为HSC活化的特有标志性蛋白,与HSC增殖、肝纤维化程度呈正相关,α-SMA可作为HSC是否激活的重要标志物[3]。其表达强度的变化与肝纤维化程度相关[4]。随着α-SMA表达的增多,肝纤维化的程度随之加重[5]。另外,ECM异常增多是肝纤维化发生与发展的主要病理基础[6]。FN是广泛存在于肝脏中的大分子糖蛋白,和胶原纤维分布在一起[7]。它作为ECM的一种,在肝纤维化过程中起着直接或间接的重要作用[5]。首先,FN 可作为其它基质蛋白的支架[8];其次,FN具有调节贮脂细胞的作用,其水平升高可以加强吞噬作用,但同时也会破坏功能性基底膜,破坏贮脂细胞静止状态,进而导致贮脂细胞表型发生改变[9]。本研究显示,用药8周后,中药各治疗组HE染色后的大鼠肝脏病理切片光镜下观察均较模型组大鼠肝组织在炎细胞浸润程度、变性坏死、纤维增生等方面有明显减轻,表示各干预治疗的中药对肝纤维的形成和发展均有一定的阻断作用。同时,化痰活血扶正方及其拆方后的相关药组能够有效减低模型大鼠肝脏组织中α-SMA、FN的表达及Masson染色后的胶原面积百分比。这说明化痰活血扶正方及其拆方后的相关药组可能是通过抑制HSCs的激活及ECM的合成而起到延缓或逆转肝纤维化向肝硬化的进程。

