谷氨酰胺酶基因的克隆、表达和酶学性质研究
张美丹,饶志明,张 显,杨套伟,徐美娟
(江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
谷氨酰胺酶(EC 3.5.1.2)能够催化L-谷氨酰胺水解形成L-谷氨酸和氨。谷氨酰胺酶主要分布在微生物和哺乳动物细胞中。哺乳细胞谷氨酰胺酶在能源和氮源代谢中起关键作用,因此,传统意义上被认为是一种线粒体酶[1]。哺乳动物谷氨酰胺酶通常被分为两个类型:肝型和肾型,肝型谷氨酰胺酶和肾型谷氨酰胺酶均能够被一定浓度的磷酸盐激活[1-3]。谷氨酰胺酶在微生物中分布很广,已经被报道过的菌体有:大肠杆菌(Escherichia coli)[4]、芽孢杆菌(Bacillus licheniformis,Bacillus sp.LKG-01)[5-6]、乳杆菌(Lactobacillus reuteri KCTC3594)[7]、青霉菌(penicillium politans NRC510)[8]、米曲霉(Aspergillus oryzae RIB40)[9]和酵母(Zygosaccharomyces rouxii,Zygosaccharomyces rouxii NRRL-Y 2547)[10-11]等。自然界中不同来源的谷氨酰胺酶的酶学性质具有很大的差距,因此谷氨酰胺酶的应用相应的也有所不同。目前,谷氨酰胺酶的研究主要集中在制药和食品工业中。在药物方面,谷氨酰胺酶被用于抗癌制剂研究,癌细胞没有L-谷氨酰胺合成机制,通过谷氨酰胺酶消耗体内环境中的谷氨酰胺,从而使得癌细胞因缺乏谷氨酰胺而被“饿死”[12-13]。在食品行业(尤其是酱油发酵)中,耐盐性谷氨酰胺酶一直是研究的热点[14-21]。酱油在发酵过程中,会有很大部分的谷氨酰胺因遇高温转变成焦谷氨酸,这很大的程度上影响了酱油的风味和营养。因此,在发酵过程中额外添加谷氨酰胺酶,从而增加谷氨酸、减少焦谷氨酸的生成从而提高了酱油的风味和营养[17-22]。也有研究者们将谷氨酰胺酶用于茶氨酸的合成[23-24]。
本研究通过将实验室保藏的一株枯草芽孢杆菌作为谷氨酰胺酶基因的来源,将其在枯草芽孢杆菌168(Bacillus subtilis 168,BS168)中进行克隆、表达,并对其酶学性质进行了研究,随后对重组菌在5 L 发酵罐进行了分批补料发酵研究。
1 材料与方法
1.1 实验材料
枯草芽孢杆菌是本实验室的一株保藏菌;大肠杆菌JM109(Escherichia coli,E.coli JM109)、枯草芽孢杆菌168、表达载体pMA5 均为实验室所有;连接载体pMD-18T、PCR 酶相关试剂、T4 DNA 连接酶以及所有的限制性内切酶BamH I 和Nde I 等都在TaKaRa 公司上购买;细菌全基因组快速提取试剂盒、质粒快速提取试剂盒、胶回收试剂盒和引物合成等都来自上海生工生物工程股份有限公司;其他试剂均为国产;SBA-40E 谷氨酸-葡萄糖分析仪买自山东科学院生物研究所;AKTA 蛋白纯化层析系统在GE Healthcare 公司购买。
1.2 实验方法
1.2.1 基因组提取,ylaM 基因的克隆 枯草芽孢杆菌基因组提取的方法参考细菌基因组DNA 快速提取试剂盒说明书。引物设计序列:ylaM-F:5`-ACCGCATATGATGGTATGCCAGCATAATGAT -3`,下划线为Nde I;ylaM-R:5`-ACCGGGATCCTTAGT GGTGGTGGTGGTGGTGAAAAATACTCAGCCTGT -3`,下划线分别为BamH I 和组氨酸标签。PCR 扩增体系中包括0.5 μL 全基因组DNA;5 μL 10×Buffer;4 μL dNTP Mixture;0.5 μL 上下引物;1 μL E Taq DNA 聚合酶;ddH2O 补至50 μL。PCR 反应条件为:95 ℃预变性5 min ;94 ℃变性30 s,58 ℃退火1 min,72 ℃延伸1 min,30 个循环;最后72 ℃延伸10 min。PCR 产物进行胶回收纯化后与pMD18-T载体进行连接,接着连接产物转化到E.coli JM109感受态细胞中,在含有100 μg/mL 氨苄青霉素(Amp)的LB 平板上进行筛选获得阳性转化子,提取质粒进行单双酶切验证并进行测序。
1.2.2 重组质粒的构建和转化 将pMD18T-ylaM和pMA5 分别用BamH I 和Nde I 进行双酶切,将所切的目的片段和载体进行回收纯化,将纯化后的目的基因ylaM 和载体pMA5 片段并使用T4 DNA 连接酶进行连接,然后放置16 ℃连接过夜。连接产物通过化学转化法转入E.coli JM109 感受态中,通过带有100 μg/mL Amp 的LB 平板筛选阳性重组菌体E.coli JM109/pMA5-ylaM,提质粒通过相应的酶切位点验证重组载体。将重组子pMA5-ylaM 再通过文献[25]所使用的化学转化法转入枯草芽孢杆菌168 中,通过带有50 μg/mL 卡那霉素的LB 平板筛选阳性重组菌BS168/pMA5-ylaM,提质粒通过单双酶切验证是否有重组子转进去。
1.2.3 重组菌的谷氨酰胺酶表达和纯化 将重组菌体BS168/pMA5-ylaM 先接入10 mL LB 培养基中,在37 ℃,180 r/min 下培养8~12 h,之后转入发酵培养基(g/L):葡萄糖25、酵母粉21、蛋白胨14、谷氨酸2、K2HPO41.25、KH2PO40.75、MgCl21、pH 6.9~7.0,在30 ℃、180 r/min 的条件下发酵培养20 h。使用4 ℃低温离心机离心收集菌体(4 ℃,10 000 g,10 min),将离心所得的重组菌体使用50 mmol/L Tris-HCl(pH 7.5)缓冲液悬洗2~3 次,之后根据生物量使用50 mmol/L Tris-HCl(pH 7.5)缓冲液将菌体定容至相应的体积进行悬浮。细胞悬液中加入20 μL 200 g/mL溶菌酶(lysozyme),放置冰盒或者4 ℃冰箱作用2~3 h左右,待菌体呈蛋清状之后将处理液放入超声波破碎仪中超声10 min 左右,将细胞破碎液离心(4 ℃,10 000 g,20 min),取上清。获得的细胞上清过膜处理之后使用Ni-NTA 亲和色谱法纯化N-末端加入His-tag 的谷氨酰胺酶,清洗、上样和洗脱过程根据公司所提供的仪器操作步骤来进行。将细胞上清液和纯化后的谷氨酰胺酶用于酶活测定和SDSPAGE 分析。
1.2.4 谷氨酰胺酶的酶活测定 谷氨酰胺酶酶活通过L-谷氨酸的生成量来测定。酶活测定方法:将440 μL 100 mmol/L 谷氨酰胺溶液和440 μL 100 mmol/L Tris-HCl 缓冲液进行混合,接着放入37 ℃的水浴锅中5 min,加入20 μL 的酶液在水浴锅中发应5 min 后,迅速加入100 μL 的反应终止液(15%的三氯乙酸)上下震荡混匀,之后将反应物放入离心机中离心(10 000 g,15 min)[26]。取反应物的上清液25 μL 打进谷氨酸-葡萄糖分析仪中进行谷氨酸测定。谷氨酰胺酶的酶活单位定义为,在37 ℃、pH 7.5 的条件下,每分钟生成1 μmol 的谷氨酸所需要的谷氨酰胺酶的量。
1.2.5 酶学性质研究 反应最适pH 和pH 稳定性研究:使用不同pH 的反应体系(缓冲液:pH 5.0~6.0,0.1 mol 醋酸-醋酸钠;pH 6.0~7.0,0.1 mol 磷酸盐;pH 7.0~8.0,0.1 mol Tris-HCl;pH 8.0~9.5,0.1 mol甘氨酸-NaOH)进行酶活测定,最大酶活定义为100%。在4 ℃条件下,将储存在不同pH 缓冲液的酶液放置一段时间,每隔2 h 后进行一次酶活测定,将最初谷氨酰胺酶的酶活定义为100%。
反应最适温度和热稳定研究:将谷氨酰胺酶反应体系放置在不同温度(20~65 ℃)的水浴锅中先预热10 min,之后加入20 μL 的酶液反应5 min,迅速加入100 μL 的反应终止液(15%的三氯乙酸),最大酶活定义为100%。在4、20、25 ℃和30 ℃保温12 h,每隔2 h 取样并进行酶活测定,将未加热的谷氨酰胺酶酶活定义为100%。
金属离子和EDTA 对酶活的影响:在谷氨酰胺酶反应体系中分别加入1 mmol/L 的金属离子EDTA、K+、Fe3+、Mg2+、Ca2+、La3+、Ba2+等金属离子,接着进行谷氨酰胺酶的酶活测定,未加入金属离子的谷氨酰胺酶活定义为100%。
耐盐性测定和高盐条件对酶稳定性的影响:谷氨酰胺酶反应体系中分别加入不同浓度的NaCl(0~20%),之后进行酶活反应并分析谷氨酸的生成,未加入NaCl 反应的谷氨酰胺酶酶活定为100%。在4℃条件下,将储存在不同盐浓度下的酶液放置一段时间,每隔0.5 h 后进行一次酶活测定,将最初在不同盐浓度下的谷氨酰胺酶的酶活定义为100%。
1.2.6 5 L 罐发酵培养 取冻管中的菌液进行划平板,挑取单菌落至10 mL 的LB 培养基中进行培养10~12 h(37 ℃,180 r/min),接取10%的菌液转入150mL的LB 种子培养基培养10~12 h(37 ℃,180 r/min)。将上述培养液接入含有2 L 发酵培养基的5 L 发酵罐中进行培养,在温度30 ℃,转速600 r/min,pH 7.0(pH 由30%的氨水和10%的磷酸进行酸碱调控)的条件下进行培养。补料措施为:碳源为50%的葡萄糖,氮源为50%的酵母粉,前18 h 发酵条件同前面,18 h 后进行自动补料,每个小时补充3 g/L 的碳源和2 g/L 的氮源。每隔一段时间进行取样,进行生物量和酶活测定。
2 结果与讨论
2.1 重组载体的构建和表达
以枯草芽孢杆菌全基因组作为模板进行PCR,通过电泳得到的目的基因大小为0.93 kb,将纯化后的目的基因与pMD18T 连接转入E.coli JM109 感受态细胞中,在抗性平板中挑取阳性转化子,酶切验证并进行测序。接着使用BamH I 和Nde I 将目的基因与载体pMA5 切下并进行连接转入枯草芽孢杆菌168 中,在抗性平板中挑选阳性转化子验证。重组质粒pMA5-ylaM 经BamH I 单切大小为8.4 kb,BamH I 和Nde I 双切的大小分别为7.5 kb 和0.93 kb(图1)。将构建好的重组菌B.subtilis/pMA5-ylaM 进行发酵表达,获得的粗酶过镍柱纯化,将纯化后的重组蛋白进行SDS-PAGE 分析,纯化后的蛋白大小为32 kDa 左右(图2)。
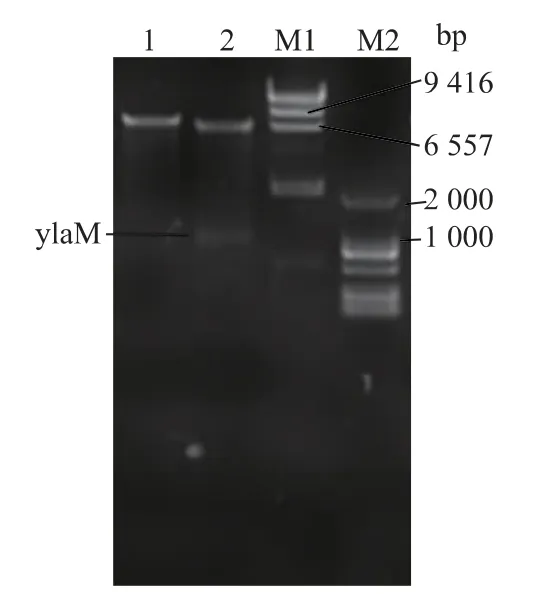
图1 重组质粒的酶切验证Fig.1 Enzyme digestion of recombinant plasmid

图2 重组蛋白酶的SDS-PAGE 电泳分析Fig.2 SDS-PAGE analysis of the purified glutaminase form recombinant
2.2 谷氨酰胺酶的酶学性质研究
2.2.1 反应最适pH 和pH 稳定性研究 在不同pH下测得的谷氨酰胺酶活并获得一条曲线,从图3(a)获知,在pH 7.5 的缓冲液下,谷氨酰胺酶酶活最适。在4 ℃条件下,每隔2 h,在不同pH 取样测酶活获得pH 的稳定曲线,如图3(b)所示,该谷氨酰胺酶在pH 6.5~8 之间稳定性很好,而低于pH 6.0 或高于8.5 时,酶活力有所下降。
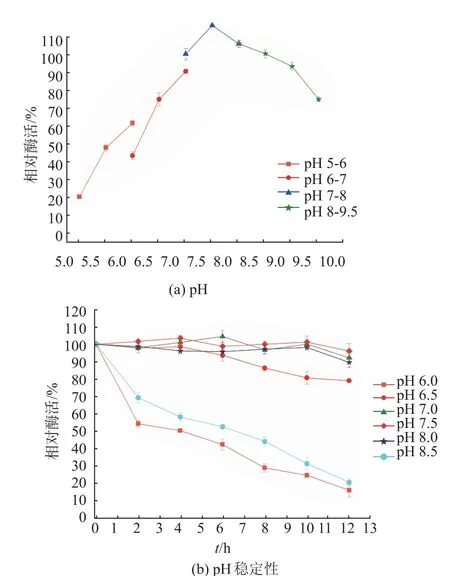
图3 谷氨酰胺重组酶的最适pH 和pH 稳定性Fig.3 Optimal pH and pH stability of the recombinant glutaminase
2.2.2 反应最适温度和热稳定性研究 在不同的反应温度下,测谷氨酰胺酶活。从图4(a)可知,谷氨酰胺酶的最适温度是55 ℃。随着温度升高,酶活力有所上升;当温度超过55 ℃时,酶活力下降。由图4(b)所示,在低温条件下保存对酶活力影响不大,当温度为大于30 ℃时,酶活力下降就明显了。

图4 谷氨酰胺酶最适温度和热稳定性Fig.4 Optimal temperature and thermal stability of the recombinant glutaminase
2.2.3 金属离子和EDTA 的影响 从图5 分析金属离子对谷氨酰胺酶活的影响得知,La3+、Zn2+、Fe3+和Al3+对谷氨酰胺酶活力具有一定程度上的抑制作用,部分金属离子对其有促进作用,但是效果不是很明显。

图5 金属离子和EDTA(1 mmol/L)对酶活的影响Fig.5 Effect of metal ion(1 mmol/L)on glutaminase activity
2.2.4 谷氨酰胺酶的耐盐性研究 反应体系中不同浓度的NaCl 条件下所测得的谷氨酰胺酶酶活曲线如图6 所示,随着反应体系中NaCl 的浓度的不断升高,相对酶活相应的下降。但是,在15%~17.5%的NaCl 条件下,残余酶活力依然有50%以上,说明该谷氨酰胺酶具有一定的耐盐性。在4 ℃条件下,每隔0.5 h,在不同盐浓度下取样测酶活获得高盐条件下谷氨酰胺酶的稳定曲线,如图7 所示,该谷氨酰胺酶在12.5%~17.5%NaCl 之间稳定性很好,当盐浓度为20%时,3 h 后,谷氨酰胺酶的相对酶活力仅下降了34.76%左右。

图6 不同浓度的NaCl 对酶活的影响Fig.6 Salt to lerance of recombinant glutaminase
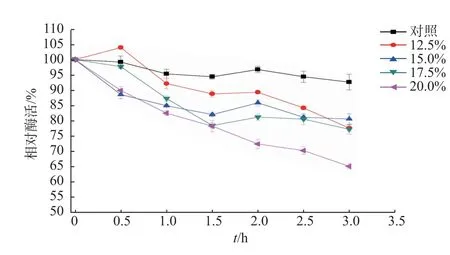
图7 高盐对谷氨酰胺酶稳定性的影响Fig.7 Effects on stability of glutaminase in the high concentration of salt
2.3 5 L 罐发酵结果
5 L 罐的分批发酵结果如图8(a)所示,随着重组菌体的生长酶活产量也有所增长,当葡萄糖消耗的差不多时菌体也不再增长。重组菌发酵18 h,重组菌细胞干重(CDW)和谷氨酰胺酶比酶活最高分别达到了4.51 g/L 和58.61 U/mL,24 h 后菌体不再生长而谷氨酰胺酶酶活有稍微的下降。在此基础上,进一步的补料发酵结果如图8(b)所示,发酵18 h后在残糖为4~5 g/L 时进行补料,每小时添加3 g/L的碳源和2 g/L 的氮源,重组菌体和酶活产量也有所增加,细胞干重最高将近有23.36 g/L,发酵54 h时谷氨酰胺酶最高酶活产量达到了215.06 U/mL。相比较分批发酵结果,分批补料发酵的谷氨酰胺酶酶活产量提高了3.67 倍,细胞干重增加了5.18 倍。

图8 5 L 罐发酵和补料发酵结果Fig.8 Fermentation and fed -batch fermentation of glutaminase in 5 L fermenter
3 结语
本研究枯草芽孢杆菌来源的谷氨酰胺酶在枯草芽孢杆菌168 中得到了有效的表达,纯化后比酶活达到了939.47 U/mg。谷氨酰胺酶在15%~17.5%的高盐浓度下相对酶活高于50%,表明了该谷氨酰胺酶具有比较好的耐盐性。食品业中,酱油的含盐量通常为14%~18%[15],这很大程度上限制了一般的谷氨酰胺酶应用。本研究获得的重组谷氨酰胺酶克服了在高盐浓度下易失活的缺点,为下一步在食品工业中的应用研究奠定了基础。本研究直接采用了葡萄糖-谷氨酸分析仪对酶活产物进行测定分析,该方法相比较谷氨酰胺酶测定试剂盒和高效液相色谱法对酶活测定更加的简单、快速和稳定,这为之后的发酵控制研究提供了便利和可操作性。发酵18 h 后,通过每个小时添加3 g/L 的碳源和2 g/L 的氮源进行补料发酵,谷氨酰胺酶的酶活产量在54 h能达到215.06 U/mL。

