改良经腹膜后入路腹腔镜肾部分切除术治疗巨大囊性肾癌的解剖程序化操作体会
曲发军,潘秀武,刘 溪,黄 海,杨启维,叶剑青,干思舜,储传敏,崔心刚
(1.第二军医大学第三附属医院,上海,200438;2.第二军医大学附属公利医院)
随着腹腔镜手术的日益普及与开展,腹腔镜肾部分切除术越来越受到泌尿外科医师的重视与青睐。除常规T1a期肾肿瘤可行腹腔镜肾部分切除术外,对于某些T1b期的肾肿瘤,也可在术者技术熟练的基础上行腹腔镜肾部分切除术。2014年中国泌尿外科疾病诊断治疗指南指出,治疗T1N0M0期肾癌患者的首选方案为肾部分切除术,同时也指出,对于T1bN0M0的患者,肾部分切除术与肾癌根治性切除术在临床疗效方面并无差异[1]。但在临床工作中,我们也会遇到一些特殊病例,其中囊性肾癌的诊断与治疗显得尤为突出。对于肾囊性占位性质的判断是决定何时手术干预的前提,选择恰当的手术方案是治疗成功的关键。我中心采取改良经腹膜后入路行腹腔镜下肾部分切除术治疗巨大囊性肾癌,取得了较好的疗效,现将体会报道如下。
1 资料与方法
1.1 临床资料 2016年1月至2018年1月我中心共收治12例巨大囊性肾占位患者,肿瘤最大径56~78 mm。其中男5例,女7例,平均(45.1±13.2)岁;左侧5例,右侧7例。 4例患者术前有腰酸症状,其余患者术前无不适、为常规体检时发现肾囊性占位。术前结合CT、MRI检查考虑为囊性肾癌(图1),参照Bosniak分型标准分类[2]:Ⅲ型10例,Ⅳ型2例。患者行肾动脉CTA检查,明确肾动脉分支血供情况;行肾小球滤过率检查,评估分肾功能。
1.2 手术方法
1.2.1 建立后腹腔操作空间 均采用经腹膜后入路施术。全身麻醉后患者取健侧卧位,调整手术床使患者处于头低足低折刀位,腰部垫高。患侧下肢伸直,健侧下肢呈屈曲位,双腿间垫厚垫,使之保持无张力状态。腋后线12肋缘下做2 cm纵切口,依次切开皮肤、皮下组织,自切口垂直置入血管钳,使之穿透腰背筋膜,穿透后可明显感到突破感,钝性分离肌肉、腰背筋膜。置入食指,将腹膜推向腹侧,将腹膜外脂肪向腹侧推移。置入自制气囊扩张器,充入800~1 000 mL气体,维持2~3 min后取出,以此扩张腹膜后间隙。分别于腋前线肋弓下2 cm处、腋中线髂嵴上2 cm处做小切口,腋前线切口穿刺5 mm Trocar(左侧)或12 mm Trocar(右侧),腋后线切口穿刺10 mm Trocar,缝合此切口防止漏气,并妥善固定套管。充入CO2建立气腹,压力维持在13~15mmHg。
1.2.2 腹腔镜视野下的操作 清除腹膜外脂肪,将其暂时置入视野下方。仔细辨别腹膜返折部位,近肾上极部位打开侧锥筋膜,沿肾周脂肪、腰大肌前方疏松组织分离出约3 cm的腔隙,将腹膜外脂肪置入。继续向下切开侧锥筋膜近肾脏下极边缘约3 cm处,分离显露此处的肾旁后间隙及输尿管上段,将之前腹膜外脂肪拉入其内妥善安放。这样操作的好处是尽可能避免了腹膜外脂肪对手术视野的干扰,尤其肥胖患者尤为重要。用Hem-o-lok将侧锥筋膜的上下两个边缘分别与腹侧腹膜、背侧腰背筋膜固定,起到扩大暴露手术视野的作用。沿肾脏背侧分离,逐渐向深面分离,直至显露肾动脉,环绕血管吊带以备阻断(图2)。根据术前影像学检查在相应部位寻找肿瘤,沿肿瘤表面小心细致分离,注意不能强行挤压或牵拉肿瘤,防止肿瘤囊壁破裂。本研究中囊性占位的直径均较大,属于巨大囊性肾癌,因此在腹腔镜操作下不能完全游离出完整的肿瘤边界。此时即转为后续的传统开放手术操作。
1.2.3 开放视野下的操作 延长背侧切口,依次切开皮肤、皮下脂肪、腰背筋膜与肌层,用切口保护套保护切口,防止肿瘤种植转移。沿之前分离的肿瘤区域继续进行有效分离,直至完全显露肿瘤的外生部分。寻及肾动脉吊带,准备阻断肾动脉。在完全长时间阻断前,行肾脏缺血预适应操作。具体如下:完全阻断全部肾动脉10s后恢复血供10s,重复6个循环。之后,再次完全阻断肾动脉,沿肿瘤边界正常肾实质0.5~1 cm处行肾部分切除术(图3)。对于内生部分较大的肿瘤,不可避免会切破肾实质血管、部分肾盂,此时在渗血较多的情况下,需要助手及时吸净术区出血,保证视野良好,防止误操作切破肿瘤囊壁。完整切除肿瘤后,创面上血管断端及渗血严重部位用电刀初步电凝止血。在完整切除肿瘤的前提下,尽可能保留较多的正常肾实质,为后续缝合打基础。本研究中肿瘤切除后肾脏创面较大,因此必须做到创面缝合的确切有效。在“2+1”缝合技术的基础上,我们延伸为“n+1”的缝合操作,具体如下:将肾盂肾盏破口进行有效缝合,一方面防止术后发生漏尿;另一方面防止出血涌入破口,无法形成血肿压迫、失去一般情况下机体自限性止血的功能;用3-0可吸收倒刺线缝合肾脏内层创面,缝合时注意层层递进,逐渐减少创面的对合张力,最终达到减张缝合的目的;用2-0可吸收倒刺线缝合肾脏外层创面,先自上而下,然后自下而上,最终形成多个外观呈“交叉式”的缝合状态(图4)。开放肾脏血流,观察创面渗血情况,用2-0倒刺线加固缝合外层创面。因创面较大,切除、缝合时间较一般手术长,当肾血流完全阻断超过30 min时,用厚纱垫填塞压迫创面,开放肾动脉血流30 s后再重新阻断。用生理盐水、无盐水反复冲洗术区,仔细检查无活动性出血后留置负压引流管,逐层缝合切口。

图1 术前CT影像
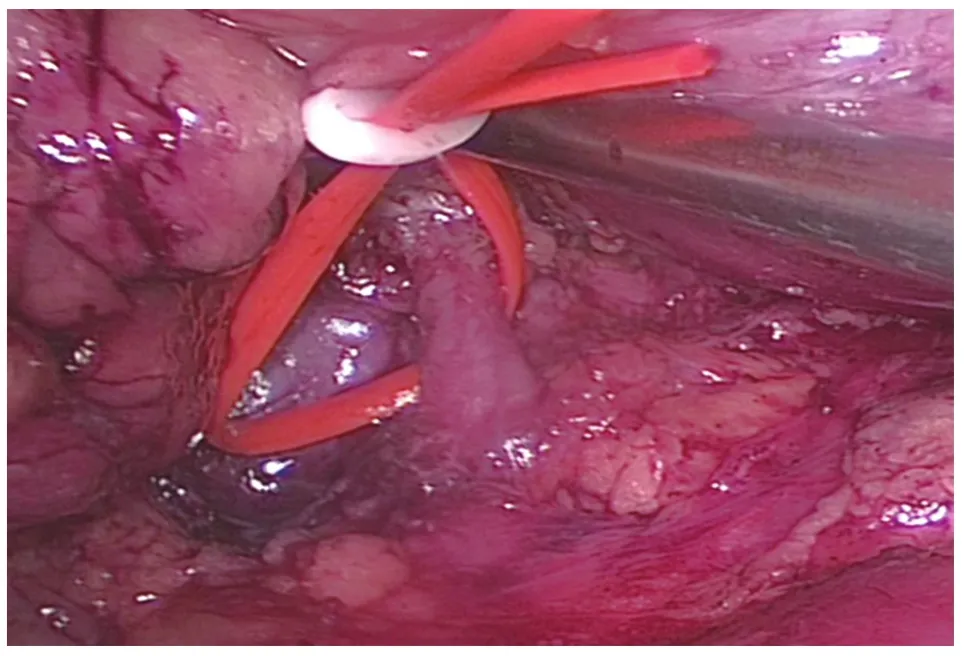
图2 腹腔镜视野下游离肾动脉

图3 开放视野下切除肿瘤

图4 开放视野下缝合肾脏创面
2 结 果
12例患者均按计划顺利完成手术。手术时间平均(130.5±30.4)min,热缺血时间平均(29.1±7.2)min,术中出血量平均(256.5±40.1)mL,术后引流管平均留置(6.5±2.5)d,术后平均住院(7.5±1.5)d。嘱患者术后绝对卧床48 h,术后3个月内禁止剧烈活动。患者均未出现严重出血等并发症。术后病理结果:12例均为透明细胞癌,Fuhrman核分级Ⅰ级10例、Ⅰ~Ⅱ级2例。术后随访2~24个月,未见肿瘤复发或转移影像学表现;患肾肾小球滤过率表现为较术前下降,具体为:5例患者下降幅度小于20%,5例患者下降幅度为20%~30%,2例患者下降幅度为30%~40%。6例患者术后复查存在部分肾盏轻度积水,无腰痛腰胀不适表现。
3 讨 论
相较其他类型的肾脏占位性疾病,囊性肾癌有其特性。临床中囊性肾占位的性质判断一直是泌尿外科学界的难题。囊性肾癌需要与单纯性肾囊肿、复杂性肾囊肿鉴别。B超检查虽然广泛开展,但对于囊性占位的性质通常无法准确鉴别,临床上医师更多地依赖增强CT与增强MRI[3]。对于没有经验或未认真读片的医生而言,很容易误诊或漏诊。笔者曾接诊过囊性肾癌的患者,在外院被误诊为单纯肾囊肿而行腹腔镜肾囊肿去顶减压术,术后病理回报为恶性肿瘤,再次手术行补救性肾切除术。对于囊性肾癌而言,行去顶减压术极易导致肿瘤种植转移,从而产生不可补救的后果。因此一方面临床医生需要增加知识储备,另一方面更重要的是认真读片,绝对不能先入为主,妄下结论。
对于一般大小的肾囊性占位,可行腹腔镜肾部分切除术[4]。但本研究中肾肿瘤较大,直径均超过5 cm,最大近8 cm。我们分析一方面由于囊性肾癌的疾病进展较缓慢,患者自无不适表现;另一方面B超检查多不能准确判断囊性肾癌的性质,仅报告为“单纯性或复杂性肾囊肿”。因此,患者多在“囊肿”接近或超过5 cm进一步治疗时才行肾脏增强CT检查。目前,大多数学者根据Bosniak分级标准来判断囊性肾占位的性质[2,5]。CT、MRI检查一旦高度怀疑囊性肾癌时,下一步医患面临的将是选择何种手术方式。鉴于囊性肾癌的大体积及囊壁菲薄,术中很可能发生囊壁破裂、恶性肿瘤的种植转移,因此大多数情况下选择开放根治性肾癌切除术[6]。传统开放手术尤其根治性肾切除术,我们认为可能存在以下不足:(1)术后病理报告可能为良性病变,对于根治性肾切除术的患者而言,即使术前已充分告知、沟通,而患者或家属可能认为损失了正常肾脏,存在医患发生尖锐矛盾的可能性;(2)开放手术处理肾蒂的过程中,巨大囊性占位可能限制了术者的操作,因此需要扩大切口来弥补操作空间的不足;并且,处理肾蒂的过程中,囊性肾肿瘤的囊壁被挤压破裂的可能性较大,有造成术区、切口肿瘤种植的可能。针对开放手术的不足,结合腹腔镜手术的优点,我们对手术方式进行了改良,开展了改良经腹膜后入路腹腔镜肾部分切除术,其解剖程序化操作过程与体会总结如下:(1)囊性肾癌的恶性程度一般较低[7],而且术后病理报告为良性病变的可能性较其他肾肿瘤大,因此我们采取的手术方式是“保肾手术”。(2)我们选用泌尿外科医师熟悉的经腹膜后入路,先在腹腔镜视野下操作,进行肾动脉的分离及囊性占位的部分分离。因为腹腔镜手术具有图像放大功能,在腔镜视野下操作较开放手术更为精细,因此我们在较小的空间状态下可有效分离出肾动脉,减少了对囊性占位的干扰。(3)巨大的囊性占位使得在腔镜下进行肿瘤切除、创面缝合非常困难,既耗费时间又可能导致肿瘤残留。因此我们重视并发挥传统开放手术的优势,适当延长切口后行开放肾部分切除术。因腔镜操作已分离出肾动脉、部分肿瘤,因此我们仅需适当延长切口即可,减少了手术创伤。与一般腹腔镜手术中转不同,我们是有计划地主动操作,而不是因为各种突发情况采取的被动操作。(4)因为考虑囊性占位巨大,肾血供的阻断时间较其他肾部分切除长,为尽量减少肾热缺血再灌注损伤,我们采取以下措施:冰屑降温,通过低温干预减轻肾脏组织代谢,从而降低细胞需氧量,减轻热缺血损伤。在长时间阻断肾动脉前先行肾脏缺血预处理适应操作,即完全阻断肾动脉10 s后再恢复血供10 s,重复6个循环。缺血预处理是指组织一次或多次反复短暂缺血再灌注,可提高组织对随后长时间缺血所致的灌注损伤的耐受性。肾脏缺血预处理对肾组织损伤有保护作用。目前认为,保护机制主要涉及内源性物质释放、细胞内信号转导、终末效应作用3方面。文献报道,这种操作可显著降低肾缺血再灌注损伤,我们前期的动物实验也证实了这种优势[8-9]。当肾血流阻断时间超过30 min时,我们中途短暂开放一次肾血供,即用厚纱垫填塞压迫创面,开放肾动脉血流30 s后重新阻断。创面缝合时,我们采取“n+1”的缝合技术,在确保创面出血已被控制的前提下,尽早开放肾脏血流[10-11]。(5)创面的有效缝合是保证手术成功的关键。我们重视肾盂肾盏破口的缝合及内、外层创面的分层缝合,最大程度地避免了术后迟发性出血。(6)需要指出的是,虽然本研究中未发生肿瘤囊壁破裂,但我们仍需要重视这种情况的预防与补救措施。除使用切口保护套外,不管肿瘤是否发生破溃,最后均需用大量冲洗液冲洗术区,尽可能防止肿瘤种植转移。(7)术后随访过程中我们发现患肾的肾小球滤过率较术前有所下降,部分患者出现了肾盏扩张积水。分析原因可能为囊性占位体积巨大,为确保切缘阴性,术中切除范围较大;术中肾动脉的阻断时间较一般肾部分切除长,肾热缺血再灌注损伤程度较大;术中切除部分肾盏甚至肾盂,因此术后出现了肾盏扩张积水。在后续的手术与研究中,我们需要针对上述方面进行改良。
综上所述,我们结合腹腔镜手术与开放手术的优势,采用改良经腹膜后入路腹腔镜肾部分切除术治疗巨大囊性肾癌,同时达到了“保肾”、“去瘤”的两个目的,疗效较好。我们认为,此术式提高了手术的有效性、安全性,值得在临床工作中推广应用。

