在线成像结合红外光谱技术对头孢克肟反应结晶过程的工艺优化
于帅 张扬 王学重,*
(1 山东省分析测试中心,齐鲁工业大学(山东省科学院),济南 250014;2 华南理工大学化学与化工学院,广州 510640)
头孢克肟(cefixime),化学名(6R,7R)-7-[(Z)-2-(2-氨基-4-噻唑基)-2-(羧甲氧基亚胺)乙酰胺基]-8-氧代-3-乙烯-5-硫杂-1-氮杂双环(4,2,0)辛-2-2-羧酸三水合物,是一种对于呼吸道感染、尿路感染、耳鼻喉感染具有卓越疗效的第三代口服头孢菌素类抗生素[1],最早由日本藤泽公司研制开发,具有抗菌谱广,半衰期长的特点,目前仍在市场中占据主要地位[2]。
头孢克肟盐与酸反应结晶是工业生产制备头孢克肟工艺中的关键步骤[3],但工业生产中发现由于反应速率快,搅拌不均匀导致局部过饱和度高,结晶后的产品常会出现较大的批间差异,成核速率与晶体生长速率难以控制,引起粒度分布不均匀,产品的储存稳定性差等问题,给实际工业生产带来了极大的困难。同时,与传统的蒸发结晶、冷却结晶以及反溶剂结晶相比,反应结晶由于同时存在反应过程和结晶过程,成核速率极快,传质和相变过程更为复杂[4-5],传统基于亚稳区宽度的晶体生长动力学模型并不适用于反应结晶过程,但目前由于传统离线测量实验方法对该过程测量时间的不匹配性,导致对该过程的理解仍不深入,影响对实际工业优化的指导。
过程分析技术(process analytical technology,PAT),是使用一系列工具,通过设计分析药物生产过程来保证产物的可靠性,提高工作效率的方法。近年来,随着对于过程分析技术研究的深入,PAT技术在药物结晶领域的应用得到了更大的重视。经过近20年的应用、改进和推广,PAT在传统结晶过程的过程工艺条件和产品质量指标表征方面的应用已经取得了一定的进展,证明是一种提高工艺可靠性及工作效率的方法,目前PAT在固体制造过程的各个领域已经获得了世界各国相关部门的大力支持,尤其在药物制造领域[6-7]。在药物结晶领域,该技术主要是应用在线红外或在线紫外来监测溶液中溶质的浓度变化[8-9];应用在线近红外关联药物结晶过程中的固含量等信息;利用在线二维成像技术[10]实时观测药物结晶过程中晶体的生长与团聚等;利用在线浊度来测量超溶解度曲线,进而确定介稳区;利用超声技术实时监测结晶过程中的粒度变化等。目前PAT技术在冷却结晶和反溶剂结晶中应用较为广泛,但是在反应结晶中应用并不多。
本文针对头孢克肟反应结晶过程,尝试使用PAT技术了解和优化反应结晶过程,实验采用单因素法考察了反应结晶过程的反应温度、养晶时刻、养晶时间、加料速率、搅拌速率等工艺条件对头孢克肟粒度分布、白度、结晶度和杂质含量的影响,探寻反应结晶过程晶型转变的规律,目标是优化该工业结晶过程,并解决目前存在的粒度分布、白度和储存稳定性的批间偏差。
1 实验材料与方法
1.1 实验药品
头孢克肟盐料液(广州白云山医药集团股份有限公司白云山化学制药厂);浓盐酸(分析纯,国药集团化学试剂有限公司);去离子水(实验室超纯水机LK-40-01S制备)。
1.2 实验仪器
结晶实验平台[晶格码(青岛)智能科技有限公司(www.pharmavision-ltd.com)],该结晶平台具有温度的在线测量和实时控制功能,包含:2L机械搅拌式反应釜,超级恒温水浴,在线红外浓度测量仪,二维成像系统(2DVP-17V16X200),探头式浊度仪(TURBIDITYPROBE);在线pH计等。
蠕动泵(BT100-2J,兰格恒流泵有限公司),真空干燥箱(上海一恒科学仪器有限公司)。
1.3 实验方法
将1500mL头孢克肟盐澄清料液(溶剂为体积比为水:丙酮=86:14的混合溶剂)加入到2L结晶反应釜中,在一定温度下保温20min,搅拌速率控制在一定转速,以一定加酸速率加入盐酸(4%, wt%)至溶液浑浊,记录初始变浑浊的点(析晶点)的pH值,此时调整盐酸加酸速率并继续滴加至pH值低于析晶点一定值后停止加酸并养晶一定时间;按2mL/min加酸速率继续加盐酸溶液直至溶液pH=2.20后,并将搅拌速率调至100r/min,溶液线性降温到5℃后,继续保温搅拌2h。产物经过滤,去离子水洗涤后放入真空干燥箱,在40℃下真空干燥10h,得到头孢克肟固体颗粒。所有的研究都是在结晶实验平台上进行的,结晶平台如图1所示。
1.4 分析方法

图1 实验装置示意图Fig.1 Schematic representation of the experiment setup
在线分析方法:实时浓度由在线红外浓度测量仪测量,实时图像二维成像系统获取,实时浊度值由探头式浊度仪测量;实时pH值由在线pH计测量。
离线分析方法:颗粒粒度分布测量,进样门高度设定为1,进料时间为10s,样品颗粒粒度取3次测量的平均值;颗粒休止角测量,测试仪顶部进料口加入10g待测颗粒,颗粒通过自由落体滑落到测量平台,通过测试仪自带量角器测量休止角;样品杂质含量测定,流动相为磷酸盐缓冲液:乙腈=86:14,检测波长254nm,流速1.0mL/min,进样量为20μL,杂质定量方法为自身对照法;样品白度测量;样品红外光谱测定,0.5mg待测样品在红外灯下研磨后与干燥后的KBr粉末压片,测定波数范围为400~4000cm-1;样品XRD图谱测定,管压:40KV,管流:40mA,靶材:Cu,入射线波长:0.15418nm,狭缝DS=1/4°,测试温度为25℃,测试角度范围为5~60°;样品SEM图像获取,分辨率:0.6nm(30kV STEM模式),束流:10~40nA;放大倍率:12~2,000,000X;加速电压:0.05~30kV,SE检测器,样品粘贴在带有导电胶的铝板,真空条件下喷铂金后进行测试;样品差示扫描热和热失重测定,测试温度范围为250~600℃,升温速率为10℃/min,N2流速40mL/min,样品量2mg。
1.5 方案设计
采用单因素法考察结晶过程的反应温度、ΔpH、盐酸滴加速率、搅拌速率实验设计如表1所示。

表1 实验设计表Tab. 1 Experimental design table
2 结果与讨论
2.1 实时浓度测量
根据朗伯比尔定律[11],溶质在溶液中的吸光度与溶质的浓度成相关关系,所以衰减全反射红外光谱仪可以将吸光度值与溶液的浓度值关联起来,在实验中起到实时预测体系浓度的作用。本实验以水-丙酮为溶剂,以头孢克肟钠盐为溶质,配制不同浓度的头孢克肟盐溶液,浓度范围为0~110mg/g,梯度间隔为10mg/g,建模温度为25℃(经测试比对发现本体系中温度对吸光度几乎无影响)。图2给出了实验测量的红外吸收光谱,分析图2可知,头孢克肟盐在1250和1370cm-1存在红外吸收特征峰,发现在特征波长的红外吸光度值随头孢克肟盐浓度的增加而增加,所以选作建模用波段为1221~1259cm-1与1334~1383cm-1,光谱仪采用蓝宝石ATR探头以确保光程的统一性,实验中仪器设定分辨率为4cm-1,扫描次数为54,选取空气为实验背景,并在建模前扣除背景。

图2 不同浓度头孢克肟钠溶液(298.15K)红外光谱图Fig.2 ATR-FTIR spectrum of cefixime sodium solution different concentration at afixed temperature of 298.15K
研究使用了偏最小二乘法(PLS)建立了浓度预测模型[11],光谱的预处理与模型的建立在Matlab PLS工具箱中实现,光谱预处理方法为一阶求导,建模主元数为4,变量数为22。根据浓度预测公式Ypredict=A×B{其中Ypredict为浓度预测值,A为选取红外波段所对应的吸光度,B为系数矩阵:B=[-0.193574170079,0.0210939709217,0.116683975727,0.110885072861,0.172947146328,0.255453548884,0.0881763491574,-0.0807526846678,-0.124507628026,-0.0705075428401,-0.0853931197226,1.95791285046e-05,-0.0748801248406,0.065141 7587433,0.131573611202,0.114144953299,0.04840 03993807,-0.169414930988,-0.0854748385721,-0.0648185307805,-0.0939223514679,-0.0203 989822544]',本研究模型R2=0.9998。将模型输出为m文件并将该预测模型文件嵌入课题组自主研发的在线红外实时浓度预测界面以供调用,对头孢克肟的反应结晶过程进行了浓度的在线测量。头孢克肟盐的浓度实时变化曲线如图3所示,实验条件为25℃,滴酸速率5mL/min,搅拌速率250r/min。
2.2 在线测量析晶点
成核时刻的确定对于结晶研究是非常重要的。研究发现,探头式浊度仪相对于肉眼具有更高的敏感度,并且可以克服结晶容器不易观察的弊端。这里结合在线二维成像系统(图4b),能够观察成核之后头孢克肟晶体生长过程尺寸和形状的变化。
实验获得的浊度数据如图5所示,发现当溶液pH值调整为3.20左右时(改变实验条件后该值会变化),实验测量的浊度值会发生突变,该时刻即是头孢克肟反应结晶的析晶点。
2.3 产物离线分析
图6为某批次头孢克肟产物的红外、XRD、DSC与TG图。头孢克肟产物的红外图谱如图6a所示,所有产物红外图谱峰位置相同,1900~1600cm-1范围内出现了3个峰,1731、1685和1648cm-1,分别为头孢克肟3个不同C=O基的振动峰,1900~1600cm-1范围内的峰属于头孢克肟胺基与酰胺基N-H键。头孢克肟产物的XRD图谱如图6b所示,所有产物的峰位置相同,主要强峰出现在5.90°、9.02°、15.12°、19.72°与22.77°处,说明不同工艺参数得到的晶体产物晶型相同。产物DSC与TG图谱如图6c~d所示,可以得出产物的分解温度在240~250℃之间,同时头孢克肟在100~120℃的热失重为11%左右,根据分子量计算得产物为三水合头孢克肟。

图3 实验过程浓度变化曲线Fig.3 Concentration curve during the experiment

图4 二维成像实时测量结晶过程图片Fig.4 Real-time crystallization process images measured by the two-dimensional imaging system

图5 实验过程中浊度变化曲线Fig.5 Turbidity curve in the experimental process
2.4 反应温度影响
对于反应结晶过程,反应温度不仅影响反应速率和副产物的含量,而且影响晶体成核、转晶和晶体生长的速率。实验考察了10、15、20、25和30℃ 5个温度梯度下的反应结晶过程。预实验发现在更低的温度下(低于10℃),聚集体晶体颗粒粒度小,会发生严重的团聚现象,团聚后会影响产品的流动性,产物黏度会增大,不利于后期的过滤和干燥,同时过低的温度会带来不必要的能耗,而当温度高于30℃时,生成的头孢克肟容易发生分解。图7为在几个不同的反应温度条件下得到的头孢克肟晶体的SEM结果。分析图7可知,反应温度会影响头孢克肟晶体的粒形,随着反应温度的升高,组成聚集体的晶粒的厚度会逐渐降低,晶粒形貌会从块状晶体逐渐变为片状晶体,同时聚集体的颗粒粒度会逐渐增大。白度是评价头孢克肟产品的一个重要质量指标,研究考察了反应温度对产品白度的影响,发现随着反应温度的升高,产品白度会下降。综合考虑白度、流动性等因素,优化后的反应温度选择为25℃。
2.5 养晶ΔpH值的影响

图6 头孢克肟产物表征Fig.6 Characterization of cefixime

图7 不同反应温度所得最终产物的SEM图Fig.7 SEM images offinal products under different reaction temperature
过饱和度是决定晶体生长过程的关键结晶过程条件,在反应结晶过程中,可以使用ΔpH代替过饱和度ΔC,描述反应结晶过程的推动力大小。ΔpH的表达式为:ΔpH=pH1-pH2。其中,pH1为析晶点的pH值(由浊度数据结合二维成像数据确定),pH2为第一次养晶开始时的pH值。本研究分别考察了0.01、0.02、0.03、0.05和0.10 5个不同ΔpH值条件下的头孢克肟反应结晶过程产品的白度、粒度和休止角,分析结果如表2所示。结果发现,ΔpH是影响产物粒度和白度的关键因素。随着ΔpH值的增加,产物的粒度逐渐减小,如图8~9所示。原因在于ΔpH增大会加快成核速率,使得养晶初始时刻溶液中存在更多的晶核,这些晶核长大形成了聚集体中心(如图4d所示),由于形成聚集体的物料衡定,生成的晶核越多则就会导致最终产品的颗粒粒度也越小。分析表2数据可以发现,颗粒产物的粒度越小,对应的白度越高。综合考虑粒度和白度,研究选定了ΔpH=0.03,作为头孢克肟反应结晶的优化后养晶ΔpH值。
2.6 养晶时间的影响
头孢克肟反应结晶中共有两次养晶,第一次养晶时间对产品的结晶度具有关键的影响。从第一次养晶过程实时取样得到的XRD谱图分析(图10,由于X射线衍射仪误差的存在,允许峰位置偏移0.2°以内)可以发现,较长的养晶时间可以得到结晶度结晶度较高的产物,但是在第一次养晶时间达到1h后,产物的结晶度不会再发生明显的变化,最终产物的结晶度较高是由于第二次加酸产生的新的小颗粒引起的。

表2 不同ΔpH条件下产物的白度、粒度和休止角结果Tab. 2 Whiteness, size distribution and angle of repose offinal products with different ΔpH
第二次养晶主要影响收率。由于头孢克肟为两性化合物,在高的pH和低的pH值下都会反生反应(图11),第二次养晶发生在溶液pH达到头孢克肟的等电点,即pH=2.20之后[3],第二次养晶的目的是使得小颗粒最大限度地附着到已经形成的球形颗粒上,以提高收率。同时,在线红外可以实时监测不同投料批次的初始浓度,并且可以结合实时的pH值来确定反应的终点。以尽可能提高收率为目的,针对实际工业生产中母液中溶质与溶剂配比具有波动的特性,在线红外检测浓度方法在实际生产中作用尤为重要。

图8 不同ΔpH下反应最终产物的粒度图Fig.8 Particle size offinal products with different ΔpH
从“2.4”项可知,头孢克肟的晶体生长方式为聚集结晶,首先形成1μm左右的细晶核,然后这些细晶在搅拌的条件下聚集长大为球形晶体。加酸形成细晶核后,需要给予足够时间让晶核聚集成头孢克肟聚集体,否则会影响头孢克肟的平均粒度及粒度分布。图4给出了通过二维成相系统观察到的反应结晶中晶体聚集生长过程以及对应的取样SEM离线分析结果(图12)。可知结晶过程中首先获得形状不规则的产品,随着养晶的进行,头孢克肟晶体逐渐形成为形状较为规整的类球形颗粒。随反应物盐酸的加入,头孢克肟盐的浓度逐渐下降,但在结晶期间,当pH值降低到3.2后的养晶过程中,pH值会发生回升。由于该过程中并无更多的H+加入,所以推测该过程为晶体的转变过程,即由无定型向晶体转变的过程。另一方面,线红外的监测数据说明了头孢克肟结晶过程中的晶体由无定型向晶体的转化过程是基于溶液过渡转化机理[12],由图3在70~100min间的浓度测量曲线也发现,结晶过程中体系的浓度也会有所回升,基于图10和图12的XRD和SEM分析结果,表明在这段时间发生了转晶,发生转晶后,无定型颗粒的表面会部分溶解(由头孢克肟逆反应生成头孢克肟钠盐,反应机理见图11),随着养晶时间的增加,热力学稳定的头孢克肟晶体会在无定型颗粒表面逐渐析出,一段时间后头孢克肟固体表面全部转变为晶体。

图10 养晶过程中晶体XRD变化图Fig.10 XRD curves of crystal during crystal growing time
2.7 滴酸速率影响
滴酸速率影响反应速率,是影响反应结晶成核和晶体生长的重要过程条件。本文考察了不同滴酸速率对头孢克肟产品结晶度的影响。尽管产物的结晶度并不能表明产物的杂质含量低,但由于结晶度越高的产物中晶体形态固体的含量也会相应地越高,由于其吉布斯自由能相对较低使得晶体结构不易被破坏,因此结晶度高的产品将会具有更好的稳定性。结晶度可以由X射线粉末衍射谱图推导计算得到,本研究中以峰高为结晶度参照。
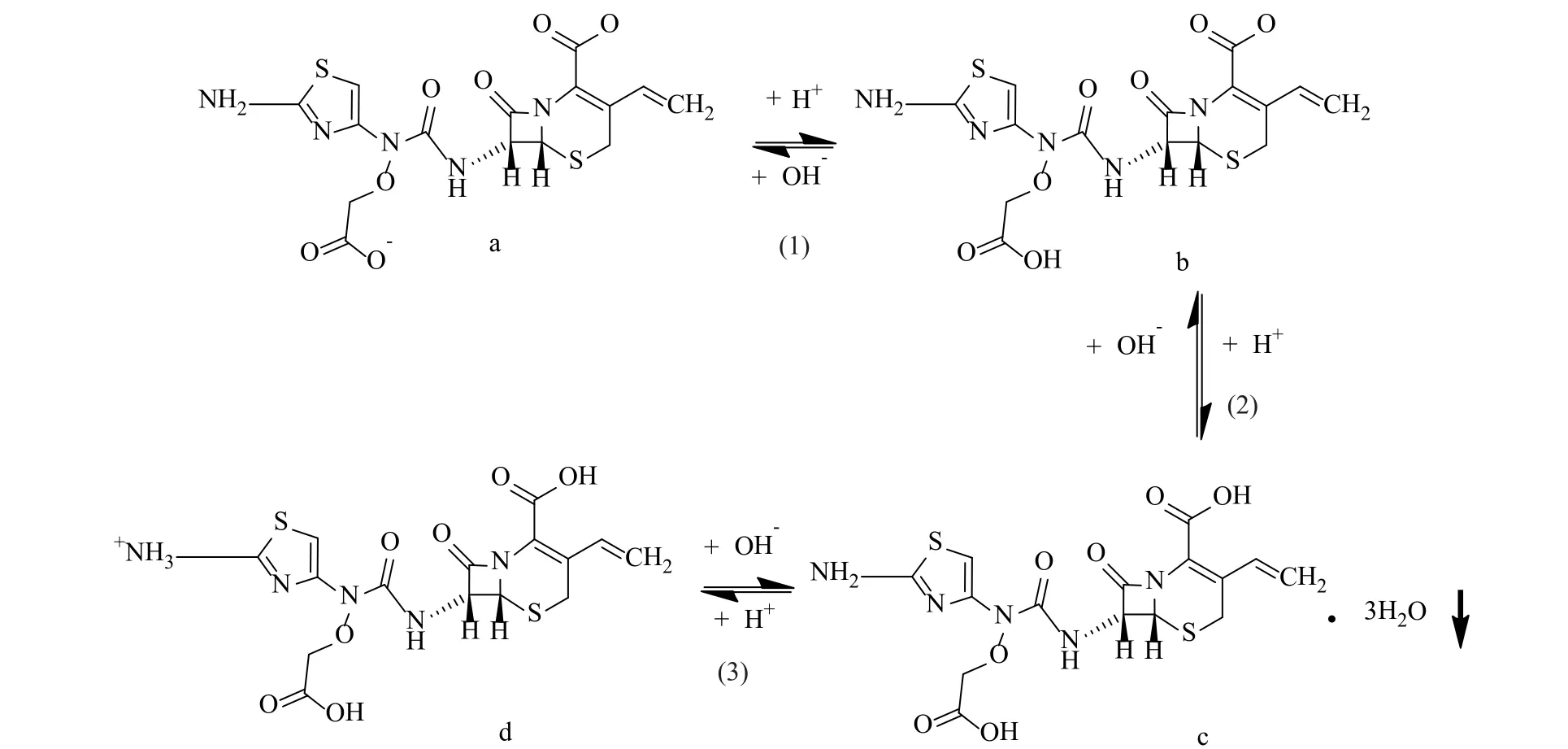
图11 头孢克肟反应结晶机理图Fig.11 Reaction mechanism of cefixime reactive crystallization

图12 养晶过程中晶体变化SEM图Fig.12 SEM images of crystal during crystal growing time
稀盐酸反应物中的H+与另一种反应物头孢克肟二钠盐溶液(pH值5.2左右)反应,该过程并不会马上产生固体,原因是首先进入溶液的H+与头孢克肟二钠盐反应生成了头孢克肟一钠盐,只有当体系中所有的头孢克肟二钠盐转化为头孢克肟一钠盐溶液(pH值3.1左右)后才会产生三水合头孢克肟固体,反应原理如图10所示。研究考察了滴酸速率为1、2、4、5和8mL/min几个实验条件得到的头孢克肟晶体的XRD谱图,如图13所示,选取2θ在5~6.5°之间的峰进行对比,通过最大衍射峰的峰高比较了结晶度,发现在较低的滴酸速率下可以得到结晶度较高的产物,但是滴酸速率在小于5mL/min时,产物结晶度差距并不明显,综合考虑结晶度与生产时间,得到最佳的滴酸速率为5mL/min。
2.8 搅拌速率的影响
搅拌是影响反应结晶的一个重要工艺条件。在反应结晶中,只有反应物充分混合,才能保证反应完全进行,减少副产物的生成。通过提高搅拌速率可以改善反应物的混合程度,但过快的搅拌速率一方面影响晶体的团聚与生长,同时增加能耗和设备投入。本实验考察了不同的搅拌速率条件对头孢克肟产品质量的影响,发现搅拌速率是影响杂质含量的主要因素,而反应温度、加酸速率等因素对杂质含量的影响相对较小,杂质含量结果如表3所示,考察的搅拌速率包括50、100、150、200、250和300r/min。从表3结果可知,当搅拌速率增大后,结晶后头孢克肟产品的最大杂质含量呈现降低的趋势。综合考虑能耗与杂质含量,最终选择250r/min为较优搅拌速率。
3 结论
本文通过在线过程分析技术对头孢克肟反应结晶过程进行了多目标优化。包括应用衰减全反射红外光谱仪(ATR-FTIR)实时监测结晶过程浓度变化并推测和解释头孢克肟的转晶过程,在线成像系统测量结合在线浊度仪确定成核时刻,在线红外结合在线pH计确定结晶过程反应终点。并通过离线手段测量了头孢克肟固体的粒度分布、结晶度、白度与杂质含量。确定了头孢克肟在结晶过程中是由无定型形态转化为晶体形态的,晶体的生长方式为聚集生长。

表3 不同搅拌速率与产物最大单杂对应表Tab. 3 Impurity content of products under different stirring speed
研究发现在头孢克肟反应结晶过程中,ΔpH是影响产物粒度分布的主要因素,反应温度是影响产物白度的主要因素,第一次养晶时间是影响产物结晶度的主要因素,搅拌速率是影响产物杂质含量的主要因素。
实验优化后的实验条件为:反应温度25℃,搅拌速率为250r/min,滴酸速率先5mL/min(析晶前),后2mL/min(析晶后),ΔpH=0.03,第一次养晶时间1h,第二次养晶时间2h。最佳实验条件下得到的三水合头孢克肟晶体结晶度高,粒度分布可以控制在60~90μm,白度大于70,最大单杂含量小于0.10%,休止角小于40°。该方法操作简单,产品质量易于控制,适用于工业生产。

