雷帕霉素生物合成及其分子调控的研究进展
田进忠 姜卫红 芦银华
(1 中国科学院上海生命科学研究院植物生理生态研究所,上海 200032;2 中国科学院大学,北京 100049;3 上海师范大学生命与环境科学学院,上海 200234)
雷帕霉素是由雷帕链霉菌(之前被称为Streptomyces hygroscopicusATCC29253或NRRL5491)、伊氏链霉菌和游动放线菌N902-109等放线菌菌株产生的31元大环内酯类抗生素,生物活性非常多样,具有抗真菌、免疫抑制、抗肿瘤、神经保护和抗衰老等多种功效[1-2]。目前,雷帕霉素及其衍生物临床上主要用作免疫抑制剂及抗肿瘤药物。它生物活性的多样性极大激发了科研工作者对其分子靶点及其作用机制的研究兴趣。研究证实,雷帕霉素首先结合于胞内受体FKBP12(FK506-binding protein 12),形成FKBP12-雷帕霉素复合体,然后再与mTOR(mammalian target of rapamycin, 哺乳动物雷帕霉素靶蛋白)的FRB结构域结合,进而抑制mTOR与下游靶蛋白之间的相互作用[3]。mTOR的靶蛋白往往参与细胞生命活动的重要过程,这是雷帕霉素呈现广泛生物学活性的原因所在。
雷帕霉素分子结构十分复杂,难以化学合成,主要依赖于放线菌的发酵法生产。为实现雷帕霉素的高效生物合成,许多科研工作者对其生物合成途径及其调控机制进行了深入研究,目前其生物合成过程已被清楚解析[4-8]。首先,聚酮合酶(PKS)加载起始单元,即莽草酸途径来源的DHCHC[(4R,5R)-4,5-dihydroxycyclohex-1-ene-carboxylic acid][5];然后,通过14步反应依次加载7分子丙二酰辅酶A和7分子甲基丙二酰辅酶A,缩合形成聚酮链;接着,在非核糖体肽合成酶(NPRS)RapP的作用下,将L-派可酸与聚酮链缩合成环,生成雷帕霉素大环内酯母核;最后,经过细胞色素氧化酶P450的氧化、甲基转移酶的甲基化等一系列后修饰过程,形成雷帕霉素[4-10]。另外,在雷帕霉素生物合成的分子调控研究方面也取得了不错的进展,对其生物合成基因簇内部的5个调控基因进行了功能鉴定,并对其可能的调控机制开展了初步研究[11-12]。这些研究成果为运用基因工程或代谢工程手段进行雷帕霉素高产菌株的分子育种奠定了良好的基础。
本文将重点介绍雷帕霉素生物合成基因簇、生物合成途径及其调节机制研究方面的最新研究进展,并将就该重要抗生素产品的发现及其类似物的功能、高产菌株育种等方面的研究进行简要回顾,同时,也对未来雷帕霉素高产菌株的分子育种以及新型类似物的开发进行了展望。
1 雷帕霉素及其衍生物的发现与功能
1964年,科学家从雷帕努伊(Rapa Nui,复活节岛)的土壤样品中分离得到产生抗真菌活性产物的菌株,并将该活性物质以雷帕努伊命名,称为雷帕霉素。1975年,Vézina等[13-15]研究者在Ayerst研究所分离鉴定了雷帕霉素的产生菌,属于吸水链霉菌(Streptomyces hygroscopicus,后被命名为雷帕链霉菌)。起初,雷帕霉素显示出很强的抗人类致病性酵母的活性,进一步研究发现该抗生素及其类似物可以抑制多种真菌的生长,包括新型隐球菌(Cryptococcus neoformans)、念珠菌(Candida stelloidea)和青霉菌(Penicilliumsp.)[16-18]。因此,雷帕霉素作为一种抗真菌剂逐渐走进人们的生活。除了抗真菌活性以外,Ayerst研究所科研人员发现该化合物还具有极强的免疫抑制活性。在大鼠模型中,雷帕霉素可抑制实验性免疫病(过敏性脑脊髓炎和佐剂性关节炎)的发展及IgE抗体的形成,从而发挥其免疫抑制作用;深入研究表明,它是通过抑制细胞免疫应答而发挥免疫抑制功能[19]。随后,该抗生素作为人类器官移植术后的免疫抑制剂进入临床应用。雷帕霉素作为免疫抑制剂具有独特的优势,比钙调神经磷酸酶抑制剂-环孢菌素A作用强10~100倍[20]。不仅可以有效抑制急性器官移植免疫排斥反应,还可以有效抑制FK506和环孢菌素A不能抑制的慢性器官移植免疫排斥[21-22],同时避免了环孢霉素引发肿瘤的可能性。另外,如将它和其他免疫抑制剂(如环孢菌素)联合使用,抗免疫排斥效果会更好,可有效抑制急性肾同种异体移植免疫排斥反应,并减少对肾的毒害[23]。
雷帕霉素及其类似物还具有很强的抗恶性肿瘤作用,与癌症化疗药物联合使用,可显著提高对癌细胞的杀伤力。报道显示,与顺铂或紫杉醇联合应用可以有效抑制子宫内膜癌细胞的生长[24-25]。在小鼠模型中,使用四甲氧基愈创木酸(tetra-O-methyl nordihydroguaia-retic acid)与雷帕霉素联合治疗,其存活率显著提高[26]。如今,研发的第二代半合成雷帕霉素衍生物(图1),如替西罗莫司(Wyeth, 3)和依维莫司(Novartis, 4),与雷帕霉素相比,具有更有效的药代动力学性质,并且毒性更低。这些衍生物已经被美国食品药品监督管理局(FDA)批准作为治疗肾癌和恶性淋巴肿瘤的临床用药[27]。随着对雷帕霉素研究的深入,发现它还具有神经保护和促进神经再生等功能。在体外和体内神经变性模型中,它可以减弱泛素化蛋白聚集和降低神经元损伤,这对于由蛋白的错误折叠和聚集引起的疾病(如帕金森病)提供了一个有希望的治疗策略[28-29]。雷帕霉素也可以减弱小鼠脊髓损伤后病理性神经疼痛的发展[30]。此外,其半合成衍生物佐他莫司(5)(图1)可以有效预防血管萎缩。佐他莫司是四唑环取代雷帕霉素C-42位的羟基,它被血液缓慢输送到冠状血管壁支架周围防止血管萎缩变窄,同时不引起炎症反应[31]。2013年,FDA已批准佐他莫司作为稳定冠状动脉支架的药物进入临床应用。
更有趣的是,雷帕霉素在模式生物酵母、线虫、果蝇和小鼠中都能显著延长其寿命。2009年,Harrison等[32]发现给600天龄(约相当于人类60岁)的小鼠喂食雷帕霉素可以延长其寿命,雄鼠和雌鼠均有明显效果,分别为9%和14%。后续的研究发现给270天龄的小鼠喂食雷帕霉素,同样可以显著提高存活时间,雄鼠和雌鼠的最大寿命分别延长16%和13%。
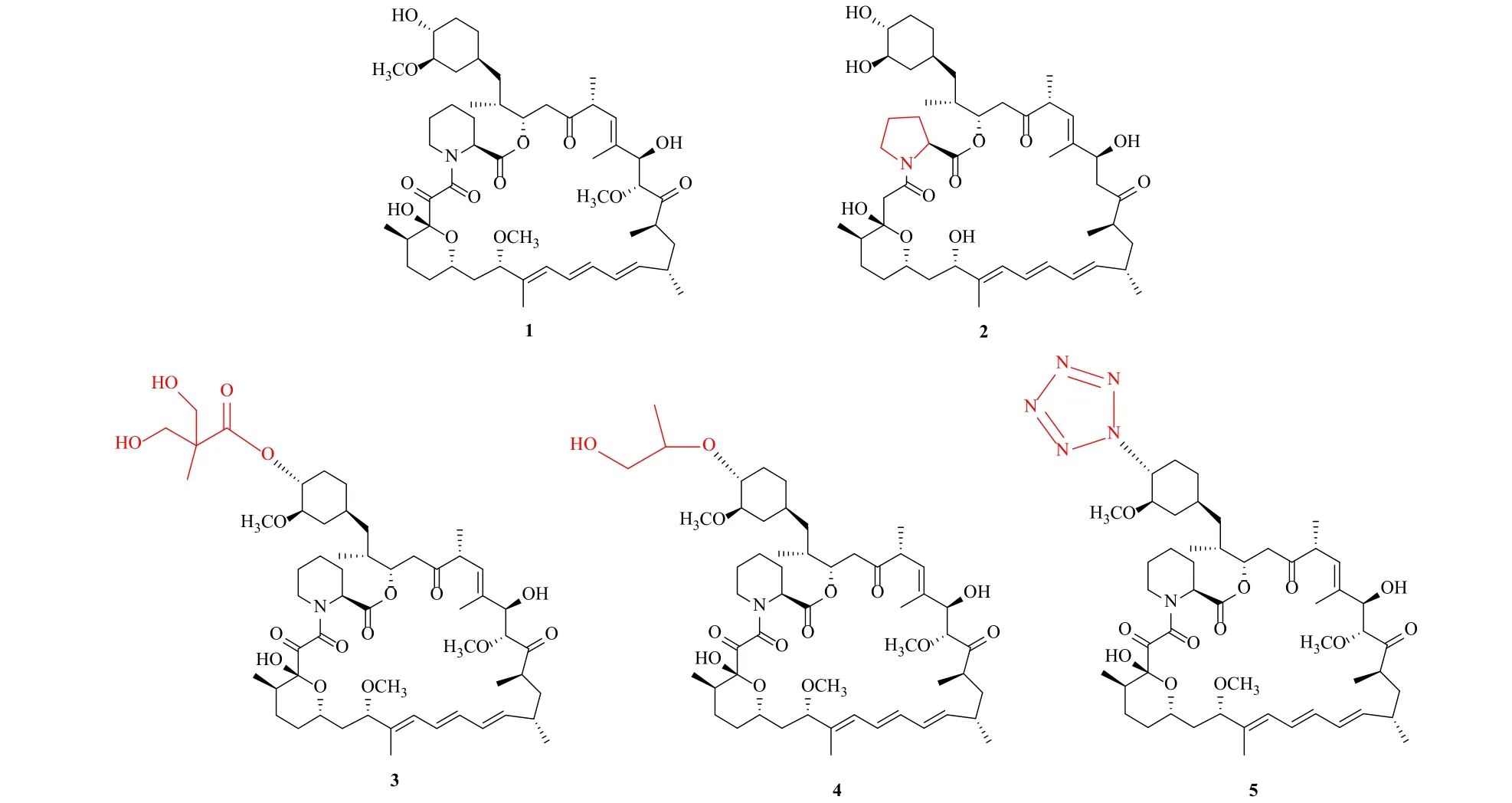
图1 雷帕霉素及其类似物的化学结构Fig.1 Chemical structures of rapamycin and its rapalogs
2 雷帕霉素生物合成基因簇及其合成途径

图2 雷帕霉素生物合成基因簇Fig.2 The map of the rapamycin biosynthetic gene cluster
1995年,Schwecke等[7]利用一段红霉素生物合成基因簇来源的聚酮合酶(PKS)序列为探针,从雷帕链霉菌基因组文库中,筛选得到含有雷帕霉素合成基因簇的文库质粒,通过测序、拼接得到完整的雷帕霉素生物合成基因簇(图2)。基因簇全长107.3kb,共有26个ORF(open reading frame,开放阅读框)(表1),其中rapK编码分支酸酶,在起始单位DHCHC的合成过程中发挥重要功能;rapA、rapB和rapC编码3个I型PKS,rapP编码非核糖体肽合成酶(NRPS)[33-34]。PKS含有以下模块化的功能结构域:羧酸连接酶(carboxylic acid ligase, CoL)、烯酰还原酶(enoyl reductase, ER)、β-酮脂酰合成酶(β-ketoacyl synthase, KS)、酰基转移酶(acyltransferase, AT)、脱水酶(dehydratase, DH)、β-酮脂酰还原酶(β-ketoacyl reductase, KR)和酰基载体蛋白(acyl carrier protein, ACP)。3个PKS复合体共含有15个催化模块,包括1个合成起始模块和14个延伸模块,每个延伸模块催化1个延伸单位连接到雷帕霉素的聚酮链上(图3)。RapP催化L-哌可酸和聚酮链的成环反应,形成前雷帕霉素(pre-rapamycin)。L-哌可酸由赖氨酸环化酶RapL催化L-赖氨酸形成。最后,在RapIJMNOQ等后修饰酶(主要为甲基转移酶、P450)的催化下,前雷帕霉素第9、16、27、39号位发生后修饰,最终生成雷帕霉素(图3)。RapXWV为ABC转运子,可能与雷帕霉素的自身抗性有关。簇内尚有多个功能未知的基因,包括rapD、rapE、rapF、rapV、rapW、rapU、rapT和rapZ(其预测功能见表1)[35]。

表1 雷帕霉素基因簇(来源于雷帕链霉菌)的基因及功能Tab. 1 The rapamycin biosynthetic genes (from S. rapamycinicus)and their functions
雷帕霉素的生物合成途径可以分为聚酮链合成的起始、延伸、环化和后修饰4步,简单描述如下:
2.1 聚酮链合成的起始
雷帕霉素合成的起始单元DHCHC来源于莽草酸途径。分支酸在RapK的催化下形成DCDC(3,4-dihydroxycycloheax-1,5-diene-1-carboxylic acid),进一步形成DHCHC,但是DCDC是如何转化成DHCHC的,尚有待解析[5,9]。DHCHC在羧酸连接酶的催化下被ATP活化形成AMP-DHCHC二元复合物,之后转移到活化的ACP上,由此开始聚酮链延伸。ACP是PKS合酶的关键结构域,在磷酸泛酰巯基乙胺基转移酶(PPTase)的催化下从辅酶A获得磷酸泛酰巯基乙胺基(PPT)从而活化[35]。
分支酸在RapK的催化下合成DCDC,再以DCDC为底物合成雷帕霉素起始单元DHCHC。PKS(RapA、RapB、RapC)催化聚酮链的起始和延伸;RapL催化L-派克酸的形成;RapP催化聚酮链和L-派克酸的环化;RapIJMNOQ分别催化相应位点的后修饰。
2.2 聚酮链的延伸
在RapA、B和C 3个PKS、14个延伸模块的催化作用下,以一定的顺序通过缩合反应将7分子的丙二酰辅酶A和7分子的甲基丙二酰辅酶A依次连接到聚酮链上。同时,每个模块上不同的功能结构域:ER、KS、AT、DH 、KR等催化相应位点的加氢和脱水反应(图3)。模块3和模块6上的功能结构域被认为是失活的,因为相对应的羰基没有被催化[36]。
2.3 聚酮链的环化
聚酮链的环化是在RapP的催化作用下完成的。RapP将L-哌可酸(L-pipecolic acid)连接到雷帕霉素聚酮链上,环化形成前雷帕霉素[37]。RapP催化反应没有严格的底物专一性,它也可以催化脯氨酸和雷帕霉素聚酮链的环化形成脯氨酰雷帕霉素[33](图1)。L-哌可酸来源于L-赖氨酸,此反应由赖氨酸环化酶RapL催化完成[6,8]。
2.4 前雷帕霉素的后修饰
雷帕霉素的生物合成存在复杂的后修饰过程,负责前雷帕霉素后修饰的基因共有6个(rapI、rapJ、rapM、rapN、rapO和rapQ)。其中,rapI、rapM与rapQ编码甲基转移酶;rapJ和rapN编码细胞色素P450单加氧酶;rapO编码铁氧还蛋白。Gregory等[35]运用基因敲除和互补实验,结合发酵产物的鉴定,推测了前雷帕霉素后修饰的过程,按先后顺序依次为:a:RapI(O-甲基转移酶)催化39位羟基的甲基化;b:RapJ(P450)催化C9位的加氧反应,形成羰基;c:RapM(O-甲基转移酶)催化16位羟基的甲基化;d:最后,RapN(P450)与RapQ(甲基转移酶)分别催化27位C的羟基化及甲基化;其中RapJ和RapN加氧反应(C9和C27)需要铁氧还蛋白RapO的参与。前雷帕霉素经过以上一系列后修饰,最终形成雷帕霉素(图3)。C9、C16 与C39位的甲基均来源于甲硫氨酸。
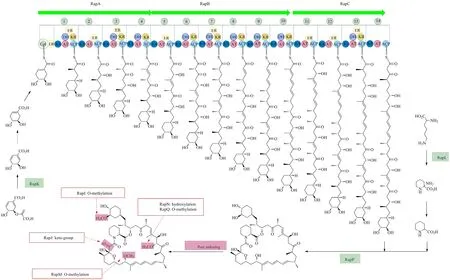
图3 雷帕霉素生物合成途径示意图Fig.3 Schematic map of the rapamycin biosynthetic pathway
值得一提的是,不同产生菌来源的雷帕霉素生物合成基因簇存在一定的差异。1995年,日本静冈县发现了一种新的产雷帕霉素的菌株游动放线菌(Actinoplanessp. N902-109),该菌产雷帕霉素的能力是雷帕链霉菌的近10倍[38]。最近,对两株菌中的雷帕霉素生物合成基因簇序列进行比较分析,发现PKS基因(rapA、rapB和rapC)和rapP在两个基因簇中的分布完全一致,其余基因也高度同源[39]。但参与前体合成和前雷帕霉素后修饰基因的分布位置则明显不同。有趣的是,游动放线菌N902-109来源的基因簇中不存在负调控基因rapS/R和rapY,同时存在ActrapTH编码的酯酶II,它可能参与编辑PKS,该酶的作用可能是N902-109雷帕霉素高产的原因所在,但却不存在于雷帕链霉菌来源的基因簇中。另外,在N902-109中,编码甲基转移酶的rapM基因多了一个拷贝,但没有发现存在于雷帕链霉菌基因簇的rapQ(编码甲基转移酶)和rapG的同源基因(图2)[39]。
3 雷帕霉素生物合成的分子调控
现有关于雷帕霉素生物合成的分子调控均在雷帕链霉菌中完成的,通过分析雷帕链霉菌中雷帕霉素的生物合成基因簇序列,5个ORF被预测为调控基因,包括rapG、rapH、rapS、rapR和rapY(图2,表1),研究发现它们在雷帕霉素合成过程中发挥不同的调控作用[11-12,40]。
在雷帕链霉菌NRRL5491中,增加rapG或者rapH基因拷贝数可以显著提高雷帕霉素产量;反之,如将基因敲除则导致产量显著下降,由此证实它们在雷帕霉素合成过程中发挥正调控作用。序列比对结果显示,RapG和RapH分别属于AraC和LAL家族的调控因子。RapG含有一个位于C端的HTH(螺旋-转角-螺旋),与来自大肠埃希菌的调控因子SoxS同源,但缺乏多数AraC家族调控蛋白拥有的位于N端的二聚化结构域。RapH含有2个结构域,分别是位于C末端和N末端的HTH DNA结合结构域和ATP结合结构域。RapH与来自另一种免疫抑制剂FK506生物合成基因簇的正调控因子FkbN基因序列显示出高度的相似性(72%)[43-44]。RapG和RapH作为雷帕霉素合成的正调控因子,它们协同调控着雷帕霉素的生物合成,其中RapG占主导作用,而RapH仅发挥辅助功能[12]。另外,这2个正调控因子的DNA编码序列中均含有放线菌稀有密码子TTA,因此,它们的翻译必须依赖于bldA(编码TTA的转运tRNA)[12,42-44]。
rapR、rapS和rapY为雷帕霉素生物合成的负调控基因[11]。rapR/S编码一对双组分系统(twocomponent system, TCS),包括应答调控蛋白RapR和组氨酸蛋白激酶RapS,它们与变铅青链霉菌(Streptomyces lividans)来源的TCS CutR-CutS和天蓝色链霉菌(Streptomyces coelicolor)的TCS AfsQ1-AfsQ2具有较高同源性[45-46]。rapY编码属于TetR家族的调控蛋白RapY,是抗生素外排抑制子,它含有一个位于N末端的HTH DNA结合结构域,与来源于放线紫红素(actinorhodin)合成基因簇的actII以及特曲霉素(tetracenomycin)合成基因簇的tcmR同源性较高[11]。3个负调控基因的分别过表达均导致雷帕霉素产量的显著下调,而将rapS或rapY缺失可以大幅提高雷帕霉素的发酵产量(分别提高4.6与3.7倍)。由于RapS与RapR是一对双组分系统,可以断定RapS的功能是通过其匹配的应答调控蛋白RapR来实现的。转录分析表明,RapS/R对rapY的转录行使抑制功能,而RapY则负调控rapX的转录。rapX编码一种ABC-转运蛋白,它可能通过外排雷帕霉素进而防止产物积累对细胞本身的毒害作用。另外,在rapS缺失的菌株里过表达rapX,可以进一步提高雷帕霉素的产量,与原始株产量相比,提高幅度达6.7倍[11]。
综上,我们可以看到,关于雷帕霉素生物合成的分子调控均停留在基因簇内分布的调控因子,而对于基因簇外调控因子参与雷帕霉素生物合成的研究至今未见报道。但考虑到基因簇外调控因子往往行使多效性或全局性调控功能,而且在不同链霉菌中相对比较保守,因此,来源其他链霉菌的全局性调控因子的研究信息可以应用到雷帕链霉菌的代谢工程分子改造中,或许会取得不错的改造效果。
4 优化雷帕霉素发酵水平的策略
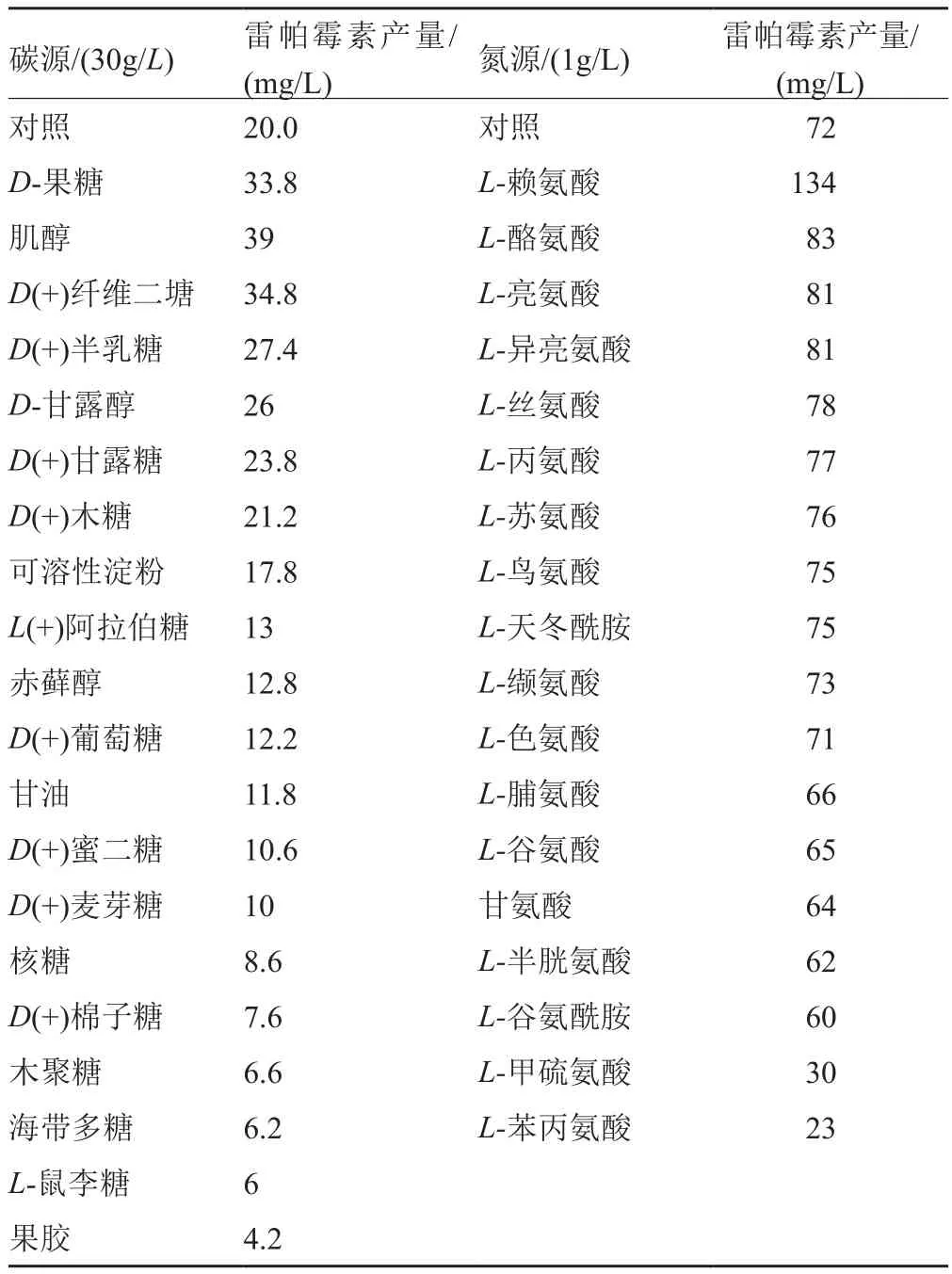
表2 不同碳源、氮源对雷帕霉素产量的影响Tab. 2 Effects of different carbon and nitrogen sources on rapamycin production
在雷帕霉素发酵研究初期,研究者在培养基优化方面开展了大量工作,为雷帕霉素的产量提升做出了很大贡献,这些工作主要是由Arnold Demain博士的研究团队[47]完成的。他们测试了35种不同碳源(包括多糖、单糖、寡糖以及有机酸)对雷帕霉素产量的影响,结果显示,纤维二糖、果糖、半乳糖、肌醇、甘露糖、甘露醇和木糖均可导致其产量的增加(表2)。同样测试了氨基酸作为氮源对产生菌的生长和雷帕霉素产量提升的效果(表2),发现在发酵培养基里添加天冬氨酸、精氨酸和组氨酸的氨基酸组合对菌种生长以及雷帕霉素的产量提升效果显著[48]。在以上培养基条件下,L-赖氨酸的添加将能够大幅提高产量(提高1.5倍),产量达到134mg/L,这可能是因为L-赖氨酸的添加可以增加雷帕霉素合成的前体物质L-哌可酸所致。而甲硫氨酸和苯丙氨酸则抑制它的生物合成。推测甲硫氨酸可能抑制雷帕霉素生物合成相关的O-甲基转移酶和S-腺苷甲硫氨酸(SAM)合成酶的活性,从而降低雷帕霉素的产量[49];而苯丙氨酸抑制雷帕霉素合成的机制还没有得到解析。Cheng等[50]还测试了磷酸盐、铵盐、镁与铁离子对雷帕霉素合成的影响,他们发现磷酸盐(K2HPO4)、铵(NH4Cl)、镁(MgSO4·7H2O)会抑制它的生物合成;相反,浓度为100mg/L(0.36mmol/L)的FeSO4(高于雷帕链霉菌生长所需的二价铁浓度)却能刺激了雷帕霉素的合成。为了更系统地优化培养基营养成分,Sinha等[51]利用Plackett-Burman设计方法和人工神经网络等方法,通过在发酵的不同时段添加营养成分,响应雷帕霉素合成的代谢需求,将其产量提高到320.89mg/L。
雷帕霉素发酵产量低,一个核心的问题是缺少优良的菌种。因此,开展高产菌株的育种研究是必需的。传统的育种方法是主要使用理化诱变策略,如紫外线(UV)照射和亚硝基胍(NTG)诱变等,通过大批量筛选获得雷帕霉素高产菌株。例如,Baby Rani等[52]将吸水链霉菌进行NTG诱变,经过筛选获得一株产量达210mg/L的突变菌株MTCC5681,相对于原始菌株(45mg/L),产量提高了5倍。在此基础上,他们还做了发酵条件的优化,突变菌株的发酵产量又提高了1.6倍,达到了360mg/L。Cheng等[53]发现,通过庆大霉素处理雷帕霉素产生菌的原生质体,可以有效获得高产菌株。在该研究中,他们筛选到一株高产突变体C14-1,它的产量比出发菌株高60%;结合NTG诱变处理,获得另一株突变体C14-2,其产量进一步提高到195mg/L,比亲本菌株增加124%。另外,理化诱变结合原生质体融合技术也被应用于雷帕霉素高产菌株的育种研究中。Chen等[54]运用此项技术,在通过种内原生质体融合和种间原生质体融合获得7株相对高产菌株的基础上,再经过一轮Genome shuffling结合高通量筛选手段,从33216个菌株中筛选到1株雷帕霉素产量高达445mg/L的突变菌株GS-1437。Xu等[55]通过96孔微量滴定板筛选了7000个菌株,其中一株高产菌株的雷帕霉素产量达420mg/L。
在过去几年中,也有通过基因工程或代谢工程手段以提高雷帕霉素发酵产量的研究报道,但相对较少。例如,Huang等[56]在吸水链霉菌TYQ0915中异源整合表达了来自阿维链霉菌(Streptomyces avermitilis)的LAL家族转录调控因子aveR,可以使雷帕霉素的发酵产量提高了2倍,达到1.5mg/g;Geng等[57]通过在ATCC29253中敲除pfk(6-phosphofructokinase基因)同时过表达dahP(3-deoxy-D-arabino-heptulosonate-7-phosphate synthase基因)和rapK,使雷帕霉素产量提升了142.3%,达到250.8mg/L。Jung等[58]以吸水链霉菌ATCC29253为出发菌株,通过紫外诱变得到突变体UV2-2,并在UV2-2中过表达pcc(propionyl-CoA carboxylase基因)的同时添加丙酸,可使雷帕霉素的产量达到42.8mg/L;但是,过表达甲基丙二酰-CoA变位酶(methylmalonyl-CoA mutase)和甲基丙二酰-CoA连接酶(methylmalonyl-CoA ligase)效果不显著。
发酵过程中的动力学参数也显著影响雷帕霉素的发酵产量[59-60]。最近研究显示,提供纯氧和低搅拌速率可以避免对链霉菌颗粒的剪切,在这种条件下雷帕霉素产量最高可达到780mg/L[59]。此外,一项研究评估了吸水链霉菌MTCC4003雷帕霉素生产的动力学参数,这项研究在最佳的发酵条件下(300r/min搅拌速率和1vvm发酵罐中的通气速率)使用可靠的数学模型(其参数包括最大比生长速率、饱和常数、抑制常数和生长产量系数),最终在2.2L生物反应器中得到1316mg/L的雷帕霉素,这是在文献报道的分批发酵中获得的最高雷帕霉素产量[64]。
5 总结与展望
雷帕霉素问世已50年有余,从作为抗真菌剂被发现,逐渐成为用量低、药效高、低毒性的免疫抑制剂,如今人们正在发掘它在神经保护、抗肿瘤和抗衰老方面的功能。由于它的多重功效,尤其是作为抗癌药物,有理由相信未来对它的需求量将逐年上升。鉴于雷帕霉素结构复杂,不适合化学合成,将来仍将依赖于发酵生产,因此迫切需要研发优良的生产菌株。虽然运用传统理化诱变育种技术结合发酵工艺优化提升了雷帕霉素的发酵水平,但是这种方法费时费力。随着其生物合成途径得到全面解析以及雷帕霉素产生菌遗传操作体系的不断完善[61],为我们发展基于代谢工程理念的分子育种提供了可能。雷帕霉素的合成亦受到复杂的调控,这也是工业生产菌种发酵单位偏低的原因之一。但是,对于这方面的研究还很薄弱,深入开展雷帕霉素生物合成的分子调控研究,解析其复杂的调控网络,将为生产菌种的改造提供重要的理论指导。
另外,生物信息学分析显示,雷帕链霉菌基因组上存在多达52个次级代谢产物生物合成基因簇[62]。多种产物(尤其是同一类型的次级代谢产物)在生物合成过程中会互相竞争前体、辅因子、能量和还原力,势必会削弱目标产物的合成。因此,敲除竞争性产物的合成途径是有效提高目标产物合成效率的策略之一[63-64]。最近,作者所在实验室发展了基于CRISPR/Cas9和Cpf1的基因组编辑技术,可以快速、高效地进行基因簇的缺失或中断[65],这些方法的建立为通过阻断竞争途径构建雷帕霉素高产菌株提供了便利。
基因簇多拷贝扩增现象广泛存在于经传统诱变育种技术获得的抗生素高产菌株基因组中,如青霉素(penicillin)、卡那霉素(kanamycin)、林可霉素(lincomycin)的高产菌株[66-68]。受到这种发现的启发,已成功开发了基于基因簇多拷贝扩增技术的分子育种技术,显著提高了放线紫红素(actinorhodin)和井冈霉素(validamycin)的发酵产量(分别提高20倍和0.34倍)[69-70]。此外,核糖体工程(ribosome engineering)已被证明是提高链霉菌中次级代谢产物产量的有效手段。例如,在天蓝色链霉菌中依次引入链霉素、庆大霉素和利福平三重抗性,突变体的抗生素产量是出发菌株的48倍[75]。因此,可以尝试使用核糖体工程和基因簇多拷贝扩增等策略来提高雷帕霉素的发酵水平。
最近,科研工作者在雷帕霉素的结构改造研究方面也取得了较大的进展。Barrie等[36]开发了一种新的组合合成方法:使用聚酮合酶基因的一段序列(约2kb),通过模块间的随机同源重组,生成一系列新的模块丢失或扩增的聚酮合酶基因,从而一次性拿到多种母核缩短或延伸的雷帕霉素类似物。如需开发更加高效快速的组合生物合成方法,则还要对PKS的结构和功能进行深入解析,构效关系的阐明将为新型雷帕霉素类似物的挖掘提供极大的便利。
随着技术的进步和对雷帕霉素认知的不断积累,关于雷帕霉素的研究不会终止在这里,希望未来能开发出更加先进的技术用于雷帕霉素类似物的发现,使其具有更好的功能和更精确的靶向性。同时,也可用于构建更高产的雷帕霉素生产菌株。近年来,随着系统生物学、合成生物学和代谢工程的快速发展,为提高雷帕霉素的生物合成效率以及开发雷帕霉素类似物提供了更多的途径。
——雷帕霉素

