不同品种豇豆发酵过程中质构品质变化及产植物细胞壁降解酶微生物种类分析
厍 晓,钱 杨,李娅琳,何鹏晖,蒋珍菊,常 伟,龚 丽,饶 瑜
(1.西华大学食品与生物工程学院,四川成都 610039;2.西华大学理学院,四川成都 610039;3.成都产品质量检验研究院有限责任公司,四川成都 610100;4.通标标准技术服务有限公司四川分公司,四川成都 610100)
豇豆(VignaunguiculataL.),别名长豆角、饭豆、裙带豆等,属豆科一年生植物。茎有矮性、半蔓性和蔓性三种。豇豆喜温,主要在夏秋两季上市,其食用方法很多,泡制是一种最常见的贮藏和食用方式[1]。发酵豇豆(fermented-cowpea)是我国传统特色发酵食品[2],也是我国产销量较高的四川泡菜之一,不仅美味爽口,而且具有解腻开胃、促消化等功效[3-4]。无论是在家庭制作还是工厂生产中,发酵豇豆都是最易发生腐败的泡菜之一,这是由于四川泡菜原料自身携带了多种微生物,其中包括易造成泡菜腐败的微生物[5]。
发酵豇豆的主要腐败特征表现有软腐、产生酸败腐烂味、“生花”即形成膜醭等[5]。蔬菜软腐是由于部分微生物具有产植物细胞壁降解酶(plant cell wall degradation enzymes,PCWDEs)的特性,PCWDEs主要包括淀粉酶、纤维素酶、果胶酶、多聚半乳糖醛酸酶等,这些酶能分解泡菜中的纤维素、果胶、木质素等[6-7],从而导致蔬菜质地变软,引起蔬菜软腐。目前对新鲜蔬菜中产PCWDEs的微生物报道较多,且多为真菌,但对发酵蔬菜尤其是发酵豇豆中产PCWDEs的微生物报道甚少,而这些微生物代谢所产生的PCWDEs是造成蔬菜软腐的重要因素,也是发酵蔬菜行业造成巨大经济损失的主要原因。
本文选用不同品种的豇豆,用配制的老盐水发酵制作发酵豇豆,研究发酵过程中发酵豇豆的质构品质变化并对产PCWDEs微生物种类进行分析,以期为发酵蔬菜的生产和贮藏提供一定的参考。
1 材料与方法
1.1 材料与仪器
豇豆 具体品种见表1,购于蔬菜基地;老盐水活化用的萝卜、豇豆、大蒜、生姜、花椒等 购买于当地的菜市场;老盐水 采集于当地一家庭;DNA Marker、Taq DNA连接酶(2.5 U/μL)、dNTPs、DNA提取试剂盒、DNA纯化试剂盒 北京天根生化科技有限公司;RNase A 美国Sigma公司;胰蛋白胨大豆琼脂(tryptone soy agar,TSA)培养基、胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基、MRS琼脂培养基、虎红琼脂培养基 北京奥博星生物技术有限公司;蛋白酶(protease)鉴别培养基(以TSA培养基为基础,添加1%脱脂牛奶)、淀粉酶(amylase)鉴别培养基(以TSA培养基为基础,添加1%可溶性淀粉)、纤维素酶(cellulase)鉴别培养基(以TSA培养基为基础,添加0.1%羧甲基纤维素,25 mmol/L磷酸钠,pH7.0)、木聚糖酶(xylanase)鉴别培养基(以TSA培养基为基础,添加1%木聚糖,25 mmol/L磷酸钠,pH7.0)、果胶酶(pectate lyase)鉴别培养基(以TSA培养基为基础,添加1%多聚半乳糖醛酸(PGA),1%酵母提取物,0.38 μmol/L CaCl2,100 mmol/L Tri-HCl,pH8.5)、聚半乳糖醛酸酶(polygalacturonase)鉴别培养基(以TSA培养基为基础,添加1%多聚半乳糖醛酸(PGA),1%酵母提取物,2.2 mmol/L EDTA,110 mmol/L乙酸钠,pH5.5) 实验室自制;其他化学试剂 均为分析纯。

表1 供试豇豆品种来源及特性Table 1 Sources and characteristics of tested cowpea varieties
TA-XT Plus型质构仪 英国Stable Micro Systems公司;Master cycler EP gradient聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司;Gel Doc EQ凝胶成像系统 美国Bio-Rad公司;DYY-8C电泳仪 北京六一仪器厂;pH S-3C酸度计 成都世纪方舟科技有限公司;MULTIFUGE X1R高速冷冻离心机、900 SERIES超低温冰箱 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 老盐水的活化 用无菌肖特瓶从当地一家庭采集老盐水1000 mL,置于冰盒中,2 h内运送到实验室,备用。将洗净晾干的萝卜、豇豆、大蒜、生姜、花椒等装入30 L的土陶坛至2/3处,加入1000 mL老盐水,并用含NaCl质量浓度60 g/L的冷开水补至土陶坛总体积的4/5处,液封,在25 ℃下发酵7 d,备用。
1.2.2 发酵豇豆的制作 将不同品种豇豆样品洗净、晾干,分别装入10 L玻璃坛子至2/3处,接入活化后的老盐水30 mL,再用NaCl质量浓度为60 g/L的冷开水补至玻璃坛总体积的4/5处,料液比约2∶1。液封,每个品种三个平行,在25 ℃下发酵24 d,每隔4 d取适量豇豆及盐卤检测。
1.2.3 pH的测定 在豇豆发酵过程中每隔4 d用无菌移液管在无菌操作台中移取10 mL盐卤,用pH计测定盐卤pH。
1.2.4 微生物计数 在不同品种豇豆的发酵过程中,每隔4 d取盐卤样品并进行总菌、乳酸菌、真菌计数。参照GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》的方法制备样品稀释液,选取适当的稀释度涂布于培养基。TSA培养基用于总菌落计数,MRS琼脂培养基用于乳酸菌计数,虎红琼脂培养基用于真菌计数。
1.2.5 感官评价 在豇豆发酵过程中采用综合评分法,以泡菜的色泽、香气、盐卤浑浊度、膜醭生长情况为评价指标,以每个项目25分制评定,综合评分满分为100分,通过30名不同年龄阶段的食品专业人员测评,测评人员的年龄在20~40岁之间,男∶女=2∶3,评价方式采用风味食品常用的盲评打分法,统计平均评价分值作为有效数据,评分按表2进行。

表2 发酵豇豆感官指标评价标准Table 1 Sensory evaluation standard of fermented cowpea
1.2.6 质构的测定 采用质构仪进行测定,探头P/5。测试程序:测试前速度2 mm/s,测试速度3 mm/s,测试后速度2 mm/s,测定间隔时间5 s,压缩量30%,压缩力5.0 g,测定发酵豇豆的硬度、弹性、咀嚼性。每组试验重复5次,以平均值表示试验结果[8]。
1.2.7 产PCWDEs微生物的分离及特性分析 在四种豇豆发酵的第24 d,从盐卤固体培养基中各随机挑取30株菌进行产PCWDEs检测,编号分别为A-1~A-30、B-1~B-30、C-1~C-30、D-1~D-30,分别用6种产酶特性鉴别培养基培养进行产PCWDEs检测[9],于28 ℃培养24 h后观察各菌株产PCWDEs情况。判定方法:蛋白酶,可直接观察透明区域;聚半乳糖醛酸酶和果胶酶,用4 N盐酸加在菌落周围并观察透明区域;淀粉酶,用碘液染色并观察透明区域;纤维素酶和木聚糖酶,用0.1%刚果红溶液染色15~30 min,再用1 mol/L NaCl冲洗数次,观察菌落周围透明区域;若有透明区域,则表示此菌株产PCWDEs。
1.2.8 产PCWDEs微生物的分子生物学鉴定 对产植物细胞降解酶的单克隆菌株进行分子生物学鉴定。使用蒋云露等[10]研究的快速提取法提取总DNA,1.0%琼脂糖凝胶电泳检验提取结果[11]。以提取的DNA为模板,细菌以引物Eu27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1490R(5′-GGTTACCTTGTTACGACTT-3′)为正向和反向引物;PCR体外扩增条件为:95 ℃、5 min;95 ℃、1 min、50 ℃、1 min、72 ℃、2 min,35个循环;72 ℃、10 min,进行16S rDNA片段扩增。真菌以引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)为正向和反向引物,其PCR体外扩增条件为:94 ℃、1 min;94 ℃、1 min,52 ℃、1 min,72 ℃、1 min,30个循环;72 ℃、5 min,进行18S rDNA片段扩增。将PCR扩增产物进行回收纯化,送成都擎科梓熙生物技术有限公司测序,测得的序列于NCBI数据库进行blast比对,其同源性≥97%时可认为是同一个属,同源性≥98%时可认为是同一个种[7],并通过Clustal X软件多重比对后用MEGA 6.0软件中的Neighbor-Joining法构建系统发育树[5],并对四种发酵豇豆中产PCWDEs微生物的种类进行分析。
1.3 数据统计分析
利用OriginLab 8.0软件、MEGA 6.0软件、Clustal X软件、SPSS软件、Excel 2007对实验的数据进行处理。
2 结果与分析
2.1 不同品种豇豆发酵过程中的pH变化
以不同品种豇豆为原料进行发酵,在豇豆发酵过程中盐卤的pH变化有明显的品种特异性(如图1所示)。豇豆品种A在发酵过程中pH下降最快,第4 d时pH已达到4.0;豇豆品种C在发酵的第8 d时pH可降至4.7。pH是表征泡菜乳酸发酵成熟和泡菜腐败的重要指标之一[12]。泡菜中的乳酸发酵是乳酸菌利用蔬菜中的糖进行厌氧发酵生成乳酸的过程,因此泡菜的发酵过程常伴随着盐卤pH的下降。通常认为盐卤pH降至4.0左右时,泡菜发酵成熟[13]。以盐卤pH为参照,豇豆品种A发酵成熟速度最快。

图1 发酵过程中豇豆的pH变化Fig.1 The pH change of cowpea during fermentation
豇豆品种A和C在12~24 d保持pH相对恒定。豇豆品种B和D在发酵前8 d pH呈下降趋势,随即pH开始上升,第24 d时已回升至pH6.5以上。在泡菜发酵和储藏过程中,盐卤pH的回升则是判断泡菜腐败的重要标志之一[12],这是由于某些微生物可以耐受低pH而生长,消耗以乳酸为主的有机酸或产PCWDEs造成泡菜腐败[14]。由此可以看出,豇豆品种B和D在发酵后期和储藏过程中更易发生腐败。
2.2 不同品种豇豆发酵过程中的微生物变化
盐卤pH的变化主要由微生物生长代谢引起[12]。泡菜发酵过程中的微生物主要来源于蔬菜自身携带和所接种老盐水中的微生物。本研究中所用老盐水均为同一坛同一批次的老盐水,因此在发酵过程中微生物数量变化的差异主要源于豇豆品种的不同。
不同品种豇豆发酵过程中的微生物群落变化表现出与盐卤pH变化一致的品种特异性。如图2a,豇豆品种A发酵前期中乳酸菌生长最快,第4 d时已高于6.0 lg cfu/mL,第8 d时乳酸菌和总菌均达到最高,分别高于7.0、8.0 lg cfu/mL,这与豇豆A发酵过程中pH下降最快的结果相符,豇豆品种A在发酵过程中pH与乳酸菌的数量之间存在极显著相关(r=0.888,p<0.01),这说明蔬菜在乳酸发酵过程中乳酸菌的生长与盐卤pH的下降相关,这与熊涛等[15]的研究一致。豇豆品种B、C、D发酵前期乳酸菌生长速度较品种A慢(图2),这是这三种品种豇豆发酵前期盐卤pH下降相对缓慢的主要原因。不同品种的豇豆中还原糖、蛋白质、粗纤维等营养成分存在显著差异[16],这是影响发酵过程中微生物群落生长差异的主要因素之一。
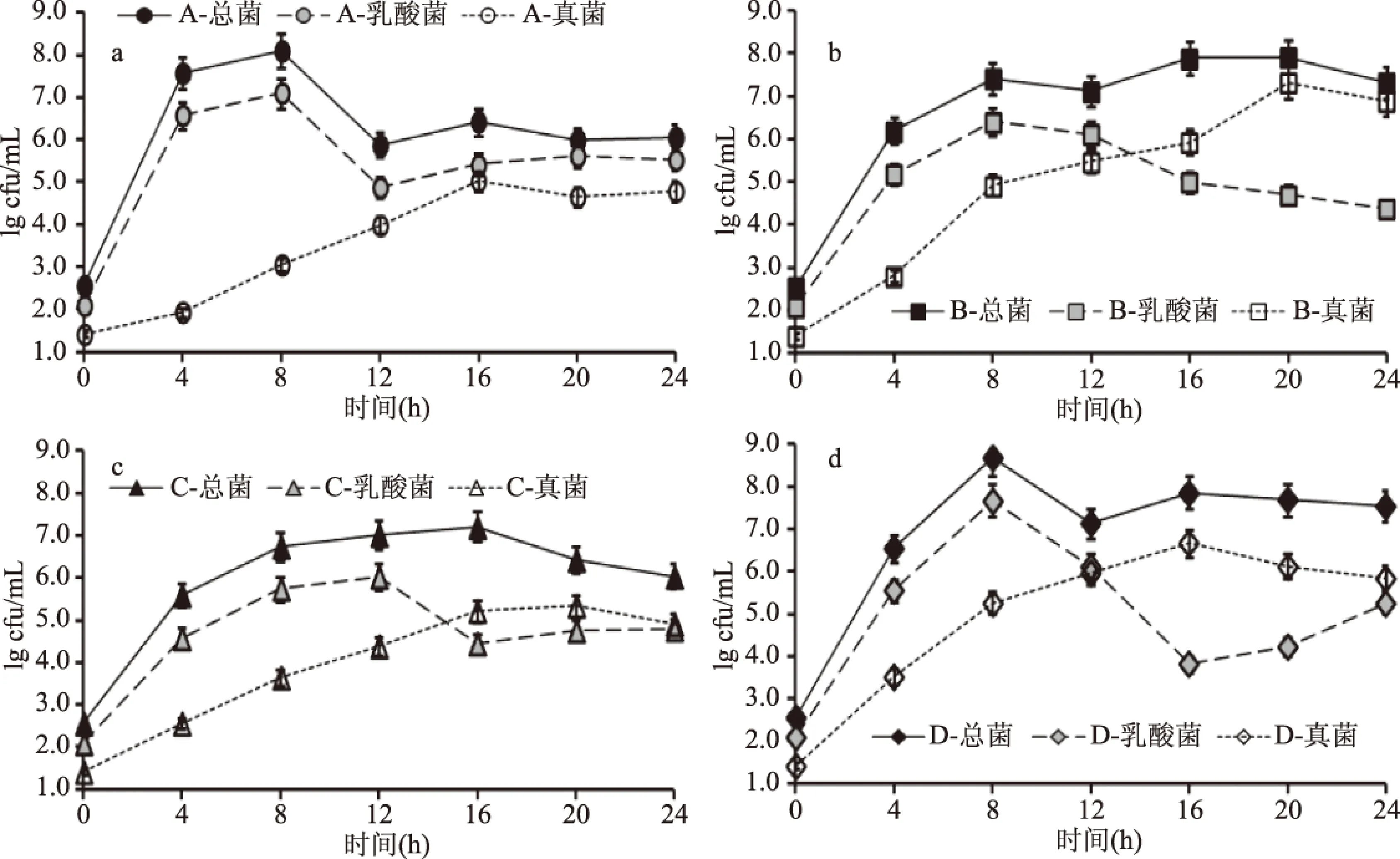
图2 发酵过程中豇豆的微生物变化Fig.2 Microbial changes of cowpea during fermentation
发酵12 d后,品种A发酵豇豆中总菌和乳酸菌数量分别下降并随即趋于平衡,真菌数量先增加后下降最后在4.5 lg cfu/mL左右波动(图2);豇豆品种B、品种C和品种D中乳酸菌于12 d后开始减少,但总菌数量仍高于7.0 lg cfu/mL;真菌数量也持续增长,特别是品种B于15 d时发酵豇豆中的真菌数量可达到(5.9±0.3) lg cfu/mL,随后持续增加,在发酵20 d时达到(7.3±0.4) lg cfu/mL。在整个发酵过程,品种A的pH、微生物数量变化与一般蔬菜在发酵过程的相似,而品种B、C、D在发酵过程中pH均未下降至4.0左右,且发酵后期的真菌数量明显高于品种A的,这可能与豇豆的品种有关。
2.3 不同品种豇豆发酵过程中的感官评价分析
在实验过程中,部分发酵豇豆在发酵第12 d开始出现腐败膜醭,到第24 d时,发酵结束,由此对第12、24 d的发酵豇豆进行感官分析,其结果见表3。
由表3知,品种A在发酵第12、24 d时的感官评价得分均最高,发酵过程中,其色泽新鲜、盐卤清亮,有着较浓的泡菜香气;品种B最低,在发酵第12 d时色泽偏暗沉,盐卤表面有连成一片的膜醭,第24 d时色泽发黑,盐卤浑浊;品种C与品种D在发酵第12 d时表现出正常的泡菜的品质,但在发酵第24 d时,色泽偏暗沉、出现腐烂味、盐卤较浑浊,泡菜品质下降,但好于品种B。
2.4 不同品种豇豆发酵过程中的质构分析
分别在发酵开始(第0 d)、部分发酵豇豆出现腐败膜醭(第12 d)、发酵结束(第24 d)时取不同品种豇豆样品,从硬度、咀嚼性和弹性三个特征参数来分析不同豇豆样品的质构变化,结果如图3。在发酵第0 d时,不同品种豇豆的硬度、弹性、咀嚼力差异不显著(p>0.05),品种B的弹性(0.8825)略低于其他三个品种(0.92左右)。发酵前12 d,豇豆的硬度、咀嚼力降低很快,其中品种C的硬度下降率为81.97%,品种A、B、C的下降率在60%左右;发酵第12 d时,4个品种豇豆的硬度、弹性、咀嚼力差异均不显著(p>0.05),但硬度和咀嚼力与发酵第0 d的差异显著(p<0.05)。在发酵的12~24 d中,品种B的硬度、弹性、咀嚼力下降率分别为68.97%、48.50%、63.43%,而其余品种豇豆下降率都比品种B小;第24 d时品种B的弹性与其余三种豇豆有显著性差异(p<0.05)。由表3知,发酵第24 d时,品种B表现出的感官品质最差,品种A最好;相比于品种C和品种D,品种A的质构特征更好,这也是品种A在发酵过程中盐卤清亮、色泽新鲜的重要原因之一。

表3 感官评价结果Table 3 Results of sensory evaluation
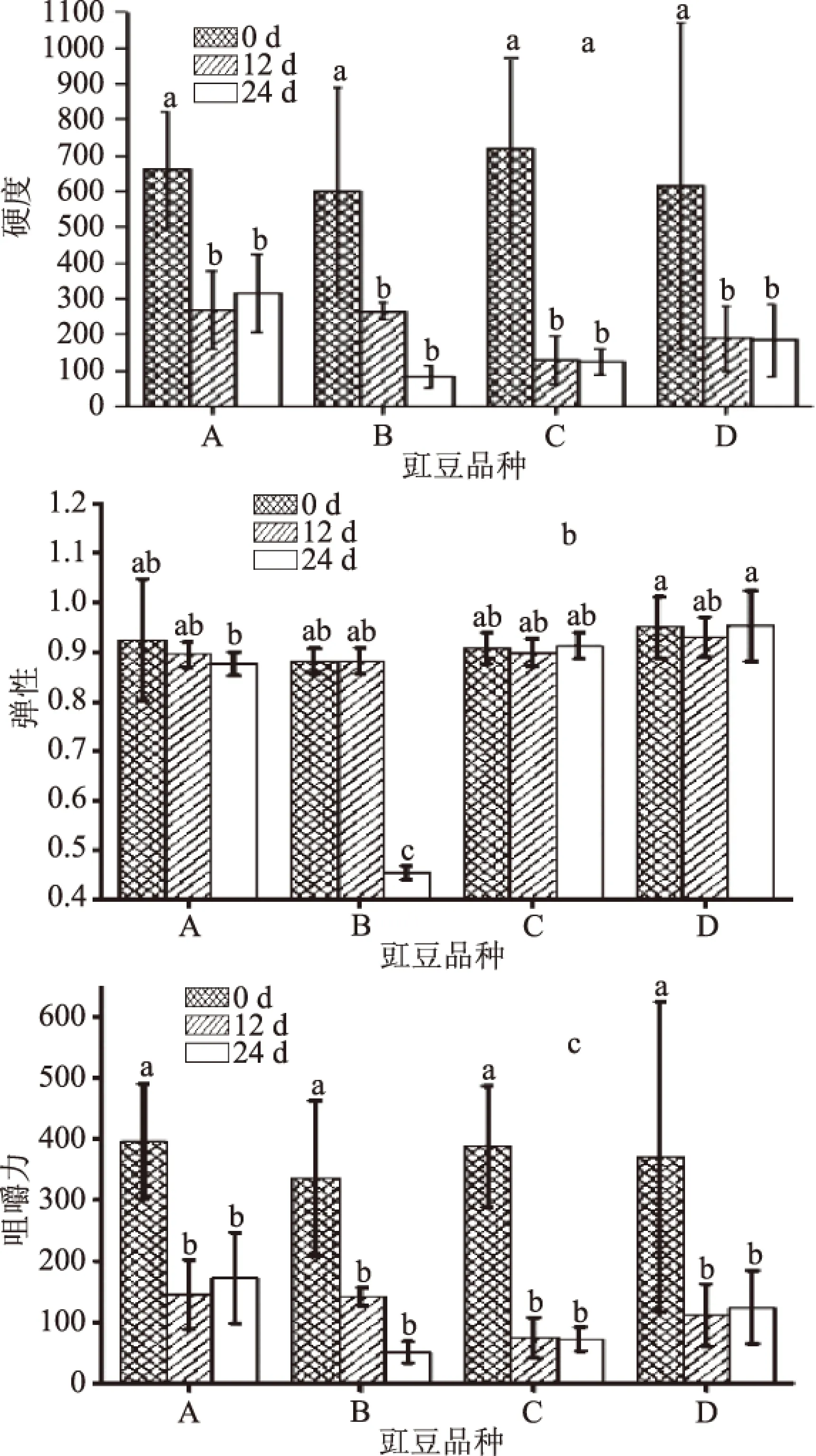
图3 发酵豇豆质构测试结果Fig.3 Results of texture test of cowpea during fermentation注:误差线上的a~d表示不同豇豆不同时间之间的显著性差异。
蔬菜原料的品种会影响其发酵产品的品质。近年来已有报道不同品种芥菜、辣椒、萝卜等在发酵后表现出不同的风味、质构、亚硝酸盐等产品品质特征[17-18]。陈玲等[19]发现3种豇豆品种发酵后的总酸、还原糖和感官品质均有差异,周情操[20]以湖北地区9个豇豆品种为原料泡制后产品风味和质构也有较大不同。除不同品种蔬菜自身的差异之外,这些风味和质构的不同主要受发酵过程中微生物的生长代谢情况影响[21-22]。本研究中品种A豇豆发酵前期乳酸菌生长和盐卤pH下降速度快,后期微生物数量降低,pH稳定维持在较低水平,并表现出正常的发酵豇豆风味和质构;其他品种豇豆尤其是品种B豇豆在发酵后期微生物数量的增加和pH的上升,这三种发酵豇豆出现不同程度的软腐,这可能与豇豆的品种以及PCWDEs微生物种类有关。
2.5 腐败微生物产PCWDEs微生物种类分析
微生物产PCWDEs是导致蔬菜软腐的重要原因之一[9],菌株的具体产酶情况见表4。检测发现有45株产PCWDEs,其中品种A中的最少,有6株;品种B中的最多,有19株;品种C、D中分别有11株和9株。品种B中产PCWDEs的微生物及产酶种类最多,而品种A最少;实验发现产蛋白酶与淀粉酶的菌株最多,产纤维素酶的最少;部分菌株同时产多种酶,如菌株B-1同时产淀粉酶、果胶酶、木聚糖酶。
将表4中的菌株进行16S rDNA及18S rDNA鉴定,结果发现这些菌株分属于13个种,10个属,进行系统发育树构建,结果见图4。对四种发酵豇豆中产PCWDEs微生物种类进行分析,结果见表5。

表4 腐败发酵豇豆中显著产酶菌株的筛选结果Table 4 Screening results of significant enzyme-producing strains in spoiled fermented cowpea
结合表5和图4可知,产蛋白酶的植物乳杆菌(Lactobacillusplantarum)和产淀粉酶的异常威克汉姆酵母(Wickerhamomycesanomalus)在4种发酵豇豆盐卤中均可检测到。植物乳杆菌是泡菜发酵中常见的主要乳酸菌[23-24],但近年来已有研究发现植物乳杆菌可能参与了泡菜腐败过程中的乳酸代谢[25-26]。本研究中,植物乳杆菌还可能通过产蛋白酶破坏发酵豇豆的质构。异常威克汉姆酵母是常见的产淀粉酶酵母菌[27],张腾[28]研究发现食盐含量4%的泡菜真菌微生物的主要优势微生物为异常威克汉姆酵母。

图4 部分细菌(a)和真菌(b)系统发育树的构建Fig.4 Phylogenetic tree of part of bacteria(a)and fungi(b)

表5 四种发酵豇豆中产PCWDEs微生物的种类Table 5 Types of PCWDEs-producing microorganisms in four fermented cowpeas
品种B发酵豇豆中产PCWDEs微生物数量和种类最多且产酶种类多样,包括肠杆菌属(Enterobacter)、弗氏柠檬酸杆菌(C.freundii)、黄褐假单胞菌(P.fulva)、松鼠葡萄球菌(S.sciuri)、成团泛生菌(P.agglomerans)、肺炎克雷伯氏菌(K.pneumoniae)和类香味菌(M.odoratimimus)等。肠杆菌是发酵蔬菜中常见的腐败菌,Franco等[26]在黄瓜二次发酵中发现阴沟肠杆菌,Krishnan等[29]也在番木瓜果实里发现产淀粉酶、木聚糖等的肠杆菌。在以白菜为原料的腐败泡菜中也发现了阴沟肠杆菌、产气肠杆菌、弗氏柠檬酸杆、肺炎克雷伯氏菌和成团泛生菌等[30]。品种B发酵豇豆在24 d时的严重软腐与其产PCWDEs微生物的种类、数量多和产酶类型多样有关。
仅在品种D发酵豇豆中发现解鸟氨酸拉乌尔菌(R.ornithinolytica),Rao等[30]在研究四川泡菜的腐败过程中分离得到解鸟氨酸拉乌尔菌,Zogaj等[31]在研究人体肠道细菌时发现解鸟氨酸拉乌尔菌产纤维素酶。由表3知,豇豆品种C、品种D和品种A中的产PCWDEs微生物种类和数量相差不大,但品种C和品种D中的微生物产PCWDEs的种类更丰富,从质构分析结果中也得出品种C、品种D的质构品质(图3)好于品种B但又差于品种A。由此可见,发酵后期豇豆的软腐与产PCWDEs微生物的种类和数量有关。
3 结论
不同品种豇豆在发酵过程中的pH、微生物群落及质构品质变化均有差异。在24 d的发酵过程中,豇豆品种A发酵前期乳酸菌生长和pH下降最迅速,发酵后期微生物群落和盐卤pH稳定,且色泽新鲜、盐卤清亮,逐渐形成较浓的泡菜香气,表现出较好的质构品质。豇豆品种B、品种C和品种D发酵前期乳酸菌生长以及pH下降速度较品种A慢,发酵后期,pH开始回升,总菌和真菌数量持续升高;品种B相比于品种A、品种C、品种D的硬度、弹性、咀嚼力降低得最快且最低,且在发酵第12 d时表现出颜色暗沉、盐卤表面有较厚膜醭出现等感官特征,其所表现出的质构品质也较差。
将不同品种发酵豇豆中产PCWDEs微生物分离鉴定后发现,品种B产PCWDEs微生物的种类最丰富且数量最多。发酵过程中,四种不同品种的豇豆中均发现产蛋白酶的植物乳杆菌和产淀粉酶的异常威克汉姆酵母产PCWDEs;此外在品种A、品种B和品种C中均检测到肠杆菌属产PCWDEs,如E.cloacae、E.aerogenes、E.faecium等;仅在品种D发酵豇豆中发现R.ornithinolytica产PCWDEs。结果表明发酵后期豇豆的软腐与产PCWDEs微生物的种类和数量有关。

