乳脂肪球膜的组成、营养及制备研究进展
张 雪,杨 洁,韦 伟,*,金青哲,王兴国,2,*
(1.食品科学与技术国家重点实验室,食品安全与质量控制协同创新中心,江南大学食品学院,江苏 无锡 214122;2.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048)
母乳是婴儿最佳的食物。母乳含有婴儿所需的所有营养成分,并有助于建立婴儿的免疫系统、促进消化系统发育和智商发育等。当无法对婴儿进行母乳喂养时,配方奶是婴儿获取营养物质的唯一来源,因此应使配方奶在成分及其含量上尽可能的与母乳相接近。
母乳中的脂肪质量分数(下同)为3%~5%,其中98%以上是以甘油三酯的形式存在、约0.8%的磷脂、0.5%的胆固醇以及种类繁多的其他脂类[1]。成熟乳中脂肪球的直径为0.1~20 μm,平均粒径3.5~4.41 μm[2]。乳脂肪球(milk fat globule,MFG)的核心为非极性酯如甘油三酯(triacylglycerol,TAG)、视黄酯、胆甾醇酯等;外面由3 层膜包被,膜是由极性物质如磷脂、蛋白质、黏多糖、胆固醇以及一些酶类组成,称为乳脂肪球膜(milk fat globule membrane,MFGM)[1]。
近年来,以牛乳为原料制备的富含MFGM的产品已经作为营养强化剂添加入婴幼儿配方奶粉中,研究表明MFGM对婴儿的生长发育起到积极作用,为婴幼儿配方奶粉的更新换代提供了指导性的思路。
1 MFGM的组成
MFGM厚度为10~50 nm,3 层膜是由乳腺细胞中内质网的单层膜及其细胞膜顶部的双层膜组成[3]。膜包括液体无序区(liquid-disordered domains,Ld)和液体有序区(liquid-ordered domains,Lo),Ld主要包括甘油磷脂、糖脂、蛋白质及一些酶类,其中甘油磷脂包括磷脂酰乙醇胺(phosphatidylethanolamine,PE);磷脂酰胆碱(phosphatidylcholine,PC);磷脂酰肌醇(phosphatidylinositol,PI)和磷脂酰丝氨酸(phosphatidylserine,PS)。而Lo富含胆固醇和鞘磷脂(sphingomyelin,SM)[4]。MFGM上的脂质主要为甘油磷脂和鞘磷脂,SM和PC大部分分布在外双层膜,而PE、PS和PI集中分布于内单层膜[5]。5 种磷脂的结构如图1所示。
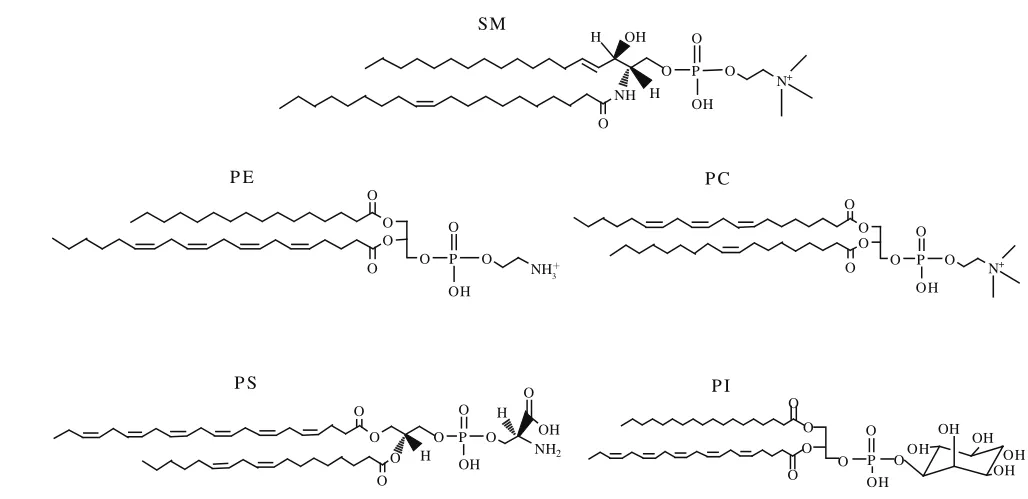
图1 乳中主要磷脂的结构[6]Fig.1 Structure of major phospholipids in milk[6]
MFGM中的脂质和蛋白质占90%,甚至更多(以干质量计)[7-8]。MFGM脂质组分主要由甘油三酯(56%)和磷脂(40.6%)组成。MFGM中主要的蛋白为黄嘌呤氧化酶、嗜乳脂蛋白、亲脂素和高碘酸,占总蛋白的6/7[9]。
1.1 MFGM中磷脂的组成
研究人乳及其中TAG组成的较多,但有关磷脂的研究相对较少。因此,对MFGM中的磷脂组成进行总结。磷脂由一小部分脂肪酸酯化而来,围绕并稳定脂肪球TAG核心[10]。MFGM中的磷脂包括SM、PC、PE、PI、PS,对最近文献中报道的人乳中各磷脂的含量、比例、脂肪酸及总磷脂脂肪酸比例进行归纳。其他哺乳动物乳脂是磷脂等天然脂类活性成分的重要来源,其磷脂组成也总结并与人乳脂相比较,用来考察作为人乳替代脂的原料。
1.1.1 磷脂的含量及比例
1.1.1.1 人乳
英国的Morrison[11]在1968年首次研究人乳磷脂组成,随着近年来分析化学的发展,学者们不断尝试测定人乳中的磷脂。人乳按泌乳期可分为初乳(产后1~5 d)、过渡乳(产后6~15 d)和成熟乳(产后15 d以后),多数研究表明人乳的成分会随着泌乳期的延长而发生改变[12]。此外,测定方法不同、地区差异、个体差异、饮食习惯等都会对磷脂定量产生影响。近30 年中,不同国家、地区报道的人乳成熟乳中的磷脂组成见表1。

表1 人乳磷脂含量及其比例Table1 Contents and proportions of phospholipids in human milk
就成熟乳而言,人乳中磷脂的总量为170.0~421.8 mg/L (3.05~5.11 mg/g总脂),其中SM:65.4~121.9 mg/L(1.34~2.05 mg/g总脂)、PC:26.1~65.5 mg/L(0.63~1.28 mg/g 总脂)、PE:41.5~126.8 mg/L(0.31~0.76 mg/g总脂)、PS:17.4~55.5 mg/L(0.37~0.84 mg/g总脂)、PI:6.7~52.0 mg/L(0.33~0.41 mg/g总脂)[4,10,12-27]。关于各磷脂占总磷脂的比例,最多的为SM(29.0%~45.5%)、PC(19.0%~38.12%)和PE(10.1%~36.1%),其次为PS(3.7%~18.4%)和PI(0.94%~11.7%)。通过比较各磷脂的含量及比例,发现大部分人结论为SM>PC>PE[4,10,12,17-18,21-22,27];一部分人研究结果为SM>PE>PC[13,16,19,23-24];少部分人得出结论为PC>SM>PE[14,25]及PE>SM>PC[15]。
不同国家、同一国家不同地区、同一地区不同个体之间的数据均有差异。SM和PC中的胆碱占婴儿摄取总胆碱的17%[6],是婴儿器官快速生长及生物膜合成所需,故是主要的极性脂质[12,17];而得出结论为PE相对含量大于PC的,可能原因为溶血磷脂酰乙醇胺(lysophosphatidylethanolamine,LPE)与PE一起定量[28]。Wang等[15]的实验结果为PE相对含量大于SM,原因为样本人群所在国家日本有食用深海鱼的习惯,深海鱼富含二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),所得数据显示PE里的长链多不饱和脂肪酸在总脂肪酸中的比例特别高(59%),特别是花生四烯酸(arachidonic acid,AA)和DHA,所以母乳中的PE可能是为婴儿提供AA、DHA和EPA的来源。绝大多数研究者发现乳磷脂中PS的比例大于PI[4,10,12-13,15-19,21-22,24-26,29]。
德国的Harzer等[13]在1983年开始研究不同泌乳期人乳磷脂组成的变化。关于泌乳期磷脂含量的变化说法不一。Harzer[13]和Shoji[27]等发现乳中总磷脂含量在整个泌乳期变化不太明显,但Shoji等[27]发现总脂质中极性脂质(polar lipid,PL)相对含量降低;Sala-Vila等[12]发现成熟乳中磷脂含量低于过渡乳和初乳,过渡乳含量最高;但Zou Xiaoqiang等[17]实验结果为初乳的磷脂含量低于过渡乳和成熟乳,过渡乳含量最高;而Bitman等[10]则发现泌乳期磷脂含量会显著减少。就成熟乳阶段而言,Ma Lin等[26]发现在产后2~12 月,乳中磷脂含量会增加,与Bitman等[10]的结论一致;然而Claumarchirant等[23]却证明在产后1~12 月乳中磷脂含量减少。关于哺乳期间5 种磷脂的变化,较多的人发现SM比例增加[13,25,27]或变化不大[12,17,22];PC比例减少[12-13,17,22,27,29];PS比例增加[12,17,27,29];PE比例增加[12-13,17,22,29];PI比例变化不大[10,12-13,22,27]。
检测方法也会影响人乳中磷脂的含量。人乳中磷脂的定量方法主要为薄层色谱分析(thin-layer chromatography,TLC)、高效液相色谱-蒸发光散射检测器(high performance liquid chromatography-evaporative light-scattering detector,HPLC-ELSD)或HPLC-质谱(mass spectrum,MS)及磷谱核磁共振(31P nuclear magnetic resonance,31P NMR)。TLC用于定性和半定量测定[6],但操作繁琐且不准确,应严格验证和标准化[30]。HPLC和TLC都需要标准品定量。而使用31P NMR对磷脂进行定量时则不需要标准品,只需在总脂肪中加入内标即可,测量准确但需要高分辨率设备和熟练操作员[6]。最常用的检测方法是HPLC-ELSD,这是由于ELSD能与广泛的溶剂相容,且信号与酰基链的饱和度和长度无关(与紫外检测器不同)。然而该检测器受到其低识别潜能、低选择性和非线性的限制[31],且每种磷脂还需要标准品做外标曲线定量,但是标准品较贵难获得。每种方法都有其优劣势,若该方法已被验证(在精度、准确度、检出限、定量限和线性方面),则能获得可比较和可重复的结果[6]。目前关于不同检测方法间人乳脂磷脂组成比较的研究较少。
1.1.1.2 其他哺乳动物乳
哺乳动物乳如牛、羊等的乳是婴幼儿配方奶粉的主要原料之一,但其磷脂含量与人乳存在显著差异。了解不同种类的乳中磷脂之间的差异,有助于促进各种乳来源的营养供给,特别是在婴幼儿食品中的使用[32]。表2列举了一些哺乳动物乳磷脂含量及其比例。
哺乳动物中含量最多的极性脂质是PC、PE与SM,与人乳相同。牛乳中的PC[21,24,34-35]或PE[18,35]含量最高;羊乳也是PC[21,24]或PE[18,35]含量最高;骆驼乳的PE含量最高,其次为SM[18,21];猪乳中的PE含量最高,略高于SM[33]。但人乳中为SM含量最高,其次为PC或PE。马乳中SM最高,略高于PC,马乳的总脂中含有接近1%的极性脂质,大于人乳和牛羊乳,但其总脂质含量太低[18]。这些差异可能是由于动物品种、哺乳期、饮食习惯以及环境和季节因素所致[37]。同时研究人乳和其他动物乳磷脂组成的文献较少,由于检测方法存在差异,因此仅研究动物乳磷脂的文献不易与其他文献中人乳磷脂相比较。人乳磷脂中的SM比例明显高于其他哺乳动物乳,总磷脂含量与牛乳最接近。Zou Xiaoqiang等[21]所研究的驴乳及Morrison等[33]所研究的猪乳磷脂中SM及PC比例与人乳相接近,PE比例高于人乳,但有关猪乳磷脂的文献较少且比较久远,因此需要新的数据来进行研究。综合比较,仍然是牛乳的各磷脂含量与比例和人乳最为接近[18,21,24]。
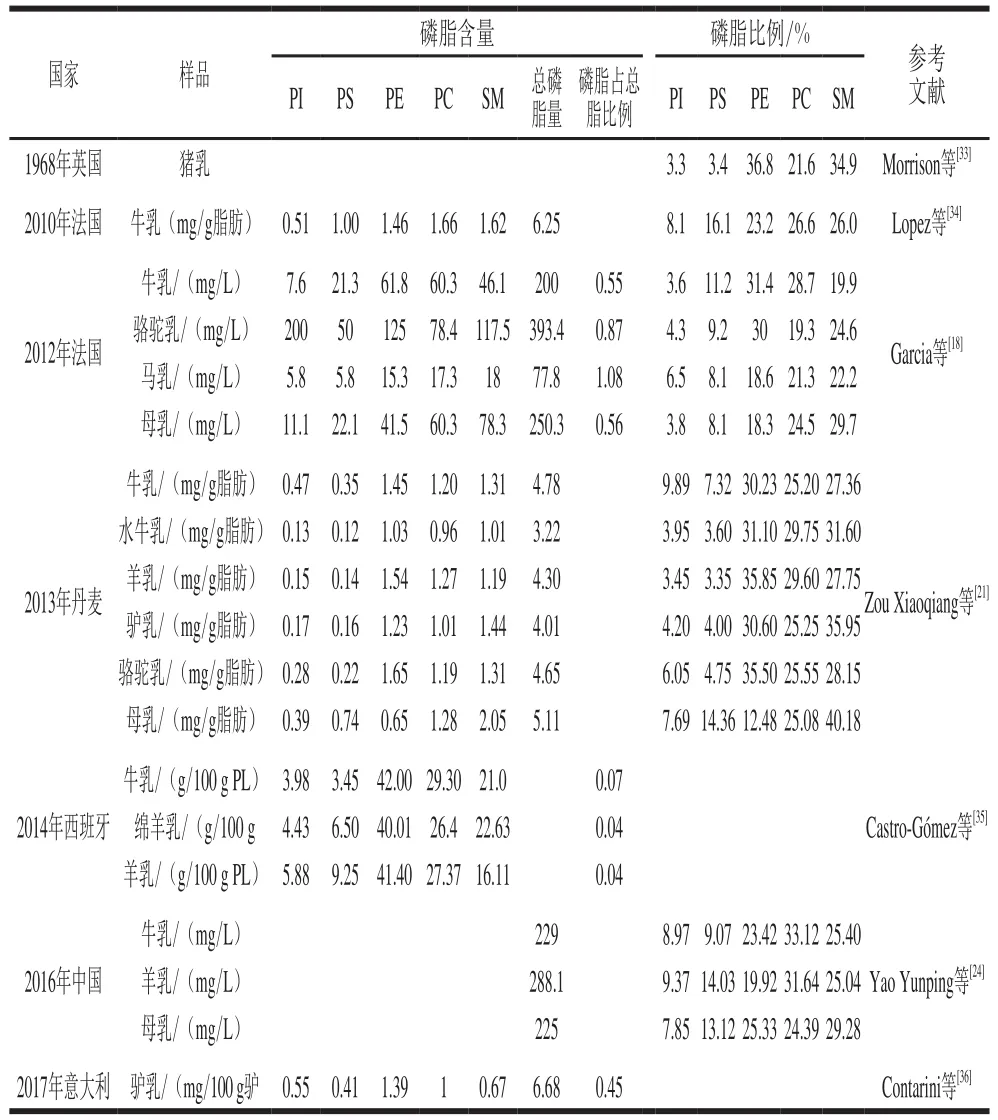
表2 一些哺乳动物乳磷脂含量及其比例Table2 Contents and proportions of phospholipids in mammalian milk
1.1.2 磷脂的脂肪酸组成
1.1.2.1 人乳磷脂脂肪酸组成
乳脂中主要的化合物为脂肪酸,大部分酯化成TAG的形式[38],少部分酯化成磷脂的形式[10]。磷脂是LC-PUFA、神经酸及胆碱的提供者,为婴儿获得最佳发育所必需[12]。日本的Kudo 等[37]在1964年首先对总磷脂脂肪酸进行研究。近30几年不同国家及不同地区报道的人乳总磷脂中各脂肪酸占总脂肪酸的比例见表3。
磷脂中的脂肪酸测定方法为TLC和气相色谱,检测出约40 种脂肪酸(不包括支链脂肪酸)。磷脂脂肪酸中饱和脂肪酸(saturated fatty acids,SFAs)所占比例最高,其次为多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)和单不饱和脂肪酸(monounsaturated fatty acids,MUFAs)。人乳磷脂中含有大量的SFAs(占磷脂总脂肪酸的56.63%~66.79%),且大多数为长链(long chain-saturated fatty acids,LC-SFAs):C16:0和C18:0含量最高,分别为13.8%~39.86%和13.08%~32.36%;MUFAs占磷脂总脂肪酸的15.61%~20.2%,含量最高的为C18:1ω-9(11.61%~17.79%);PUFAs占磷脂总脂肪酸的19.65%~23.98%[12-13,16-17,21-22,24,29],主要为ω-6(15.36%~20.3%)和ω-3(1.9%~4.76%)系列[16-17,21-22],如C18:2ω-6(12.04%~24.12%)、C20:4ω-6(1.43%~6.21%)等。

表3 人乳总磷脂总脂肪酸组成Table3 Fatty acid composition in total phospholipids of human milk%
人乳磷脂中含量最高的4 种脂肪酸为C16:0、C18:0、C18:1ω-9和C18:2ω-6,占总脂肪酸的70%以上。比较各地区的人乳磷脂中各脂肪酸所占比例,中国人乳磷脂中的C18:3ω-3、C22:1ω-9、C22:4ω-6含量明显高于德国、西班牙、法国和丹麦的人乳;中国东北地区和法国的人乳磷脂中C18:1ω-7、C20:0、C22:0、C24:0、C24:1ω-9含量明显高于其他国家;东北地区的C18:0、C18:2ω-6、C20:1ω-9含量明显高于无锡地区,而C16:0、C18:1ω-9含量明显低于无锡地区;丹麦地区的C16:0含量明显高于其他国家,而C18:0、C20:0、C20:4ω-6含量明显低于其他国家;德国地区的C18:2ω-6、C20:4ω-6含量明显高于其他国家,而C14:0含量明显低于其他国家。这些差异与检测方法有关,如在使用TLC分离磷脂的过程中,可能单甘脂与极性脂质没有完全分开,导致所得结果为C16:0含量高于C18:0。地区饮食也会有较大的影响,如中国人乳磷脂中C20:4ω-6和C22:6ω-3含量低于日本人乳,这是由于日本人所食用的大量海产品是PUFA的最佳来源[39];中国人乳磷脂中的PUFA含量比北美及欧洲的高,可能是由于中国饮食主要为食用植物油(大豆油中富含亚油酸和亚麻酸)引起[40]。
磷脂中的脂肪酸在泌乳期间也在发生动态变化。SFA总量在不同阶段含量均最高,但变化无规律:Sala-Vila等[12]发现SFA在初乳磷脂中含量最高;Zou Xiaoqiang[17]和夏袁[22]等发现过渡乳磷脂中SFA含量显著高于初乳和成熟乳;而何扬波[29]发现SFA在成熟乳磷脂中含量最高,在初乳和过渡乳中差异不大。MUFA总量在初乳磷脂中最高[12,17,22,29]。PUFA总量在成熟乳磷脂中最高,在初乳和过渡乳中差异不大[17,22,29]。PUFAω-3在初乳期磷脂中含量最低,随泌乳期延长而增加;PUFAω-6在成熟乳磷脂中含量最高[17,22]。C16:0含量随哺乳期延长而减少[17,22,29]或变化不大[41];C18:0含量变化不大[29,41]或增加[17]或在过渡乳中最低[22];C18:1ω-9含量变化不大[12,29]或在过渡乳中最低[17,22]。Sala-Vila[12]和何扬波[29]等得出相同的结论:C20:4ω-6和C22:6ω-3含量随泌乳期延长而减少;而C18:2ω-6和C18:3ω-3含量随泌乳期延长而增加。这是因为在婴儿早期,C20:4ω-6和C22:6ω-3在体内合成不足,需要直接从母乳中摄取。随着婴儿的生长,体内酶系统逐渐完善,对外源性PUFA的依赖性降低。转化为对C20:4ω-6和C22:6ω-3的合成原料——C18:2ω-6和C18:3ω-3的需求增大[29]。
Morriso等[42]在1967年首先对人乳中各磷脂脂肪酸组成进行研究。表4为近年来人乳各磷脂中脂肪酸组成。
目前仅有少量文献对各极性脂质脂肪酸进行报道[10,15-16,24],原因可能是极性脂质在TLC的薄板上的分离较为困难。
S M所含的S F A s在所有磷脂中最高,主要为LC-SFAs:C16:0(5.3%~21.32%)、C18:0(12.7%~13.8%)、C20:0(6.34%~10.2%)、C22:0(16.4%~20.7%)、C24:0(8.1%~17.5%),所以SM有更高的熔化温度,可在室温下很容易与其他磷脂分离[21]。SM中PUFAs含量在所有磷脂中最少。主要的UFA为:C24:1ω-9(9.7%~16.05%)、C18:1ω-9、C18:2ω-6和C22:1ω-9[8,12-13,15-16]。C24:0及其饱和同系物神经酸占SM的25%~30%[8,10,15-16]。神经酸(nervonic acid,NA)主要在SM中酯化,因为NA-SM是有利于婴儿吸收的最佳形式[43]。在乳汁分泌的前两周,总磷脂中的NA含量相对稳定,NA以其最易生物利用的形式稳定地供应给婴儿,在成熟乳中含量会减少25%。这证明,虽然新生儿能利用油酸合成NA[44],但在其第1个月可以从母乳中稳定地获得预形成的NA,以增强NA在新生儿中的摄入[12]。早产儿和足月儿成熟乳中SM的FA组成差别较小[10]。
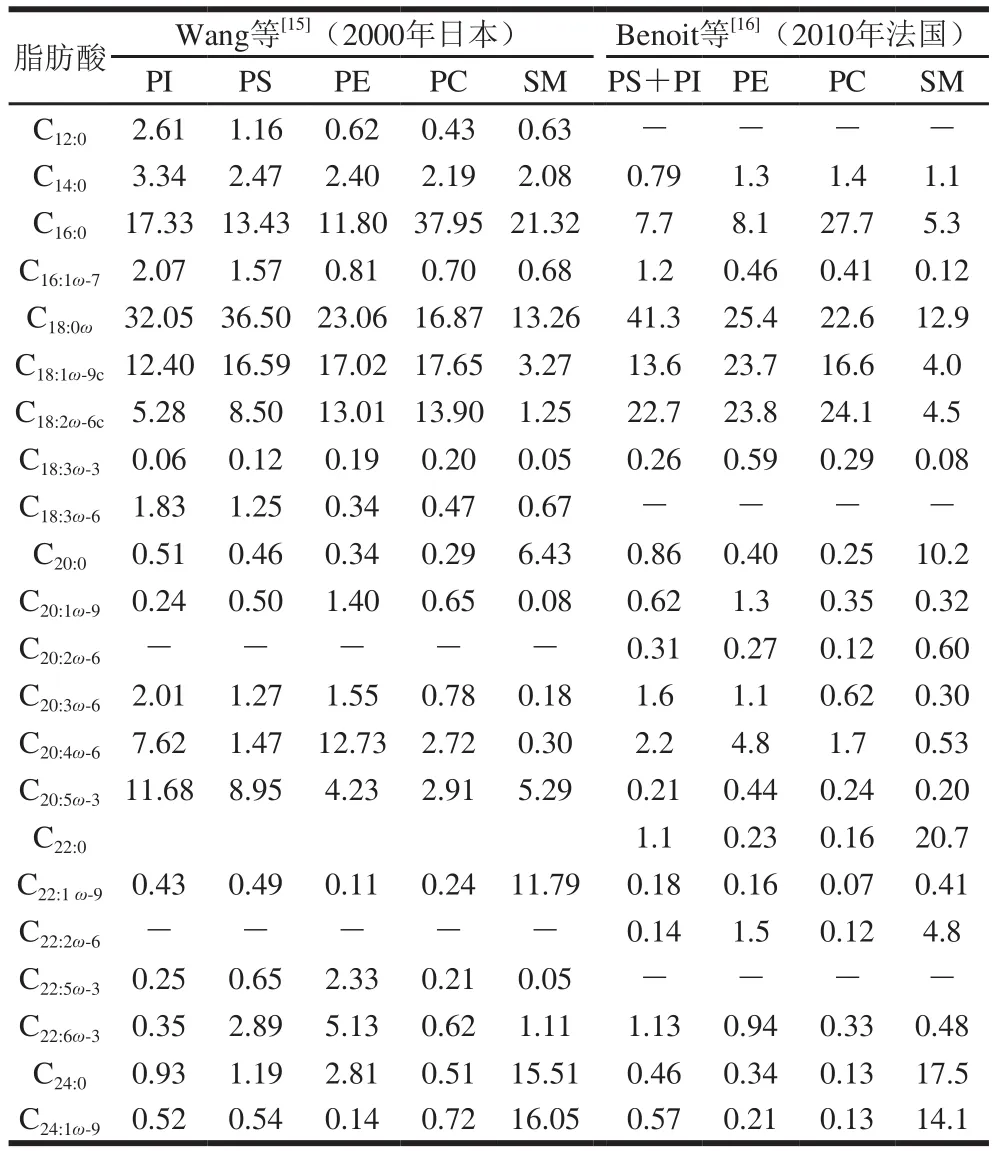
表1 人乳各磷脂的脂肪酸组成Table1 Fatty acid composition in phospholipids of human milk%
P C中主要4 种脂肪酸依次为C16:0(25.1%~37.95%)、C18:0(16.87%~24.7%)、C18:1(15.6%~17.65%)及C18:2(13.9%~24.1%),四者占PC总脂肪酸的90%。近年来几乎没有关于对不同泌乳时期的早产儿和足月儿的各个磷脂的脂肪酸组成的研究报道。Bitman等[10]发现脂肪酸含量从初乳到成熟乳的变化较明显,足月儿与早产儿的脂肪酸也有差异。在PC中,早产儿的初乳和过渡乳比足月儿含有更多的C16:0;从初乳到成熟乳,早产儿和足月儿人乳中的C18:1在总脂肪酸中的含量显著下降,而C18:2含量显著增加[10]。
PE含PUFAs最多,SFAs最少(约40%[15-16])。主要脂肪酸为C16:0(7.5%~1 1.8%)、C18:0(23.06%~25.6%)、C18:1(17.02%~23.7%)、C18:2(13.01%~23.8%)和AA(4.8%~12.73%)。α-亚麻酸、AA和DHA在PE中含量最高,含量高于总脂[15],被报道是最不饱和的磷脂[45]。因此,建议向配方奶中加入磷脂,模仿各个磷脂的浓度[15]。从初乳到过渡乳到成熟乳,PE中的C18:1和C18:2含量明显增加,AA含量明显减少[10,46]。
PS和PI中50%的脂肪酸是饱和的[10,15],4 种主要的脂肪酸为C16:0、C18:0、C18:1及C18:2。PS中C18:0含量最多,占总脂肪酸的35%~40%[8,10,15]。早产儿乳PS中的C18:1随泌乳期减少,足月儿的相对稳定;早产儿和足月儿的C18:2在泌乳期均增加[10,42]。PI中含量最多的脂肪酸仍为C18:0,占总FA的1/3,在哺乳期变化不明显;C18:2含量显著增加;C20:4和C22:4的含量显著减少[10]。PI所含的AA含量(约7%)仅次于PE[10,15]。
1.1.2.2 其他哺乳动物乳磷脂脂肪酸组成
哺乳动物的磷脂脂肪酸组成也与人乳有着较大的差异。表5列举了近年来其他哺乳动物乳磷脂总脂肪酸组成的数据。可以看出,牛、水牛、驴、羊、骆驼乳的磷脂脂肪酸中SFAs所占比例最高,其次为MUFAs和PUFAs[21,24,36]。
与人乳总磷脂脂肪酸相反的是,这些哺乳动物的MUFAs所占比例均大于PUFAs。SFAs中含量最多的为C14:0、C16:0和C18:0。这些动物乳磷脂中的C16:0含量低于人乳,水牛乳的C18:0明显低于其他乳。人乳磷脂中的中链SFAs比例明显低于其他乳,而LC-SFAs明显高于其他乳。人乳磷脂中的MUFAs的比例显著低于其他乳,这是因为其他乳中的C18:1ω-9比例较高(23%~30%),远高于人乳(约13%)[21]。驴乳和骆驼乳中磷脂的PUFAs比例高于人乳磷脂,而羊乳、水牛乳、牛乳里的PUFAs低于人乳磷脂[21,24]。值得注意的是,C22:6ω-3和C20:4ω-6在牛、羊、水牛、骆驼乳中并没有检测到[21,24],在驴乳中也是微量存在[36];但Morrison等[33]在羊乳里没有检测到C22:6ω-3,在猪乳和骆驼乳中均检测到;Fauquant[50]和Sánchez-Juanes[47]等在牛乳中几乎没有检测到C22:6ω-3。此外,Contarini等[36]在驴乳中检测到了少量的支链脂肪酸(1.43%),其他乳脂肪酸数据中并没有提到,但支链脂肪酸是人乳中主要的微量脂肪酸,在人乳脂中含量高达1.5%[48],是婴儿出生前后的主要营养成分之一,并具有特殊的生理功能[49]。
近年来同时研究人乳和其他动物乳的各个磷脂FA组成并进行比较的文献较少。根据Yao Yunping等[24]的实验结果可知,在牛乳和羊乳中,SM的主要SFAs为C16:0(25%以上)、C22:0、C24:0,与Fauquant等[50]的研究结果一致;而人乳为C18:0、C22:0、C24:0。牛羊乳PC中C16:0和C18:1含量最高,而人乳PC中C16:0和C18:2含量最高。人乳的PE比牛羊乳含有更多的C18:2,而含有更少的C16:0。人乳与牛、羊乳中PI和PS的FA组成相似,C18:0和C18:2含量高于牛、羊乳,C18:1含量低于牛、羊乳。人乳中的PE、PC和PS中的UFAs、SM和PI中的SFAs含量比牛乳和羊乳高。

表5 其他哺乳动物乳磷脂总脂肪酸组成Table5 Fatty acid composition in total phospholipids of mammalian milk%
因此,婴儿配方奶应反映出健康母乳的脂肪酸组成,不仅仅是各脂肪酸在总脂中的含量,还要模仿各脂肪酸在总磷脂中的含量[6]。
1.2 脂肪球膜中蛋白质的组成
MFGM蛋白仅占总乳蛋白的1%~4%,通过蛋白质组学分析已经确定了具有多种功能的200多种蛋白质[51]。MFGM蛋白对人体健康的营养价值不容忽视。Lu Jing等[32]通过无标记定量蛋白质组学分析分别鉴定和定量了人、牛、山羊和牦牛乳MFGM中的312、554、175 个和143 个蛋白质。50 种参与囊泡介质运输和乳脂肪球分泌的蛋白质在物种间保守。此外,参与脂质合成和分泌的蛋白质(黄嘌呤脱氢酶/氧化酶(xanthine dehydrogenase/oxidase,XDH)、口形蛋白质(stomatin)和分化抗原簇(cluster of differentiation 36,CD36)显示不同的表达模式,宿主防御蛋白在物种内也是不同的。
在人、牛和耗牛乳M F G M中,嗜乳脂蛋白(butyrophilin,BTN1A1)是最丰富的蛋白质,而山羊乳MFGM中最丰富的蛋白质是XDH[32],与Zamora等[52]的结果一致。XDH与BTN1A1配合用于MFG分泌,XDH/BTN1A1的比例越大,MFGM蛋白含量越多[53]。
值得注意的是,脂肪分解酶的含量和活性在人MFGM中显著较高,这可能表明母乳喂养婴儿的脂肪利用率较高。人类MFGM蛋白的组成与目前使用的婴儿配方奶粉替代品的差异很大。人MFGM中脂质代谢酶的深入研究可能有助于通过调节婴儿配方奶粉中脂质代谢酶来改善脂肪利用[32]。
2 添加入婴儿配方奶中MFGM的营养功能
近几年研究添加入婴儿配方奶中MFGM补充剂的营养作用的文献增多。所研究的膜产品主要来自恒天然(Fonterra)和爱氏晨曦(Arla)公司。MFGM在母乳中有着重要的作用,研究表明将其添加入配方奶中是安全的,其功能主要集中在促进神经发育、肠道发育及免疫力的提高。
2.1 MFGM可促进神经发育
Gurnida等[54]在婴儿配方奶中加入Complex Milk Lipid,将神经节苷脂含量增加至2~3 mg/100 g,有利于0~6 月龄婴儿认知能力的发育,可能是因为血清神经节苷脂水平升高所致。Timby等[55]对160 个低于2 月龄的婴儿分别喂养添加MFGM(Lacprodan®MFGM-10,Arla)的低能量低蛋白配方奶和标准配方奶至6 个月,80 个婴儿母乳喂养进行对照,结果证明MFGM的补充减小了配方奶和母乳喂养的婴儿在认知发育上的差距。Timby推测这种结果可能归因于单一因素(例如唾液酸[56-57]、神经节苷脂[54,58-59]、鞘磷脂[60-61]、胆碱[62-63]或胆固醇[64-66]),两种或多种因素的组合,也有可能是由于不同婴儿体内限制因素不同所致。Hernell等[67]在婴儿饮食里补充MFGM(Lacprodan®MFGM-10),结果证明MFGM补充剂是安全的,对神经发育和预防感染有积极作用,能够减少母乳与配方奶在认知能力和感染率上的差别。
Guan Jian等[68]对大鼠长期补充MFGM衍生的Beta Serum Concentrate(BSC),发现BSC改善了大鼠的学习、记忆和认知能力,BSC还改善了多巴胺和谷氨酸神经传递,这可能是改善认知功能的神经生物学机制,可能是因为胆碱、神经节苷脂和磷脂在起作用。Liu Hongnan等[69]试图确定磷脂和神经节苷脂对婴儿脑部和认知发育的影响,对多只出生两天的仔猪进行人工喂养含0%(对照)、0.8%或2.5% Lacprodan®PL-20的配方奶至28 d。结果表明,将磷脂和神经节苷脂添加到婴儿配方中可能会影响大脑发育,并增强人类婴儿认知的某些方面。
2.2 MFGM可促进肠道发育
Bhinder等[70]分别对5~15 d龄的老鼠喂养添加有或不添加MFGM(Lacprodan®MFGM-10)的奶粉,对照组为母乳喂养,证明MFGM可调节新生儿肠道菌群,使肠道上皮及微生物正常发育,可显著预防有害炎症的刺激。Nilssonden等[71]提出,因为SM和鞘糖脂的消化和吸收可产生生物活性代谢物神经酰胺、鞘氨醇和鞘氨醇-1-磷酸,并且完整的神经节苷脂可能在肠道中具有有益作用,这些物质可能对新生儿肠道完整性和免疫成熟有重要作用。但还需进一步的研究以证明此结论。
2.3 MFGM可提高免疫力
Timby等对160 个小于两月龄的婴儿喂养添加(EF)或不添加(SF)富含MFGM的乳清蛋白浓缩物(Lacprodan®MFGM-10)的婴儿配方奶,对照为80 个母乳喂养的婴儿(BFR)。结果证明MFGM降低了急性中耳炎的风险,减少了在婴儿配方奶粉中退热药物的使用,并对肺炎球菌疫苗的体液应答具有免疫调节作用[72];EF的血清胆固醇浓度大于SF,达到了BFR水平,EF的低密度脂蛋白/高密度脂蛋白与SF无显著差别,但低于BFR,因此MGFM改进了配方奶的脂肪组成,缩小了母乳喂养和配方奶喂养的婴儿在12 月龄时血清脂质状态的差距[73]。Billeaud等[74]对119 个短于14 d的足月儿分别喂养添加有lipid-rich MFGM fraction(MFGM-L)或proteinrich MFGM fraction(MFGM-P,Lacprodan®MFGM-10)的配方奶,实验组的体质量增加、不良反应和发病率与对照组无差别,除了MFGM-P组的湿疹发生率较高。
Veereman-Wauters等[75]在儿童配方奶中加入浓缩的MFGM,结果证明MFGM是安全的,儿童对其有良好的耐受性,且短暂发热的次数显著减少,并改善了行为调节。Zavaleta等[76]在550 个6~11 月龄的婴儿饮食中加入MFGM(Lacprodan®MFGM-10)喂养婴儿6 个月,实验组与对照组在贫血、血清铁蛋白、锌及叶酸含量无差别,但实验组的血性腹泻发作减少,因此MFGM对婴儿的腹泻有积极意义,从而有助于改善婴儿的健康。MFGM对腹泻的影响可归因于对肠道微生物群落的直接作用、增强的免疫功能或作为病原体诱饵的成分。乳铁蛋白还具有抗炎活性,也可能限制感染的作用并减少血性腹泻。
Srong等[77]在大鼠体内测定MFGM的功效,对大鼠喂养脱脂奶粉(MFGM低)或牛甜酪乳粉(MFGM高),结果证明富含MFGM的甜酪乳粉可保护大鼠免受单核细胞增生李斯特菌感染,可能是通过阻止该病原体黏附到肠黏膜所致。乳脂肪球状膜的几个组分可能负责这种保护:溶血磷脂甘油酯的消化产物[78]、SM的消化产物[78]或黄嘌呤氧化酶[79],还需进一步的研究以确定MFGM的单个化合物对减少的李斯特菌感染的影响。更早些年Rueda等[80]测试了补充神经节苷脂的牛乳配方对早产儿粪便微生物群落的影响,得出结论:补充神经节苷脂的牛乳配方可以促进双歧杆菌的生长,并抑制早产新生儿肠道中大肠杆菌和其他潜在致病微生物的生长。Snow等[81]将MFGM从巴氏杀菌乳中分离出来,加入小鼠饮食中,增强了其肠道屏障,可能是神经节苷脂或膜蛋白在起作用;加入大鼠饮食中,减少了其异常隐窝病灶的发生率,可预防结肠癌的发生,这些可能是SM或膜蛋白在起作用[82]。
3 现有的MFGM产品及其制备
现市面上已有一些脂肪球膜的产品,有些已添加入婴幼儿配方奶粉如Enfinitas蓝臻和Enfamil®。市售的富含磷脂的产品,其成分及含量如下:1)Lacprodan®MFGM-10:总蛋白73%(质量分数,下同)、MFGM蛋白8%、磷脂7%、唾液酸2%、免疫球蛋白G 5%、乳铁蛋白0.2%、神经节苷脂0.2%。其磷脂含量为452 mg/L,包括PI(41 mg/L)、PS(58 mg/L)、PE(127 mg/L)、PC(120 mg/L)和SM(106 mg/L)[74]。乳清蛋白与酪蛋白的比例为60∶40,与成熟母乳相似。2)Lacprodan®PL-20:至少含有16%的磷脂、SM、神经节苷脂的牛乳蛋白浓缩物及大约55%的干蛋白质浓缩物,具有丰富的生物活性脂质。Lacprodan®PL-20是胆碱,PS和其他生物重要脂质的天然来源,如含唾液酸的神经节苷脂和支持认知功能和脑发育所需的SM。3)BAEF、SM2、SM3和SM4粉:Cor-Powder®SM3:胆固醇含量较低,含14%磷脂,原料:浓缩黄油或牛乳脂肪;Cor-Powder®SM2:含7%磷脂;Cor-Nutri®SM2 SM3:磷脂浓缩至天然乳的20~30 倍。4)BSC:每100 g含有52.30 g蛋白质、总脂质36.20 g、磷脂13.67 g、神经节苷脂0.63 g、乳糖6.60 g及矿物质5.20 g[68]。5)lipid-rich MFGM fraction:其中磷脂含量647 mg/L,包括PI(57 mg/L)、PS(80 mg/L)、PE(187 mg/L)、PC(173 mg/L)和SM(141 mg/L)[74]。6)酪乳粉浓缩物BPC50、BPC60、G600、PC700:BPC50极性脂质质量分数15%[31];BPC60极性脂质质量分数15.2%[83];G600极性脂质质量分数16.5%[31];PC700脂质质量分数85%、乳糖质量分数7%和水分质量分数1.7%[84],极性脂质质量分数60.6%[31,83],重要的脂肪酸为油酸(31%)、棕榈酸(21%)和硬脂酸(11%)[85]。BPC50、BPC60、G600、PC700的极性脂质组成见表6。

表6 BPC50、BPC60、G600、PC700的极性脂质组成Table6 Polar lipid composition in BPC50, BPC60, G600 and PC700

图2 MFGM分离方法[79]Fig.2 Flow chart of MFGM separation[79]
MFGM对婴儿的生长发育具有重要的作用,目前主要是从牛乳里面将MGFM或富含极性脂质的成分提取出来。
Gassi等[86]制备了富含极性脂质的黄油乳清。原料:工业黄油乳清;工艺流程:奶油分离器脱脂→管式杀菌机加热→用乳酸在pH 4.6下凝结并排水→超滤和透析过滤乳清滤液→冷冻干燥。终产物包含31.5%极性脂质、26%蛋白质及34%甘油三酯(干物质计)。其中极性脂质中包含PE(20.9%)、PI(7.2%)、PS(8.6%)、PC(26.8%)和SM(36.5%),这与初始黄油乳清相似,在加工过程中无选择性损失。Dewettinck等[79]则总结了从牛乳中分离MFGM的方法(图2)。
典型的MFGM分离方法大致可分为4 个步骤:脂肪球分离、乳脂洗涤、从脂肪球中释放MFGM和收集MFGM材料。方法都是实验室方法,用于从未处理过的牛乳中分离MFGM材料。脂质含量、蛋白质组成和酶活性因使用收集方法的不同而不同,其他因素如品种、喂养、哺乳期、挤奶频率、乳腺炎、冷却、冷冻、机械应力、高压处理、热处理、均质化和干燥等因素都会影响分离的MFGM材料的得率和组成[79]。因此需要更多的研究以优化工艺条件并提高得率。
4 结 语
虽然研究者们在MFGM的化学组成、物理结构方面已做了一部分工作,但是其营养功能和作用机理方面仍需更深入的研究,国内关于MFGM的研究较少,需要引起研究者们的注意。
未来在MFGM的研究中几个重要的方向包括:我国人乳脂中MFGM中各种磷脂的脂肪酸的组成的数据;MFGM中其他极性脂的组成,如神经节苷脂、脑苷脂类等;MFGM中单一组分具体的营养功能研究;MFGM的结构对婴儿的生长和发育方面的影响;优化MFGM的分离及加工生产工艺等。此外,还需要进行更多的动物实验以确定为婴儿提供最佳生长和健康益处的有效磷脂含量,不仅在磷脂种类上,而且应具体到脂肪酸组成方面。

