不同质量浓度鲢鱼肌球蛋白低温自组装动力学及理化性质
高 霞,曹立伟,熊善柏,2,胡 杨,2,尤 娟,2,刘 茹,2,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
肌球蛋白是肌纤维蛋白的重要组成部分,也是鱼糜形成凝胶最重要的功能性蛋白[1-2],肌球蛋白在体外很不稳定,会迅速组装成微丝,呈现出高度有序的组装特性[3]。组装体的尺寸和形态受自组装条件的影响,比如蛋白浓度、温度[4-5]、pH值、盐浓度[6]、盐的种类[7]和溶剂类型等[8]。因此,可通过控制自组装条件来制备不同的肌球蛋白组装体,进而设计成不同性能的产品。肌球蛋白大分子的自组装需要一定的浓度,浓度较低时,自组装不能进行[9]。随蛋白浓度增加,蛋白分子的疏水性区域相互接触,促使蛋白分子间相互作用[10],大分子自组装,进而絮凝、成胶甚至形成紧密的网络结构[11]。且随蛋白浓度增加,蛋白凝胶的强度会提高[12-13]。此外,Adam等[14]研究了几种不同浓度的大分子溶液(极稀溶液、稀溶液、高浓度溶液),证明这些大分子间的交联依次呈现递增的趋势。鱼糜加工过程中,低温下初加工需较长的时间,低温下肌球蛋白低聚物会自组装成簇,影响鱼糜的凝胶特性[15-16],二段式加热有利于鱼糜形成高弹性和持水性的凝胶体[17]。目前大多数研究集中于较高温度下肌球蛋白分子的组装和成胶[18-19],对低温下肌球蛋白自组装的浓度效应鲜见报道。研究肌球蛋白低温自组装动力学及理化性能,不仅能为提高自组装能力提供新的切入点,还可为减少肌球蛋白在热胶凝前不期望的自组装,提高其热凝胶性能提供参考。
本实验以鲢鱼肉为原料提取肌球蛋白,采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察肌球蛋白组装体的微观结构,通过研究不同质量浓度肌球蛋白在低温自组装过程中蛋白质构象和分子间作用,以及组装体的浊度和粒径的变化,来探讨低温下肌球蛋白在不同质量浓度下自组装的特点,获得不同质量浓度肌球蛋白低温自组装动力学方程,并对组装体的流变学性能进行分析,以期为拓宽鱼蛋白的应用领域、提高鱼蛋白的胶凝特性提供理论依据。
1 材料与方法
1.1 材料与试剂
鲢(Hypophthalmichthyx molitrix),个体质量约为1.5 kg,购自华中农大菜市场,将活鲢鱼迅速运回实验室,宰杀取背脊部肉,暂时不用的置于4 ℃冰箱里保存,所用实验原料均是当天的新鲜鱼肉。
牛血清白蛋白(分析纯) 武汉科瑞生物技术有限公司;罗丹明B染料(分析纯) 美国Sigma-Aldrich公司;β-巯基乙醇(β-mercaptoethanol,β-ME)(纯度≥99.0%)、叠氮钠(NaN3)(高级纯) 美国Amresco公司;其他均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
1750型紫外-可见分光光度计 日本岛津公司;722 N型可见分光光度计 上海仪电分析仪器有限公司;ZEN 3600激光粒度仪 英国马尔文仪器有限公司;AR 2000 ex流变仪 英国TA公司;LSM 510 META CLSM德国Zeiss公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考Cao Liwei等[20]的方法提取肌球蛋白,尸僵前的鲢鱼背脊肉用食品调理机绞碎,向绞碎后的鱼肉中加入10 倍体积含0.1 mol/L KCl、0.2 mg/mL NaN3和20 mmol/L Tris-HCl的缓冲液(pH 7.5),并用高速分散均质机于9 000 r/min下均质1~2 min。均质液于4 ℃下放置15 min,8 000 r/min离心5 min后去除上清液,将沉淀于5 倍体积0.45 mol/L KCl-20 mmol/L Tris-HCl 缓冲液(pH 6.8,含5 mmol/L β-ME、0.2 mol/L Mg2CO3、1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸)中悬浮,同时加入ATP-Na2使肌球蛋白与肌动蛋白解离,ATPNa2的终浓度控制为5 mmol/L。于4 ℃下放置60 min后10 000 r/min 离心10 min,上清液用6 倍体积1 mmol/L KHCO3稀释,于4 ℃下放置60 min,然后12 000 r/min 离心10 min。沉淀重新用2.5 倍体积的20 mmol/L Tris-HCl缓冲液(pH 7.5,含0.5 mol/L KCl、5 mmol/L β-ME)悬浮,于4 ℃下放置15 min,再用2.5 倍体积的1 mmol/L KHCO3稀释,并加MgCl2固体粉末至终浓度为10 mmol/L,于4 ℃下放置过夜,然后12 000 r/min离心15 min收集沉淀,得到纯化的肌球蛋白。肌球蛋白质量浓度测定参考Lowry法[21],用牛血清白蛋白作标曲。纯度采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)来检验。
1.3.2 样品处理与制备
用0.5 mol/L NaCl-20 mmol/L Tris-HCl缓冲液(pH 7.0)将肌球蛋白的质量浓度分别调整至0.1、0.3、0.5、1.0、5.0 mg/mL和8.0 mg/mL,分别于4 ℃下静置2、12、24、36 h,取样,测定相应的理化指标,其中,5.0 mg/mL和8.0 mg/mL样品仅用于静态流变学测定和CLSM观察。
1.3.3 紫外吸收光谱测定
以0.5 mol/L NaCl-20 mmol/L Tris-HCl缓冲液(pH 7.0)为参比空白,采用紫外-可见分光光度计在230~350 nm波长范围内进行中速扫描,采样间隔1 nm。利用Origin 8.0软件作图。
1.3.4 浊度测定
浊度的测定参考Yongsawatdigul等[22]的方法,以溶液320 nm波长处的吸光度(A320nm)来表示蛋白质溶液的浊度。
1.3.5 动态光散射表征粒径大小
参考Zhan Fuchao等[23]的方法,采用激光粒度仪测定样品的平均粒径及粒径分布。水溶剂黏度0.8873 mPa·s、介质折射率1.33、物质折射率1.45,相关测量时间函数通过自动程序分析,平均粒径由电脑自动输出。吸取2 mL样液置于“聚苯乙烯”样品池中,放入仪器中于25 ℃下进行测试(散射角度173°)。每个样品测试3 次,每次测试激光扫描15 圈。
采用一阶模型[24](式(1))对组装体的平均粒径数据进行拟合。

式中:Z表示t时刻的平均粒径/nm;Z0表示初始平均粒径/nm;k表示组装速率/h-1;t表示组装时间/h。
1.3.6 静态流变学性能测定
采用动态流变仪在flow模式下扫描,测试条件为:温度4 ℃、锥板(2°)直径40 mm、载物台与平板间距54 μm。数据获取模式为Continuous step,以剪切速率(γ)为变量,变量范围为0.1~1000 s-1,得到剪切应力(τ)随剪切速率变化曲线,采用幂律定律(式(2))拟合τ-γ曲线。

式中:τ表示剪切应力/Pa;K表示稠度系数/(Pa·sn);γ表示剪切速率/s-1;n表示流动指数。
表观黏度(ηa/(Pa·s))可由式(3)计算获得。

采用Cross模型(式(4))拟合其零剪切黏度(η0)。

式中:η∞表示无穷剪切黏度/(Pa·s);η0表示零剪切黏度/(Pa·s);α表示Cross模型参数。
1.3.7 CLSM分析
采用CLSM观察肌球蛋白组装体(组装12 h)的立体显微结构及在溶液中的分布状况。使用罗丹明B对蛋白质进行标记,磁力搅拌后得到均匀样品,待测。标记量为每50 mL样液加入体积分数0.2%罗丹明B 100 μL。取适量的样品于显微镜长盖玻片上,使用10×目镜和100×物镜观测,选用荧光模式。采用He/Ne激光器作为激发光源,发射波长确定为543 nm,使用光电倍增管进行荧光检测。扫描密度为1 024×1 024,扫描频率为40 Hz。参数确定后进行扫描,采集液滴图像。仪器平均多次扫描信号的波动,以减少对激光共聚焦图片的影响。实验在25 ℃空调房间内避光测量。用仪器自带的LSM Image Examiner软件对图像进行分析和数据处理。
1.4 数据处理
所有数据均采用Origin 8.0软件作图,SAS 8.0统计软件进行分析,用ANOVA进行方差分析,显著性检验方法为最小显著性差异(least significant difference,LSD)法,P<0.05表示差异显著。有关数据为3 次以上平均值。
2 结果与分析
2.1 鲢鱼肌球蛋白纯度鉴定

图1 提取的肌球蛋白的SDS-PAGE谱图(a)和各条带所占比例(b)Fig.1 SDS-PAGE patterns of the extracted myosin (a) and the percentage of each band in SDS-PAGE pattern (b)
提取的鲢肌球蛋白的SDS-PAGE图见图1a,肌球蛋白重链的分子质量为223 kDa,肌球蛋白轻链的分子质量为21、14 kDa,这与之前学者报道的肌球蛋白分子由2 条分子质量各为220 kDa的重链和4 条分子质量在17~22 kDa范围的轻链所组成[25]是基本一致的。图1a中几乎看不出肌动蛋白的条带(43 kDa),在70 kDa处有含量甚微的原肌球蛋白带。肌球蛋白具有物种差异性,且不同鱼种之间也有差别,尤其体现在轻链上。通过Gel-pro analyzer 4.0凝胶定量分析软件计算得出各条带的比例分布。由图1b可知,肌球蛋白重链在整个泳道所有条带中所占比例达75%,同时也计算得出肌球蛋白的纯度达92%,说明所得肌球蛋白的纯度高,可作为本实验原料使用。
2.2 不同质量浓度肌球蛋白低温放置过程中的紫外吸收光谱
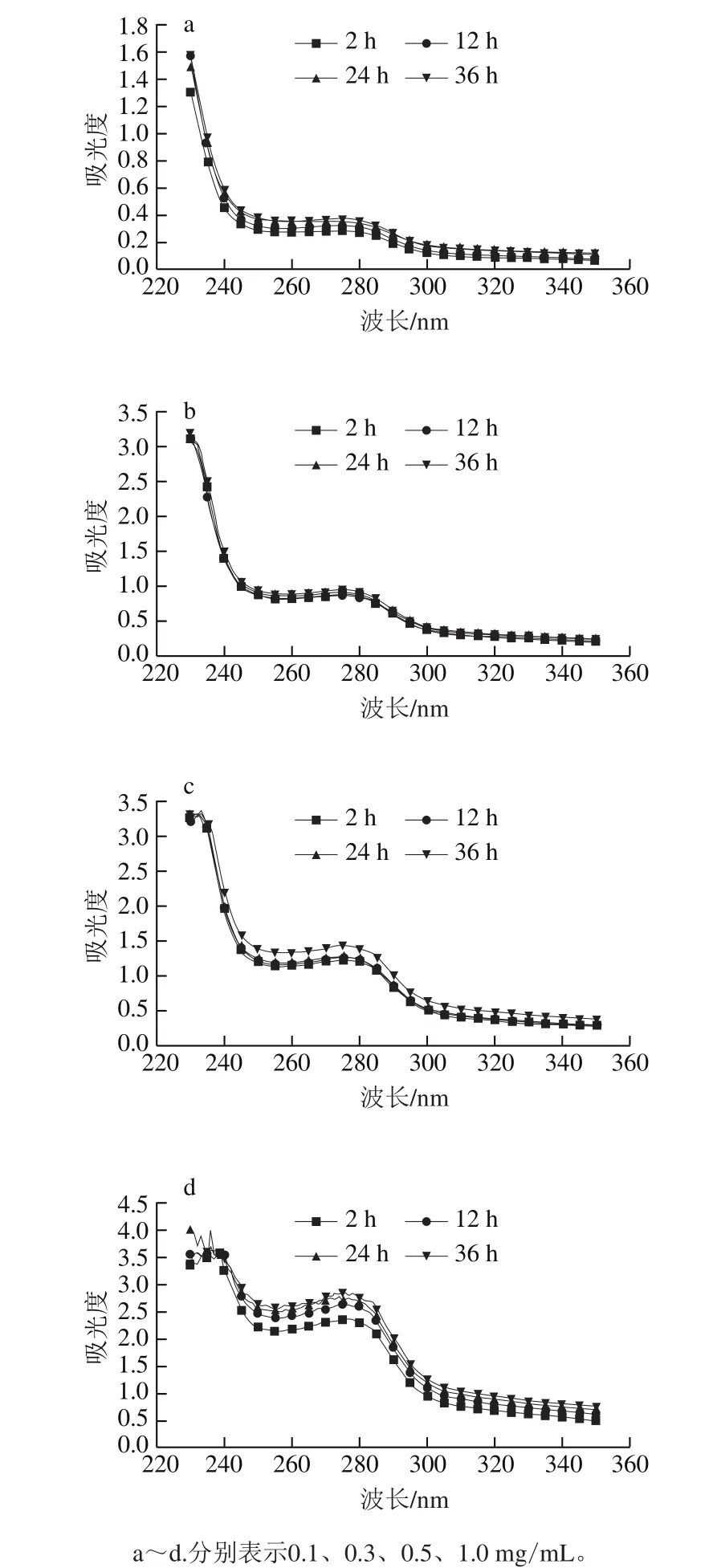
图2 不同质量浓度肌球蛋白溶液低温放置过程中的紫外吸收光谱Fig.2 UV absorption spectra of myosin assembly suspension under the condition with different concentrations
紫外吸收光谱是一种研究蛋白构象的有效手段[26]。由图2可以看出,肌球蛋白溶液在276 nm波长处有明显的吸收峰,表明有色氨酸、酪氨酸等疏水性氨基酸残基的存在[27],随着放置时间的延长,该吸光度呈增大趋势,说明肌球蛋白分子链逐渐伸展,暴露出更多的疏水性残基。320~350 nm波长范围内吸光度也随放置时间的延长而增大,结合276 nm处吸光度的变化,推测放置过程中肌球蛋白分子伸展暴露出更多的活性基团,有利于分子间相互作用,形成了大的组装体,增加了光散射强度。Brenner等[15]曾报道了类似的现象,鳕鱼肌球蛋白在低温条件下也会自发组装形成寡聚体。随着蛋白质量浓度的增加,吸光度呈增加趋势,且随着放置时间的延长,质量浓度高的肌球蛋白样品吸光度增大的幅度更大。
2.3 不同质量浓度肌球蛋白低温放置过程中的浊度变化

图3 不同质量浓度下肌球蛋白低温放置过程中的浊度变化Fig.3 Turbidity of myosin suspension at different concentrations
浊度可用于反映蛋白质的组装情况。由图3可知,0.1、0.3 mg/mL的肌球蛋白样品在放置的前24 h,其浊度随放置时间的延长显著增大,24 h后浊度缓慢增大但无显著变化。浊度增大可能是由于肌球蛋白自组装形成了大的组装体[2,28],有研究报道,低温下肌球蛋白分子间主要依靠氢键、静电相互作用等组装形成微粗丝[6]。随后肌球蛋白以微粗丝为“成核中心”,继续组装形成更大尺寸的粗丝,浊度进一步增大,24 h以后肌球蛋白的自组装基本达到了动态平衡。0.5、1.0 mg/mL肌球蛋白样品的浊度随着放置时间(0~36 h)的延长而显著增大(P<0.05),说明在放置时间(36 h)内肌球蛋白自组装持续进行。肌球蛋白的自组装行为是一个有序排列的过程,质量浓度越大,混乱度也越大,达到有序结构的时间也相对越长。
2.4 不同质量浓度肌球蛋白低温放置过程中的粒径变化
为进一步了解肌球蛋白组装体的尺寸大小和稳定性,采用动态光散射技术测定了肌球蛋白在组装过程中的粒径分布及平均粒径,结果见图4。由图4a可知,随着放置时间的延长(2~36 h)和蛋白质量浓度的增加(0.1~1.0 mg/mL),肌球蛋白组装体的粒径分布均向大粒径方向移动,说明自组装在进行,且肌球蛋白质量浓度越大,形成的组装体越大。由图4b可知,0.1 mg/mL的肌球蛋白组装体的平均粒径在2~12 h之间随放置时间延长显著增大(P<0.05),继续延长自组装时间(12~36 h)对平均粒径的影响不显著(P>0.05),说明低质量浓度肌球蛋白自组装能较快达到平衡。0.3 mg/mL的肌球蛋白组装体的平均粒径在2~12 h之间显著增大(P<0.05),但在12~24 h间增长不显著(P>0.05),继续延长自组装时间(24~36 h),平均粒径又显著增大。0.5、1.0 mg/mL的肌球蛋白组装体的平均粒径随着自组装时间(2~36 h)的延长一直呈显著上升趋势(P<0.05),说明提高蛋白质量浓度后自组装平衡所需的时间也随之延长,各质量浓度下肌球蛋白样品的自组装可划分为成核、组装、平衡3个阶段。该结果与浊度结果基本一致。


图1 不同质量浓度下肌球蛋白组装体的粒径分布(a)及平均粒径(b)Fig.1 Particle sizes (a) and Z-average particle sizes (b) of myosin assemblies at different concentrations
为进一步探究肌球蛋白组装动力学,采用一阶模型对其平均粒径进行拟合,方程P值均小于0.05,说明该模型具有较高的拟合精度,所得动力学参数见表1。随着蛋白质量浓度增大(0.1~1.0 mg/mL),肌球蛋白样品的初始平均粒径(Z0)呈上升趋势,即质量浓度越高,初始组装体越大。肌球蛋白质量浓度较低(0.1~0.3 mg/mL)时,组装速率k值较接近,当肌球蛋白质量浓度由0.3 mg/mL增至1.0 mg/mL时,组装速率迅速增大,说明肌球蛋白在低质量浓度时组装速率慢;当质量浓度提高至0.5 mg/mL以上时,肌球蛋白之间相互接触的几率更大,暴露出的活性基团更易发生相互作用,组装速率加快,分子以微粗丝为成核中心,继续组装成为更大的组装体。

表1 低温下肌球蛋白自组装的动力学参数Table1 Kinetic parameters for myosin self-assembly at low temperature
根据表1中得到的参数,进一步对组装速率k与质量浓度ρ进行拟合,可用线性方程很好地描述两者之间的关系。因此,将质量浓度作为动力学方程的自变量之一,重新拟合得到的方程为:(P<0.000 1),说明该方程可以很好地描述不同质量浓度肌球蛋白在低温自组装过程中粒径随时间的变化。且通过该方程可更直观地看出,速率常数随着蛋白质量浓度的增加而增大,表明质量浓度较高时组装体粒径增大的速度加快。
2.5 不同质量浓度肌球蛋白在低温放置过程中流变学特性
图5为自组装12 h肌球蛋白样品的剪切应力τ随剪切速率γ的变化(其他放置时间下趋势类似,故省略)。溶液的剪切应力随着剪切速率的增加而增大,在低剪切速率下,剪切应力随剪切速率的增长呈近似直线增长的趋势,表现出牛顿流体的性能,此阶段流体的黏性表征为零剪切黏度(η0),不受剪切速率的影响。利用Cross模型拟合所得η0见表2,对于低质量浓度(0.1~0.3 mg/mL)的肌球蛋白样品而言,延长放置时间,η0很小且没有明显变化,说明低质量浓度时肌球蛋白相对稳定,分子间相互作用较弱,流动性强。对于质量浓度为0.5~8.0 mg/mL的肌球蛋白,随着自组装时间从2 h延长至24 h,η0逐渐增大,表明肌球蛋白分子间相互作用增强,形成了具有一定结构的组装体,流动性下降。该实验结果表明肌球蛋白自组装需要一定的质量浓度(不低于0.5 mg/mL),达到该质量浓度分子链间相互交联和缠结形成组装体。

图5 自组装12 h下肌球蛋白溶液的τ-γ曲线Fig.5 τ-γ curves of silver carp myosin at the self-assembly time of12 h
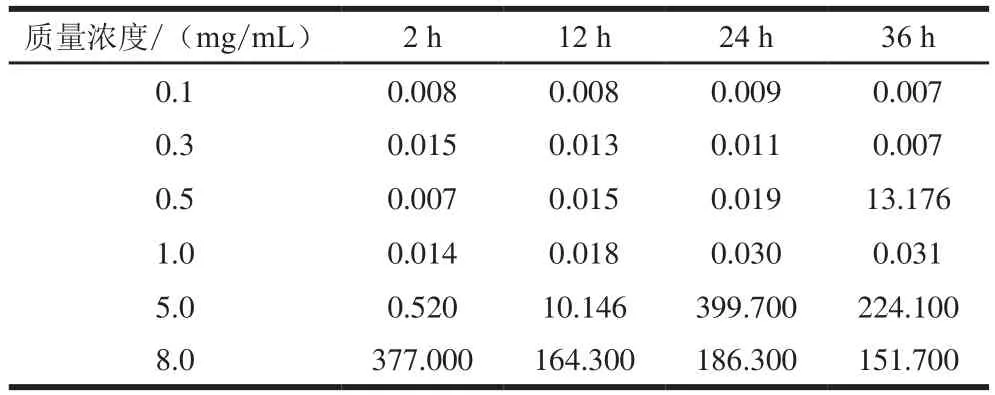
表2 不同自组装时间下肌球蛋白溶液的η0Table2 Parameter η0of myosin suspension at different self-assembly time Pa·s
在22~220 s-1剪切速率范围内,肌球蛋白组装体部分解体,分子链段随流动方向拉伸、取向,剪切应力与剪切速率不能维持正比关系,偏离直线变成向下弯曲的曲线(图5),表现出剪切稀化行为,采用幂律定律进行拟合,结果见表3。所得模型P值均小于0.01,说明具有较高的拟合精度,所有肌球蛋白溶液的n值均小于1,表现为假塑性流体。随着自组装时间(2~36 h)的延长,质量浓度为0.5~8.0 mg/mL的肌球蛋白所形成的组装体的n值逐渐降低,K值逐渐增大;同样,随着蛋白质量浓度增加,n值也下降,说明溶液的假塑性增强,推测这是由于肌球蛋白分子间发生了相互作用,导致所形成组装体的尺寸逐渐增大而流动性降低。这与本实验室前期研究鱼肉与猪肉肌动球蛋白静态流变学性能的结果一致,肌动球蛋白质量浓度增大也会使其假塑性增强,降低其流动性[29]。

表3 不同自组装时间下肌球蛋白溶液的稠度系数(K)和流动指数(n)Table3 Consistency coef fi cients (K) and fl ow indices (n) for myosin suspension at different self-assembly time


图6 不同组装时间下肌球蛋白表观黏度(ηa)与剪切速率(γ)的关系Fig.6 Relationship between apparent viscosity (ηa) of myosin and shear rate (γ) at different self-assembly time
由图6可知,所有样品的ηa都随着γ增大先迅速下降后缓慢下降至趋于稳定,这种趋势在较高质量浓度(1.0~8.0 mg/mL)下更直观,推测较高质量浓度下形成的肌球蛋白组装体具有相互缠绕和交联的长分子链结构,在静止时将保持其内部结构的有序性,因而具有较高的内部阻力阻碍流动,表现为较高的黏度;低剪切速率下,尽管有轻微的剪切取向效应,但分子的无规则布朗运动使所有的分子或分子组装体都处于无序状态。随着γ的增大,肌球蛋白溶液将沿着剪切驱动力的方向流动,部分组装体解体,分子链逐渐解缠绕、拉伸和取向,排列后的分子或分子组装体更容易相互滑移,溶液的ηa急剧下降[30]。当γ增大到一定程度,ηa趋于稳定,即表现出类似牛顿流体的性能。
2.6 不同质量浓度肌球蛋白低温放置过程中的微观结构

图7 肌球蛋白组装体的CLSM图(×1 000)Fig.7 CLSM images of myosin assemblies ( × 1 000)
图7 为低温下肌球蛋白溶液组装12 h后的CLSM图。组装体的尺寸随蛋白质量浓度增加而增大;当质量浓度为0.1、0.3 mg/mL时,溶液中可以观察到极少量肌球蛋白的存在;质量浓度为0.5 mg/mL的肌球蛋白经过自组装后形成了均一分散在溶液中的小聚集体(粒径<20 μm)。这是由于低质量浓度下肌球蛋白分子间的距离较大,分子间自组装行为不易进行且组装速率较低;随着蛋白质量浓度增大(大于等于0.5 mg/mL时),肌球蛋白自组装速率提高,甚至组装成肉眼可见的粗丝(5.0、8.0 mg/mL)。综上分析可知,肌球蛋白低温快速自组装的临界质量浓度为0.5 mg/mL,这与胶原蛋白自组装的临界质量浓度在0.30~0.45 mg/mL之间相近[31]。
3 结 论
低温(4 ℃)放置过程中肌球蛋白的自组装行为表现出较强的质量浓度依赖性。随自组装时间的延长和蛋白质量浓度增大,分子间相互作用加强,初步聚集成微丝并继续以其为成核中心组装成更大的组装体,使得肌球蛋白溶液在230~350 nm波长范围内的吸光度和浊度增大;动态光散射所测组装体粒径的变化可由动力学模型
较好地描述,当质量浓度提高到0.5 mg/mL时,肌球蛋白溶液的组装速率加快;随着肌球蛋白质量浓度进一步增大,组装平衡时间也延长。进一步用静态流变学表征样品的性能变化发现,各质量浓度肌球蛋白溶液都呈现出典型的剪切稀化行为,随蛋白质量浓度提高,肌球蛋白组装体对溶液流动的阻碍作用增强,表观黏度随剪切速率增大而降低;CLSM观察发现,0.5 mg/mL时溶液所形成的组装体尺寸较小且分布均匀,再提高质量浓度便能形成肉眼可见的粗丝。综上结果推测肌球蛋白快速自组装的临界质量浓度是0.5 mg/mL。

