应用基因本体数据库分析中波紫外线对HaCaT细胞microRNA表达的影响
杨 玲,许 速,胡中华
皮肤在接受一定累积剂量的紫外线辐射后可发生一系列细胞内变化,如细胞内活性氧(reactive oxygen species,ROS)和氧化应激标志物(8-氧-鸟核苷、异前列烷、硝基酪氨酸等)水平升高、细胞核染色体断裂和线粒体DNA突变等,从而激活与炎症或肿瘤相关的信号转导途径,并进一步调节其下游基因的表达,最终启动皮肤的损伤、衰老甚至癌变等过程[1]。近年来,微小RNA(microRNA,miRNA)逐渐引起各相关领域的重视,许多研究表明miRNA在细胞的增殖、分化与凋亡、生物体的生长发育、免疫反应以及疾病发生发展中发挥重要作用[2]。为探讨miRNA在紫外线引起皮肤光损伤机制中的作用,本研究利用生物芯片技术检测中波紫外线(ultraviolet B,UVB)辐照人角质形成细胞的miRNA表达,并应用基因本体(gene ontology,GO)数据库分析差异miRNAs的靶基因功能,以期从miRNA组学水平探讨UVB致皮肤光损伤的作用机制。
1 材料与方法
1.1 材料
永生化人角质形成细胞(HaCaT细胞,昆明怀天科技有限公司)。miRNA抽提试剂盒(德国QIAGEN公司),miRNA标记和杂交试剂盒、基因表达洗涤缓冲液(美国Agilent公司);Agilent Bioanalyzer 2100电泳分析仪、Nano Drop ND-2000分光光度计、滚动杂交炉、微阵列扫描仪(美国Agilent公司)。
1.2 方法
1.2.1 细胞培养及分组 HaCaT细胞以DMEM(高糖)培养基调整浓度为105/ml~106/ml,接种于6孔培养板中继续培养24 h,待其贴壁后用于后续观察及实验检测。将亚融合状态的细胞分为对照组和照光组,辐照前各孔细胞均弃去培养基,加磷酸盐缓冲液(PBS)覆盖,辐照后弃去PBS并加相应培养基继续培养。根据UVB照射剂量对实验细胞分组如下:①未处理组;②100 mJ/cm2UVB组;③200 mJ/cm2UVB组;④400 mJ/cm2UVB组,并设定12 h、24 h为检测时相点。
1.2.2 miRNA的抽提、纯化与标记 根据miRNA抽提试剂盒的标准操作流程进行样品的总RNA抽提,经电泳质检合格后备用。实验样品RNA采用Agilent miRNA芯片配套的试剂盒,按照标准操作流程对样品miRNA进行荧光标记和杂交。杂交条件如下:在滚动杂交炉中,55℃ 20 r/min,滚动杂交20 h,杂交完成后洗片。按上述流程共完成7张人miRNA (8×60K)V21.0芯片的处理。
1.2.3 芯片扫描 应用Agilent微阵列扫描仪对芯片进行扫描,扫描分辨率(scan resolution)=3 μm。 用 Feature Extraction software 10.7.1.1读取数据,最后采用R语言程序包AgiMicroRna进行归一化处理,所用的算法为Quantile。
1.2.4 差异miRNAs筛选 选择倍数差异(fold change,fc)和探针检出标记( fl ag)两个参数设定筛选阈值,每个处理组分别与对照组相比较进行差异miRNA筛选,且至少一组内不出现fl ag 为A(A 表示该探针信号值与背景信号值无明显差异,P 表示该探针信号值与背景信号值有显著差异)的探针,若设定筛选阈值为fc2,则两组比较的倍数值为≥2 倍(上调差异miRNA)或≤0.5 倍(下调差异miRNA),将上述数据经标准化处理后绘制散点图。若设定筛选阈值为fc3,筛选表达变化更有显著的差异miRNA,则两组比较的倍数值为≥3 倍(上调差异miRNA)或≤0.33 倍(下调差异miRNA),即差异miRNA表达更为显著,以上筛选结果可在miRBase序列数据库(网址http://mirbase.org/)中查询其相关信息。
1.2.5 差异miRNA的靶基因预测 采用Target Scan7.0进行靶基因预测,预测阈值为保留total context ++ score<-0.2的结果,并进行基于GO数据库的靶基因功能的富集分析。
1.2.6 GO富集分析 采取的方法是 fi sher精确检验,数据包是clusterPro fi ler,来自R/bioconductor,挑选的标准是落在某个term/GO 上差异的基因数目≥2且P<0.05,并按照富集因子(enrich factor)的值从大小降序排列,取前30个结果绘图。
2 结果
2.1 UVB处理HaCaT细胞的miRNA表达
差异倍数fc是由各处理组与对照组信号值比较所得,首先设定筛选阈值为fc2,图1为100 mJ/cm2、200 mJ/cm2和400 mJ/cm2UVB处理HaCaT细胞12 h和24 h后的差异miRNA表达情况,其中上调表达miRNA为≥2 倍,下调表达miRNA为≤0.5 倍。图1提示不同剂量UVB处理HaCaT细胞后均出现差异miRNA表达,其中400 mJ/cm2UVB处理后的HaCaT细胞差异表达的miRNA最为明显。
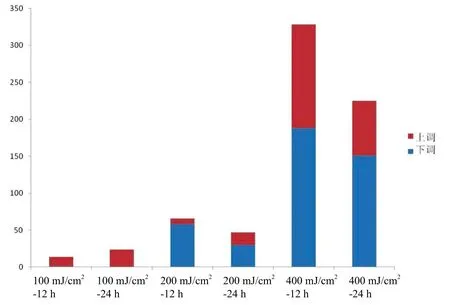
图1 UVB处理HaCaT细胞的miRNA表达
图2为fc阈值下的差异miRNA散点图分布。x轴表示该探针集在对照组样本芯片中标准化后的信号值,y轴表示该探针集在处理组样本芯片中标准化后的信号值,图中每一个点代表芯片上的一个探针集,落在图形中y=x直线上的点,代表该探针在两组样本内的信号值无差异,落在图形中y=x直线两侧有颜色区域的点,代表该探针在两组样本内的信号值有差异,红色点代表上调表达的差异miRNA,蓝色点代表下调表达的差异miRNA。图2提示各处理组和对照组数据总体分布比较集中,信号值分布与图1一致。
根据图1和图2提示,400 mJ/cm2UVB处理组的差异miRNA表达最为显著,将该组(包括12 h和24 h)实验数据设定筛选阈值为fc3,筛选表达变化更为显著的差异miRNA,即两组比较的倍数值为≥3 倍(上调差异miRNA)或≤0.33 倍(下调差异miRNA),具体见表1。
2.2 差异miRNA的靶基因功能分析
主要针对400 mJ/cm2UVB组的差异miRNA进行靶基因预测及GO富集分析 根据富集因子(enrich factor)的值从大小降序排列,并进行分析(图3)。图3提示部分靶基因功能涉及T淋巴细胞介导的细胞毒作用、T淋巴细胞耐受、B淋巴细胞分化、自然杀伤细胞增殖、树突细胞抗原处理提呈、免疫球蛋白产生以及中性粒细胞稳态等。
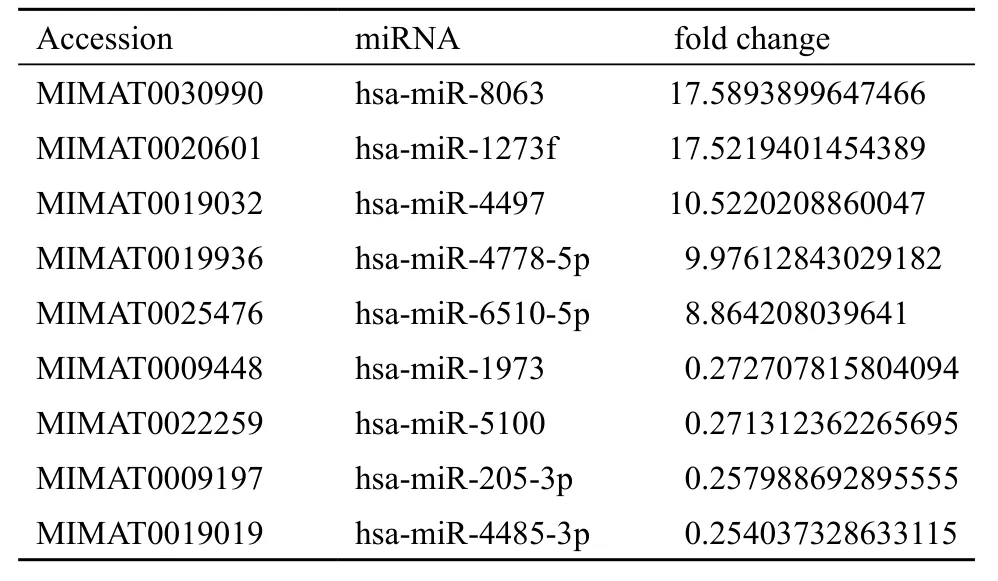
表1 400 mJ/cm2 UVB处理细胞后表达变化显著的差异miRNA
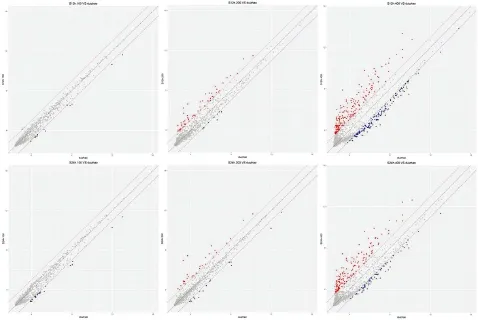
图2 UVB处理HaCaT细胞的差异miRNA信号值分布图
3 讨论
miRNA属于非编码RNA的一类,生物信息学预测每个miRNA均有众多的靶基因,而每个基因的mRNA又有可能受到多个miRNAs的调控,由此构成复杂调控网络的理论基础[3]。一般认为其对靶基因的调控主要发生在翻译水平,影响基因表达的机制是miRNA与靶基因mRNA的3′端非翻译区(UTR)不完全互补结合,影响mRNA的成熟、转运及稳定性,或直接调控翻译过程,从而调节蛋白质的表达水平[4]。

图3 400 mJ/cm2 UVB处理组差异miRNA靶基因功能的GO富集
针对皮肤光损伤的机制研究多集中于炎性因子或炎症递质参与的信号通路,为了探讨其miRNA调控机制,本研究以不同强度UVB辐照HaCaT细胞,在12 h和24 h检测细胞miRNA的表达,发现不同强度UVB作用后的不同时间点HaCaT细胞均有明显的miRNA差异表达,且以高能量强度UVB条件下变化最为显著。说明随着UVB强度及时间的变化,有越来越多的miRNA参与到UVB对细胞机能影响的调控中。该结果与既往研究基本一致[5],可为后续实验提供理论基础。进一步设定更为严格的fc3阈值筛选出9个表达变化明显的miRNAs,其中上调表达的为miR-8063、miR-1273f、miR-4497、miR-4778-5p和miR-6510-5p,下调表达的为miR-1973、miR-5100、miR-205-3p和miR-4485-3p。查阅相关文献发现,上述miRNAs有的参与了炎症的发生、发展或转归过程,如miR-8063在感染(如肺部感染、皮肤感染等)引起的败血症患者血清中均有差异表达,并对判断疾病的预后有一定的提示作用[6];miR-6510-5p在银屑病皮损中的差异表达提示其参与银屑病发生、发展调控[7]。其他的miRNAs则集中于肿瘤研究领域,如Reshmi等[8]利用一种新的计算工具“Mpred”鉴定并验证了miR-1273f序列在宫颈癌组织中的表达,提出其可能在肿瘤发生发展中起作用的观点;Jima等[9]对比了miR-4497和miR-4485-3p在恶性B淋巴细胞和正常细胞中的表达情况,发现二者在恶性B淋巴细胞中均有差异性表达;miR-4778-5p在乳腺肿瘤组织中存在差异表达[10]、miR-1973在儿童急性淋巴细胞性白血病中存在差异表达[11]、miR-205-3p在宫颈癌和鼻咽癌中存在差异表达[12,13],以上均提示这些miRNAs不同程度地参与了肿瘤的发病机制。此外,研究还发现,miR-5100在干燥综合征患者的唾液腺中差异表达[14],推测其与机体的自身免疫调节相关。鉴于皮肤作为人体与外界环境的第一道屏障,且皮肤属于人体特殊的免疫器官,因而推测上述miRNAs在UVB诱导的皮肤致炎、致瘤以及免疫应答等过程中也具有重要的调控作用,并提示其可能是UVB致角质形成细胞病变的机制之一,值得进一步研究和探索。
GO是一个在生物信息学领域中广泛使用的本体,用于提供一个可具代表性的规范化的基因和基因产物特性的术语描绘或词义解释的工作平台,其涉及的基因和基因产物涵盖生物学的三个方面:细胞组分(cellular component)、分子功能(molecular function)和生物过程(biological process)。通过将差异基因做GO富集分析,可以把基因按照不同的功能进行归类,并对基因进行注释和分类,从而为继续进行通路分析打下基础[15]。本实验应用GO数据库对UVB诱导的差异表达miRNA的靶基因进行功能富集分析和分类,发现一部分差异基因的功能涉及T淋巴细胞介导的细胞毒作用、T淋巴细胞耐受、B淋巴细胞分化、自然杀伤细胞增殖、树突细胞抗原处理提呈、免疫球蛋白产生以及中性粒细胞稳态等方面,进一步说明UVB诱导的角质形成细胞差异miRNA的靶基因直接或间接参与了机体的体液免疫和细胞免疫过程,并最终调控致炎或致瘤的病理过程。
综上所述,本研究利用miRNA 表达谱芯片筛选了UVB辐照HaCaT细胞的差异miRNA,并应用GO数据库分析了UVB致角质形成细胞损伤过程中可能起显著作用的靶基因功能,为UVB致皮肤病变的机制研究提供了一些理论基础。但本研究尚处于初步探索阶段,还存在一些不足之处:其一,HaCaT细胞是经特殊培养条件诱导后永生化的细胞株,从基因调节方面看这种细胞与正常角质形成细胞相比有一定的差别,由此得到的实验结果推导延伸至正常表皮细胞,其准确性及代表性有所偏差,下一步可利用原代培养的角质形成细胞验证上述结果的可信度。其二,miRNA参与细胞的基因调控过程,涉及从基因表达到核酸转录再到蛋白质翻译直至产生生物学效应等一系列复杂的中间环节,期间的影响因素错综复杂。本研究应用GO数据库对差异miRNA的靶基因功能进行了初步分析,所涉及的靶基因功能较为宽泛,下一步实验研究可选定某几个miRNA片段与细胞生物学效应相关性进行研究,从而为UVB损伤皮肤角质形成细胞的HaCaT细胞的miRNA调控机制积累更有意义的结论。

