表现为神经淋巴瘤病的外周T细胞淋巴瘤一例
何惟薇,倪春雅,毕海霞,杨 凯,徐慧青,朱海泳,陈 洁,白妍双,吴文育
临床资料
患者,男,31岁。全身反复出现皮损8年余,伴肢端麻木感,于2016年1月入院。8年前(2008年11月26日),无明显诱因患者全身出现散在数十片大小不等红斑,按“环状红斑”予白芍总苷胶囊0.6 g每日3次口服,治疗3周皮损无变化。2个月后,双手第4、5指出现对称性麻木,肌电图检查示:尺神经传导减慢,拟诊为肘管综合征,未予治疗。3个月后,皮损组织病理提示脂膜炎,口服醋酸泼尼松片40 mg每早顿服,2周后所有红斑均消退,手指麻木略改善,醋酸泼尼松片每10天减5 mg,共用药3个月停药。9个月后,再次出现进行性双足麻木、伴低热(37.3~37.8℃)。14个月后,肌电图示:获得性多灶性感觉运动神经病,脱髓鞘为主,诊断为Lewissumner综合征,予注射用甲泼尼龙琥珀酸钠冲击治疗1周(具体剂量不详),随后口服醋酸泼尼松片40 mg每早顿服,神经症状逐渐改善,约每2周减2.5~5 mg,至半年左右停药。4年前,全身再次出现散在红斑,自行外涂含糖皮质激素软膏,红斑2周左右可消退,但不断有新发皮损。3年零5个月前,左上腹壁出现一直径2 cm左右的结节,轻压痛,随后左小腿屈侧出现类似结节,伴左踝关节肿胀,之后6个月,结节自行消退。2年前,肢端感觉障碍加重,双小腿出现弥漫性肿胀,右肘活动受限。4个月前,双上肢多谱勒超声提示:双上肢尺神经弥漫性肿胀,右侧明显,诊断肘管综合征(中重度),并行右肘部尺神经松解、肌下前置术,术后切除的部分右肘尺神经及周围组织病理提示为细胞毒表型的外周T细胞淋巴瘤。当时给予术后肢体康复治疗,右肘活动度较前好转,但肢端麻木等症状无改善,躯干部及双下肢出现新发红斑。患者自发病以来,神志清楚,精神好,饮食、睡眠正常,二便正常,体重无明显下降。既往体健,无化学、放射毒物接触史,否认家族中有遗传病及类似病史。
体格检查:一般状况良好,神清,精神可,双侧颈部及腹股沟可触及数个直径<1 cm的淋巴结,质软至韧,活动度可,无触痛,余浅表淋巴结扪及明显增大。心、肺、腹查体未见异常。四肢近端肌力Ⅴ级,远端肌力Ⅴ-级,肌张力正常,双手尺侧及双足深浅感觉减退,双下肢腱反射减弱,双侧Babinski征(-),Kernig征(-)。皮肤科查体:四肢散在直径1 ~5 cm淡红至紫红色斑片,境界清楚,表面光滑,双侧小腿远端散在直径2~5 cm肿胀性红色斑块及皮下结节,界欠清,表面皮温较高,结节质韧,有轻压痛(图1a-1c)。
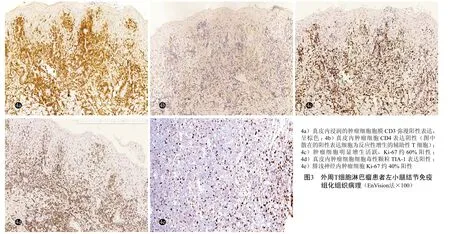
辅助检查:血、尿、粪常规及肝肾功能正常。四肢肌电图示:获得性多灶性感觉运动神经病,脱髓鞘为主。四肢体表超声多谱勒示:双上肢尺神经弥漫性肿胀,连续性存在,右侧明显;小腿红斑肿胀部位为肿大、增粗的腓浅神经。双小腿磁共振成像(MRI)平扫+增强示:左侧胫神经、双侧腓浅神经增粗、信号增高,增强扫描后可见明显强化;双小腿皮下软组织条片影,增强扫描后可见强化。正电子发射计算机断层显像(PET-CT)示:淋巴瘤,双上臂、小腿、足部多发软组织结节,FDG代谢增高;两侧上颈部、髂血管旁、腹股沟多发增大淋巴结,FDG代谢增高,淋巴瘤侵犯可能。骨髓穿刺及脑脊液检查未见异常。右肘尺神经组织病理:弥漫增生的淋巴样细胞,细胞体积小,形态较单一,胞质较少,核深染,染色质粗,核仁不明显(图2);免疫组化:肿瘤细胞CD3、CD5、TIA-1均阳性,Ki-67约40%~70%阳性(图3)。CD8、CD4、CD10、CD20、CD30、CD56、PAX5均阴性;TCR克隆性基因重排阳性;EBER原位杂交阴性。左小腿前侧皮肤结节组织病理示:表皮和真皮浅层、皮下脂肪、皮肤附属器及部分血管周围较多异形淋巴样细胞浸润,细胞中等大、胞质空亮,核圆形或不规则,染色质深,核仁不明显(图4);免疫组化染色:CD3、CD5、GrB、TIA-1均阳性(图5),Ki-67 约 40% 阳性,CD4、CD8、CD20、CD30、CD56、ALK、TCRαβ、TCRγδ均阴性 ;TCR 克隆性基因重排阳性;EBER原位杂交阴性。
诊断:①非霍奇金淋巴瘤ⅣB期;②外周T细胞淋巴瘤,非特指型;③神经淋巴瘤病。
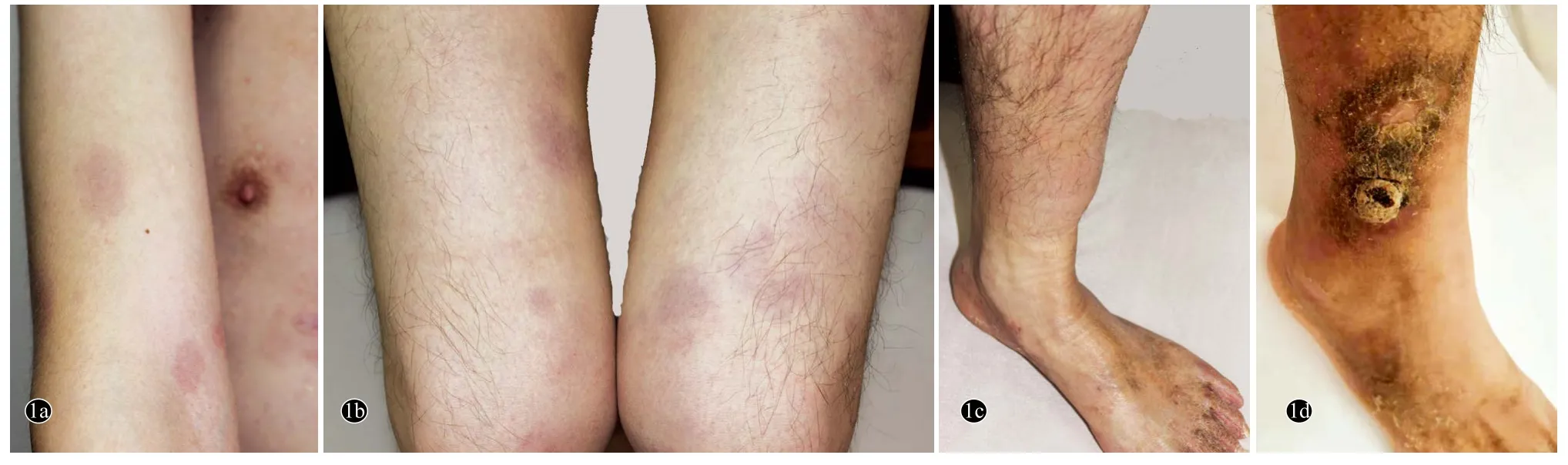
图1 外周T细胞淋巴瘤患者四肢皮损临床表现
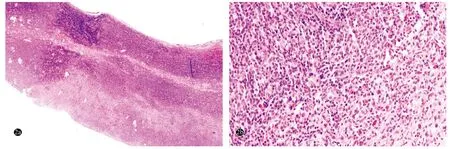
图2 外周T细胞淋巴瘤患者右肘尺神经组织病理(HE染色)
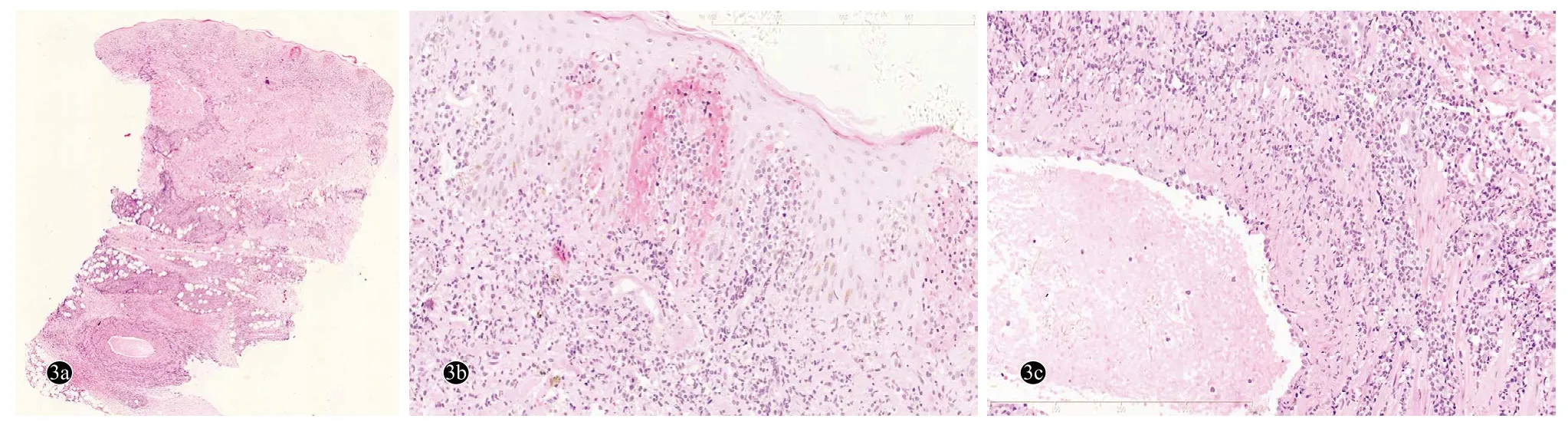
图3 外周T细胞淋巴瘤患者左小腿结节组织病理(HE染色)
治疗:确诊即刻开始化疗,先后采用吉西他滨+培门冬酶、DICE、CHOP、EPOCH+来那度胺、BECOP+西达苯胺等多种方案,具体如下:(吉西他滨1.69 g+培门冬酶3 380 IU)1 d,化疗后四肢肿胀一度缓解,但随后渐恢复至治疗前,3个周期后疗效评价:病情稳定。DICE方案(顺铂33.8 mg+异环磷酰胺2.0g+依托泊苷 0.1g+地塞米松 40 mg )4 d,化疗2个周期后评价疗效:病情稳定。CHOP方案化疗1次,无明显效果;EPOCH+来那度胺方案(依托泊苷75 mg ×4 d,长春地辛1 mg ×4 d,阿霉素15 mg ×4 d,地塞米松15 mg ×5 d,环磷酰胺1.125g第5天1次,来那度胺20 mg ×4 d),3个周期评价疗效:部分缓解;EPOCH方案动员外周血造血干细胞(依托泊苷85 mg ×4 d,长春地辛1 mg ×4 d,醋酸泼尼松片100 mg×5 d,环磷酰胺1.4 g第5天1次,吡柔比星 17 mg ×4 d);BACOP+西达苯胺方案化疗1次后出现粒细胞缺乏、血小板下降,遂停系统化疗。2016年10月开始口服西达苯胺20 mg 每周2次至今,原皮损逐渐消退,但双小腿仍时有新发结节,病程总体呈缓慢进展趋势(图1d)。
讨论
神经淋巴瘤病(neurolymphomatosis,NL)是指非霍奇金淋巴瘤直接侵犯周围神经系统(peripheral nervous system,PNS)(包括颅神经、周围神经、根和丛)的表现,是淋巴瘤神经系统受累最少见的类型。NL最常见于B细胞淋巴瘤,也可见于T细胞或自然杀伤(NK)细胞淋巴瘤。常见形式为系统性淋巴瘤或中枢神经系统(central nervous system,CNS)播散至PNS,可伴随脑膜或中枢神经的淋巴瘤浸润,也可表现为原发性。NL有4种临床表现形式:最常见的是痛性多神经或神经根病变,其次为颅神经病变,无痛性多神经病变和单一周围神经病变[1]。本例患者双侧尺神经、胫神经和腓浅神经神经受累,症状以麻木为主,属于无痛性多神经病变,临床多表现为感觉异常、麻木、深部腱反射消失先于下肢无力发生。
NL的诊断需综合临床表现、影像学和神经组织、非神经组织和脑脊液的形态学依据。经验性药物治疗包括系统用糖皮质激素、IVIG等可能会掩盖病情。已报道的50%患者在尸检后才做出该诊断。MRI是最敏感和特异的非侵袭性检查手段,浸润的神经、根或丛会增大,且增强扫描后强化[2]。PET-CT有助于辅助诊断和识别潜在的肿瘤部位[3]。受累周围神经组织活检仍是诊断的金标准,组织病理上表现为肿瘤细胞浸润神经内膜和神经束,伴有髓神经纤维轴索或髓鞘损害。脑脊液检查有助于判断是否伴随脑膜播散,约有20%~40%患者脑脊液中存在肿瘤细胞[4]。本例患者首诊临床表现为皮肤红斑,进而出现周围神经病变伴有低热,辅助检查提示周围神经增粗、肿胀,神经的组织病理结果提示为T细胞来源肿瘤,综合考虑为NL表现的外周T细胞淋巴瘤(非特指型)。
NL的治疗原则与原发CNS淋巴瘤类似。多数患者需要系统化疗或者联合鞘内注射、局部放疗,制定治疗方案前需进行全身评估以准确分期。静脉给药化疗可能最有效,大剂量甲氨蝶呤(MTX)(>3.5 g/m2)或者联合其他药物可作为单神经病变的一线治疗;联合化疗方案可选择CHOP、VAC、ProMACE等。脑膜浸润的患者需联合鞘内注射化疗。对于瘤体较大或者药物难治性局限性淋巴瘤患者辅助放疗可能有效。传统化疗达到完全缓解后的患者可考虑进行自体干细胞移植[1]。回顾性病例研究显示50%以上的患者治疗有效,另有25%处于疾病稳定状态,其余病情呈进展状态。自诊断明确之后的NL患者中位生存期为10个月,总体预后不佳,原发性NL的预后略好[4,5]。
本例患者表现为皮肤组织和外周神经同时受累,皮肤基本损害为红斑、结节,以下肢为著,临床上需与结节性红斑、硬红斑鉴别,临床表现和组织病理改变均需与皮下脂膜炎样T细胞淋巴瘤鉴别。后者特征性组织病理改变为肿瘤性T细胞围绕单个脂肪细胞形成特征性的花环状排列,一般预后较好。NL表现的外周T淋巴细胞瘤临床罕见,报道很少,尚不清楚皮损是否与病情进展及预后有关。从本例患者的随访来看,其病程进展相对缓慢,已远远超出NL的中位生存期,肿瘤缓慢进展的同时,皮肤表现仍然反复出现,二者的关系是否存在必然联系,尚需长期随访观察。由于本病少见,有学者提议全球性的合作研究、临床病例资源共享可能有助于更好地理解NL的危险因素、治疗和预后[5]。
——翻身肘

