经皮脊柱内镜在治疗胸椎管狭窄症中的应用研究
杨俊松 楚磊 王永峰 邓锐 刘鹏 刘团江 田方 邓忠良 郝定均
胸椎管狭窄症 ( thoracic spinal stenosis,TSS ) 主要因黄韧带骨化 ( ossification of ligamentum flavum,OLF )、胸椎间盘突出 ( thoracic disc hemiation,TDH )、后纵韧带骨化 ( ossification of posterior longitudinal ligament,OPLL )、椎体后缘离断或椎体后缘骨内软骨结节压迫脊髓引起双下肢的麻木无力,大小便功能障碍,严重影响患者生活质量[1-3]。TSS 一旦出现症状,保守治疗一般无效,症状多持续进展,延迟时间越长,预后越差。因此,一旦发现临床症状与影像学表现相符合,应尽早手术治疗。目前临床上常用的后路开放手术,去除后方椎板,移除背侧增生骨化的韧带,移除腹侧的椎间盘或骨化的后纵韧带。如何通过创伤小、简单、安全、有效的治疗手段治疗 TSS,缓解此类患者的痛苦,提高生活质量,是一个亟待解决的临床问题。
近些年,随着微创技术的发展,经皮脊柱内镜在治疗椎间盘突出症方面已取得显著的疗效[4]。随着内镜技术的成熟,其适应证也逐渐扩大到腰椎管狭窄症以及颈、胸椎间盘突出症的治疗中,并取得了满意的疗效[5-11]。但是由于胸椎与腰椎相比解剖差异大,胸椎管储备空间有限、脊髓耐受性较差,且受肋骨、胸腔的影响,操作空间有限,因此能否采用经脊柱内镜技术治疗 TSS 在国内外鲜有报道。在笔者的既往实践中,经皮脊柱内镜可以完成胸椎的椎间盘髓核摘除术。回顾性分析 2016 年 9 月至2017 年 9 月,我院收治并应用经皮脊柱内镜技术治疗的 21 例 TSS 患者,以探讨该技术在治疗 TSS 方面的可行性及临床疗效。
资料与方法
一、纳入及排除标准
1. 纳入标准:( 1 ) 明确诊断为单节段 TDH,经非手术治疗 3 个月症状无缓解或加重;( 2 ) 症状发展迅速;( 3 ) 肌力减退、肌肉有萎缩;( 4 ) 括约肌功能障碍;( 5 ) 影像学检查证实椎间盘突出巨大,脊髓压迫明显,虽然症状轻微,也应考虑手术治疗。
2. 排除标准:( 1 ) 明显的脊柱侧凸、后凸畸形或结构性矢状面失衡者;( 2 ) 病变节段有减压手术史,且术后超过 3 个月者;( 3 ) 患者精神异常、吸毒人员、交流困难者;( 4 ) 合并凝血功能障碍者;( 5 ) 不能平卧或侧卧者;( 6 ) 合并血管源性的间歇性跛行。
二、一般资料
本组共纳入 21 例,其中男 14 例,女 7 例,年龄 32~65 岁,平均 ( 54.5±8.4 ) 岁。T9~104 例,T10~113 例,T11~127 例,T12~L17 例。患者术前均出现不同程度的胸腹部皮肤感觉减退,下肢根性痛、无力、麻木、括约肌功能障碍等症状。结合 CT 及MRI 检查,患者均存在不同程度的椎间盘突出,硬膜囊受压明显。本研究病例术前影像学检查均与症状、体征定位相符。术前的 MacNab 功能评定,良7 例,可 12 例,差 2 例。
三、术前准备
所以患者术前均详细询问及往病史,完善心电图、胸片及肺功能检查 ( 有吸烟史或年龄>60 岁 ),排除内科系统手术禁忌证。行胸椎正、侧位 X 线片、三维 CT 及 MRI 检查,仔细阅读术前 X 线片评估有无脊柱侧凸畸形及确定穿刺节段和方向;通过CT 判断有无合并椎间盘钙化,查阅 MRI 明确椎间盘突出的范围。必要时检查颈椎及全胸椎 MRI,已排除上位神经元病变的影响。术前 30 min 静脉点滴第二代头孢类抗生素预防感染。
四、手术方法
以 T11~12节段椎间盘突出患者为例。患者俯卧位,采用局部静脉复合麻醉,术中给予右美托咪定[ 初始 0.5 mg / kg 行弹丸式注射,再以 0.1~0.5 mg /( kg·h ) 持续泵入 ] 可起到镇静止痛的作用,有利于提高患者术中的耐受度。C 型臂机透视下克氏针定位 T11~12,再次间隙正中旁开 8 cm 标记穿刺位置。常规消毒,铺无菌单。沿定位位置,用 1% 利多卡因局部浸润麻醉。穿刺针沿胸椎后外侧逐渐穿入,触及关节突关节骨质时,再次 C 型臂机透视,调整穿刺位置见位置良好,穿刺针已达到上关节突位置。穿刺针拔除针芯,插入导丝,沿导丝分别置入扩张管、环锯套管,用环锯切除 T12上关节突 ( 必要时可使用内镜下磨钻去除遮挡的肋骨 ) 行椎间孔成形。后更换为工作套管置入内镜,置入脊柱内镜,镜下见突出椎间盘。髓核钳分块予以钳出,并用镜下磨钻将多余骨质磨除。充分显露出神经根和硬膜囊,见神经根搏动良好,神经根减压彻底。射频烧灼椎间盘破裂口,行纤维环成形,并出血点予以射频止血。拔除脊柱内镜及工作通道。沿切口留置引流管 1 根,缝合切口,予以无菌敷料包扎。
五、术后处理
术后即可回病房卧床休息,次日可进行直腿抬腿练习;术后 24 h 鼓励患者佩戴支具下床活动。术后给予对症支持治疗。术后第 2 天可出院,佩戴支具保护 2 周,其间建议休息为主,可适当锻炼;术后 3 个月内避免过度体力活动和剧烈体育锻炼。
六、随访及疗效评价
记录手术时间、术中及术后并发症等。术后1、3、6、12 个月门诊随访,评估临床疗效并行MRI 检查 ( 选取手术节段行薄层扫描 )。采用疼痛视觉模拟评分 ( visual analogue scale,VAS ) 评价术前下肢痛的程度,术后疼痛缓解情况。Oswestry 功能障碍指数 ( oswestry disability index,ODI )。日本骨科协会 ( Japanese orthopaedic association,JOA ) 评分,并计算术后 1 年 JOA 评分改善率,JOA 改善率=( 术后JOA 评分-术前 JOA 评分 ) / ( 29-术前 JOA 评分 )×100%,改善率 ≥ 70% 为优,50%~70% 为良,25%~50% 为好转,<25% 为无效。
七、统计学处理
采用 SPSS 22.0 软件进行统计学分析,术前、术后第 1、3、6、12 个月时下肢疼痛 VAS 评分、ODI评分及 JOA 评分。计量资料采用±s表示。采用单因素方法分析行统计检验,P<0.05 为差异有统计学意义。
结 果
本组病例均由同一位术者完成,所有患者均顺利完成,无一例术中转为开放手术。手术时间 55~145 min,平均 ( 85±45 ) min;术中均无明显出血。术中所有患者均未出现硬膜囊撕裂、大血管及脊髓损伤。术后未见胸腔积液及明显硬膜外血肿的形成。3 例出现手术入路侧肋间神经刺激症状,并通过保守治疗逐步缓解。在术后 1 年的随访中,复查MRI 提示椎管减压满意;未发生切口感染、髓核残留、复发性椎间盘突出及二次翻修手术。
患者的下肢疼痛 VAS 评分、ODI 评分、JOA 评分、JOA 改善率见表 1。术后 1 年 MacNab 的总体优良率为 95.2%,其中优 17 例,良 3 例,可 1 例。VAS 与术后各时间点与术前比较,差异有统计学意义 (P<0.001 )。典型病例见图 1~3。

表 1 患者术前及术后-下肢疼痛 VAS 评分、ODI 评分、JOA 评分及 JOA 改善率比较 ( x ± s )Tab.1 Compa-rison of VAS, ODI, JOA preoperatively and postoperatively ( x ± s )
讨 论
一、经皮椎间孔入路脊柱内镜与既往手术在TSS 治疗中的优势
对于 TSS 的治疗,目前常用手术方式主要通过传统开放或者微创通道下进行。根据病变部位的不同,针对椎间盘突出等源于椎管腹侧的压迫主要有前路经胸腔或经胸膜外的前入路减压,经胸膜外的侧前方入路减压以及单纯后路切除椎板行“涵洞塌陷法”减压或经椎间孔减压;而对于 OLF 等源于椎管背侧的压迫,多采用后入路行椎板减压去除骨化的黄韧带[12-19]。前入路可直达病灶,显露好,对于硬膜囊腹侧的压迫可直接彻底去除压迫;但开胸手术创伤大,毗邻肺脏和大血管等,术后并发症较多,如肺炎、肺不张、肋间神经痛等[20]。经胸膜外的侧前方入路可深入解剖间隙,技术难度大,手术时间长,但对暴露脊髓腹侧优于其它外侧和后外侧入路[21]。由于后方仅存在肌肉组织,远离心脏及大血管,安全性较高,手术入路更加常见,但通过此入路解除硬膜囊腹侧的压迫对操作提出更高的要求[18]。由于传统手术创伤大、术后恢复期长、并发症较多[22-23]。随着近年来微创脊柱外科手术的不断发展,已有学者在胸腔镜下或可扩张通道下通过上述入路进行了 TSS 的彻底减压并观察到了满意的临床疗效[24-26]。作为近年来最具有代表性的微创脊柱外科技术,经皮脊柱内镜手术以靶向减压为核心,是介于保守治疗及传统开放手术之间阶梯性治疗策略的重要一环,具有创伤小,花费少,恢复快,满意度高等优势。在 TSS 的治疗中,胸腔镜下或可扩张通道下手术需置入外径约 18~22 mm 的扩张套管,而脊柱内镜手术仅需置入外径约为 7.5 mm,进一步减少的手术创伤[9]。多项研究表明,一旦熟练掌握此项技术,对于颈腰椎退行性疾病,其疗效不亚于传统开放手术[27-28]。而与胸腔镜或可扩张通道下等空气介质下手术不同,脊柱内镜手术需完全在水介质下进行,由于灌注水压的存在,其镜下出血更少,同时水压的存在可起到松解病灶周围粘连带的作用,有利于镜下减压安全地进行;由于工作通道不需要额外装置固定,可通过镜头深度及角度的调节,对病灶区进行放大、立体地成像,有利于提高术中的安全性。更重要的是,内镜手术不需要电生理监测且可在局麻下进行。由于胸段脊髓血液供应较差,对于损伤的耐受性更差,术中发生脊髓损伤加重的可能较大,而镜下手术中医患双方可及时地进行沟通反馈,进一步提升术中的安全性,尤其是对于高龄,由于其它基础疾病无法耐受全麻的患者,更加具有优势。
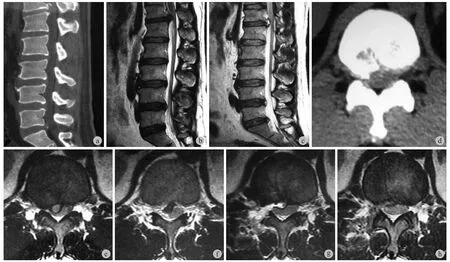
图 1 患者,男,38 岁,T12~L1 椎间盘突出伴钙化,行右侧经皮内镜椎间孔入路髓核摘除、椎间盘射频消融成形术 a~e:术前 CT( a、d ) 及 MRI ( b、e ) 示 T12~L1 旁中央型椎间盘突出,右侧侧隐窝狭窄伴钙化;术后矢状位 T2 加权像 ( c ) 示 T12~L1 突出位置成高信号水肿影;f~h:术后轴位 MRI 示 L1 右侧上关节突腹侧椎间孔成形,右侧凸出间盘及增生黄韧带摘除,局部残留水肿信号,脊髓无受压Fig.1 A 38-year-old male patient with T12 - L1 intervertebral disc herniation and calcification was treated by percutaneous endoscopic thoracic discectomy and foraminotomy via a transforaminal approach. Pre-operative CT ( a, d ) and MRI ( b, e ) showed paramedial intervertebral disc herniation at the level of T12 - L1 with stenosis of the right lateral recess accompanied by calcification. Postoperative sagittal T2-weighted imaging showed high signal at T12 - L1 ( c ). Views ( f, g, h ) showed the foraminoplasty at the ventral side of the right superior articular process of L1 was satisfactory, the protrusion of intervertebral disc and hyperplasia of yellow ligament were removed with local residual edema signal and no compression of the spinal cord
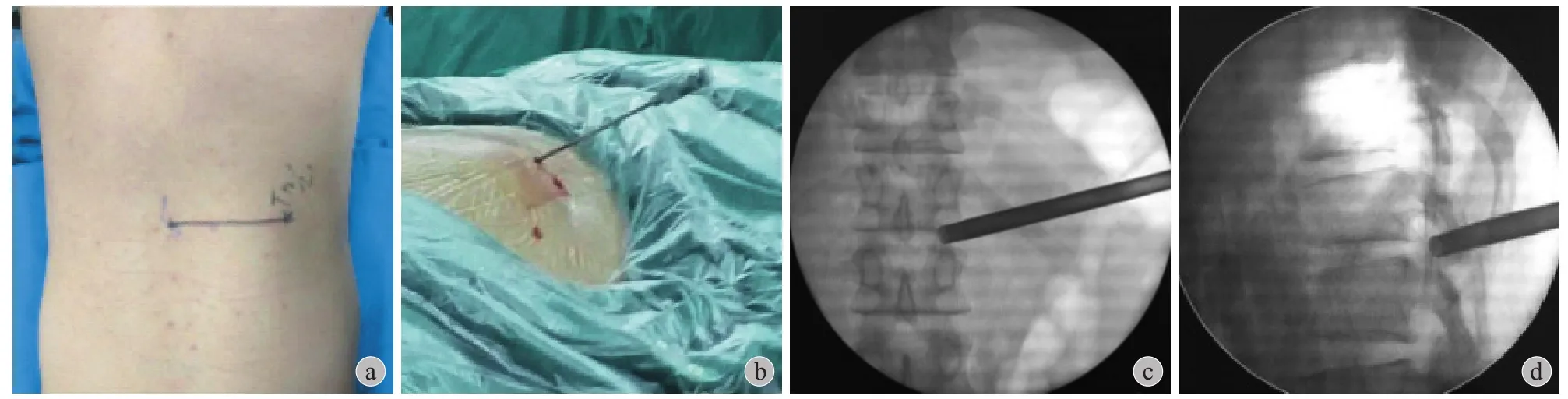
图 2 a~b:术中大体照确认切口位置 ( 正位,侧位 );c~d:透视下正位环钻到达椎弓根连线水平,侧位到达关节突关节Fig.2 IIntraoperative general views ( a: anteroposterior position, b: lateral position ); Fluoroscopy indicated that the depth of trephine reached the medial margin of the pedicle at the anteroposterior view and contacted the facet joint at the lateral view
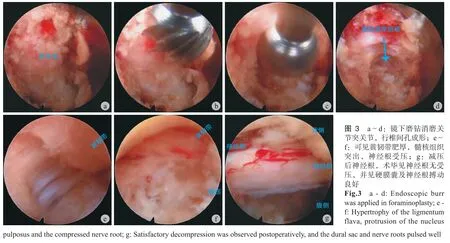
二、经皮椎间孔入路脊柱内镜治疗 TSS 的可行性
近年来,随着微创脊柱外科技术的发展,经皮椎间孔镜下间盘切除术在治疗椎间盘突出方面已取得显著的疗效[9]。随着内镜技术的成熟,其适应证也逐渐扩大到腰椎管狭窄症以及颈、胸椎间盘突出症的治疗中,并取得了满意的疗效[5-11]。Choi 等[11]在 2010 年报道了经皮脊柱内镜下采用经椎间孔入路处理非钙化性 TDH,并取得了满意的疗效。Wagner等[9]采用经椎间孔入路,通过椎间孔扩大成形成功治疗了 1 例 T8~9椎间盘突出的患者。迄今为止最大样本量的研究是由 Rutten 等[10]报道的。他们在全内镜下采用前方经胸膜腔、侧方经椎间孔及后方经椎板间入路共计治疗 55 例 TDH 导致 TSS 的患者,在术后长达 18 个月的随访中,临床效果满意。而对于脊髓背侧 OLF 导致的压迫,Miao 等[29]采用经皮脊柱内镜成功地治疗了 2 例。上述研究已初步提示在TSS 的治疗中,经皮脊柱内镜可以实现脊髓腹侧及背侧的环形减压。对于经皮脊柱内镜在 TSS 的临床应用价值,目前国内尚无相关研究。与前述研究不同,本研究首次将局部静脉复合麻醉引入了经皮脊柱内镜手术,研究也提示对于存在脊髓腹侧压迫的TSS 患者,经皮脊柱内镜可以在局部静脉复合麻醉下实现理想的减压,且在术后 1 年的随访中临床疗效是满意的。
三、手术要点及注意事项
本组与前述研究不同,笔者推荐术中采用局部静脉复合麻醉。因为胸段脊髓术中损伤风险较大,全麻下采用神经电生理检测,可能出现神经电生理的假阳性。采用局部麻醉,患者处于清醒状态,可实时进行沟通,有利于提高手术安全性,降低脊髓损伤的发生风险。但是当局麻效果不满意时,可能出现患者无法耐受手术而被迫中转手术。另一方面若此时追加麻醉,麻醉药可进入硬膜外或椎管内,导致全脊麻的发生,严重者可能影响呼吸以及循环功能。在术区局部麻醉的基础上,静脉持续泵入右美托咪定辅以镇静、止痛的作用,提高患者的耐受度。右美托咪定是一种安全、有效且高选择性的 α-2 受体激动剂,可以提高患者舒适度,在临床诊疗的过程中已被广泛使用[30]。Surve 等[31]在慢性硬膜下血肿清除术中,联合局部麻醉与右美托咪定镇静,成功地实施了内镜下的钻孔减压。
术中应注意避免对脊髓直接的牵拉或者挤压,当椎管存在明显狭窄时,应注意首先对椎弓根、后方关节突或腹侧椎体的部分骨组织进行成形,为置入操作器械及脊髓神经的避让预留空间,采用曲向减压的技术尽可能地围绕硬膜囊行环状减压。
在磨除骨质后,可能出现松质骨髓腔的渗血。虽然提高灌注水压有利于维持镜下视野的清晰,但灌注水压过高可能出现胸腔或者纵隔腔的积液。针对硬膜囊或者松质骨表面的出血,可采用射频进行点状止血。而对于难以控制的髓腔渗血,可在磨钻的表面涂抹骨蜡,在磨钻对骨质进行打磨的过程中,表面涂抹的骨蜡可即刻的封堵松质骨创面,控制出血。同时术后切口区留置引流管,也有利于降低术后硬膜外血肿发生。
综上所述,对于 TSS 患者,由于脊髓本身受压较重,术前脊髓功能已有不同程度的受损。无论哪种术式,其目的均是以彻底地解除脊髓压迫,促进患者脊髓功能的恢复为核心的。如何能够在保证理想的减压效果下,进一步减少手术的创伤,降低手术相关的并发症,是目前 TSS 治疗的探索方向。本研究提示采用经皮脊柱内镜处理 TSS 是一种可行、安全、有效的治疗方式,在术后 1 年的随访中,患者的临床疗效满意。对于经皮的脊柱内镜的远期疗效仍需后期的研究进一步随访。同时仍需前瞻、随机、对照的高质量研究,进一步比较经皮脊柱内镜与现有各项微创治疗技术在 TSS 治疗中的差异。

