miRNA对自然杀伤细胞生长发育及功能的调控作用
黄秋萍 袁欢 王宜林 黄庆生 李琦,2★
微小 RNA(microRNAs,miRNAs)是一种非编码的单链小RNA,通过与靶mRNA的3′非编码区(3′-untranslated region,3′-UTR)特异性互补配对,降低靶基因mRNA的稳定性或抑制蛋白质翻译,调控细胞的功能和多种生理过程。自然杀伤(naturalkiller,NK)细胞是人体免疫防御的第一道防线,在抗肿瘤、抗病毒感染和免疫调节方面发挥重要作用[1]。本文总结了近年来miRNA在NK细胞分化发育与功能调控中的作用,对miRNA在NK细胞免疫调控中作用的了解有利于从分子细胞水平上揭示某些疾病的发病机理并为其临床防治提供新理论与新依据。
1 NK细胞概述
人的NK细胞是CD56阳性且CD3阴性(CD56+CD3-)的大颗粒淋巴细胞。根据NK细胞表面CD56分子和Fc受体CD16(Fcγ RⅢA)的表达水平不同又可将NK细胞分为CD56dimNK细胞和 CD56brightNK细胞 2类亚群[2]。CD56dimNK 细胞和CD56brightNK细胞在分布与功能等方面存在较大差异。CD56dim亚群在骨髓、外周血、脾脏中占主导地位,胞内含有大量穿孔素(perforin)和颗粒酶(granzyme,Grz);而 CD56bright亚群则在淋巴结、扁桃体和蜕膜中占主导地位,以释放细胞因子为主要功能,并参与免疫调节[3]。NK细胞没有主要组织相容性复合体(major histocompatibility complex,MHC)限制,无需特异性抗原刺激,可直接被激活并杀死靶细胞。因此NK细胞在人体固有免疫系统中发挥重要作用。
2 miRNA的产生以及生物学功能
成熟的miRNA由基因转录后的初级转录本经过一系列核酸酶的切割而形成。初级转录本被称为pri-miRNAs,其片段长度从几百到几千个碱基不等。pri-miRNA通过由RNA聚合酶III(Drosha)和双链RNA结合蛋白(DGCR8)组成的蛋白质复合物修剪。形成长度为60~70个核苷酸的miRNA 前体,即 pre-miRNA[4-5]。pre-miRNA 的结构为单一发夹,5′端带有磷酸基团,3′端有2个突出碱基,并带有3′羟基。pre-miRNA的3′剪切位点被转运蛋白exportin5识别,依赖于Ras(rat sarcoma)相关核蛋白和 GTP(guanosine triphos phate)途径,pre-miRNA 被 exportin5带入胞质区域[6];接下来,pre-miRNA被另外一个RNA聚合酶Ⅲ(Dicer)与TAR RNA结合蛋白(TAR RNA binding protein,TRBP)复合物剪切,从而得到单链成熟miRNA。成熟的miRNA与其他相关蛋白质组成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)[7],引起靶 mRNA 的降解或翻译抑制(图1)。
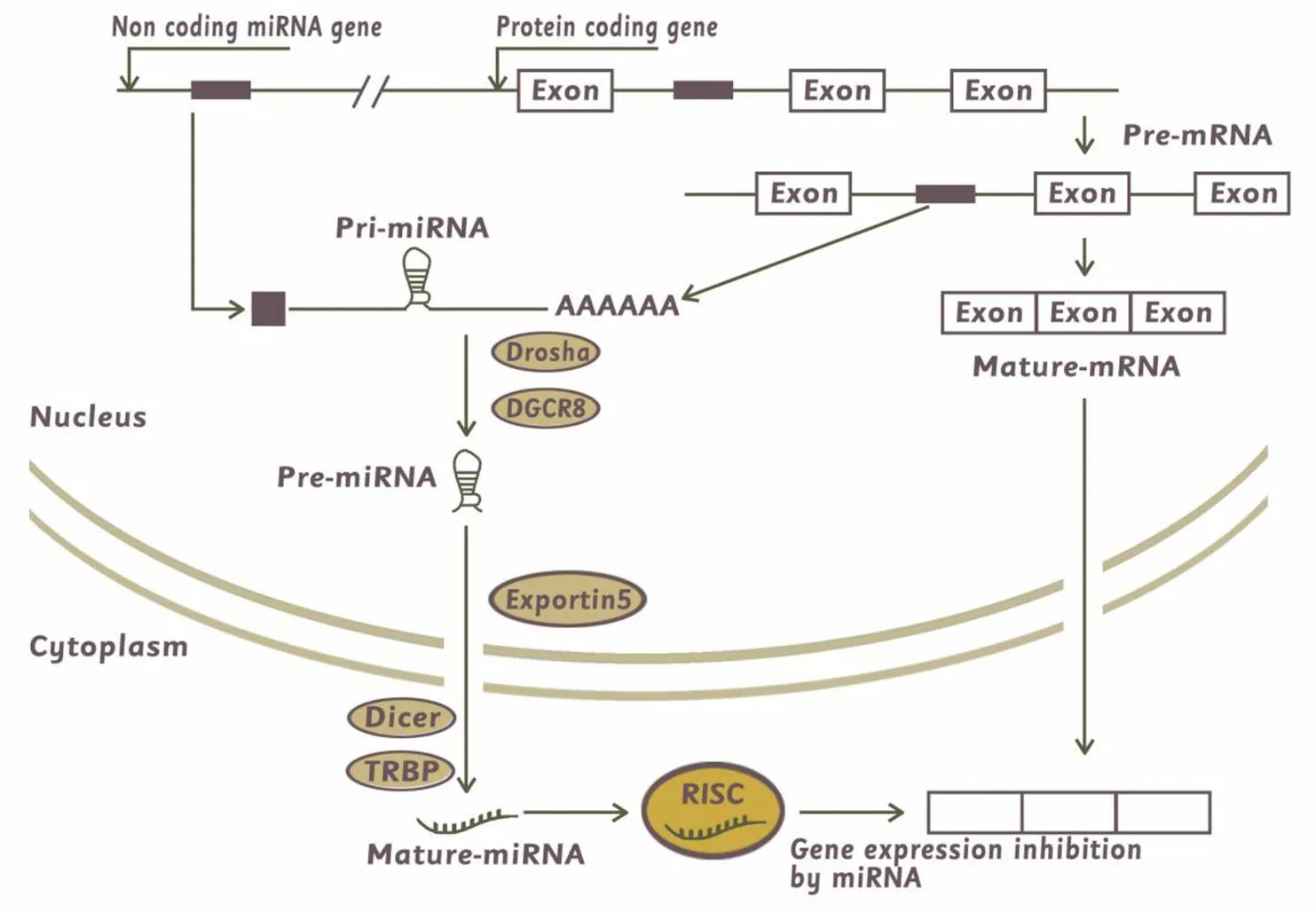
图1 miRNA形成与作用机制Figure 1 The formation and action mechanism of miRNA
3 miRNA调控NK细胞的生长发育及功能
miRNA在生物体内广泛存在,虽不直接参与编码基因和蛋白质的翻译,但因其可以调控靶标基因的表达,在生理和病理过程中发挥着强大的调控作用。关于miRNA在调节T、B细胞的成熟和功能方面的作用已有了较多的研究,但针对miRNA调控NK细胞发育与功能方面的报道则较少。近几年,随着人们对NK细胞功能重要性认识的提高,miRNA在NK细胞发育与功能的调控中扮演的重要角色引起学界的广泛关注,并取得了许多研究进展。
3.1 miRNA调控NK细胞发育
众所周知,Notch信号影响细胞功能的多个过程,包括多能祖细胞的分化、细胞凋亡、细胞增殖及细胞边界的形成。而c-Myb是一种原癌基因,在细胞增殖、分化方面具有重要作用。Cichocki等[8]的研究发现,在NK细胞中,miR-181可通过抑制Notch信号的抑制剂Nemo样激酶(Nemo-like kinase,NLK)的表达水平来促进NK细胞的发育和成熟的过程。类似的,其它一些miRNAs,如miR-15/16[9],miR-150[10]也能够调控 NK 细胞的成熟过程,这些miRNAs都可通过靶向c-Myb来促进NK细胞走向成熟。
miR-155也是一条能够调控NK细胞功能的重要miRNA,可通过抑制肌醇磷酸酶-1(SH2-containing inositol phosphatase-1,SHIP-1)的表达,增强胞外信号调节激酶(extracellular regulatedprotein kinases,ERK)和蛋白激酶 B(protease kinase B)的活性,从而增强NK细胞的细胞毒活性,调控NK细胞的发育和NK细胞在体内的动态平衡和活化过程[11]。
3.2 miRNA调控NK细胞的细胞毒功能
在人体先天免疫过程中,NK细胞被激活后,通过释放诱导凋亡的GrzB、perforin和一系列细胞因子,如IFN-γ和TNF-α等发挥针对靶细胞的细胞毒作用。
Ni等[12]的研究团队在人外周血 NK(peripheral NK,pNK)细胞中发现了高表达的miR-362-5p,该miRNA通过靶向肿瘤抑制因子头帕肿瘤综合征蛋白(cylindromatosis,CYLD),使 NK 细胞中CD107a表达量上调,促进perforin、GrzB的分泌,从而促进NK细胞的细胞毒性。
与miR-362-5p作用相反,miR-223和miR-27a*负调控NK细胞的细胞毒功能。miR-223可直接抑制NK细胞中GrzB mRNA的翻译;miR-27a*则可同时抑制NK细胞中GrzB和perforin mRNA的翻译来抑制NK细胞的细胞毒性功能[13]。
在调控NK细胞分泌IFN-γ方面,miR-155起着重要的促进作用。SHIP-1是调节IFN-γ表达的负性调控因子,但miR-155可通过下调SHIP-1的表达促进NK细胞对IFN-γ的分泌[11]。除了SHIP1,miR-155还可调控多种靶标基因,例如Noxa 和 SOCS-1(Suppressor of cytokine signaling-1)等,说明miR-155参与细胞内多条信号通路的调节,对细胞的功能发挥重要的调控作用。而与miR-155作用相反,miR-29、miR-15/16可直接作用于IFN-γ mRNA 的 3’UTR 区域,抑制IFN-γ mRNA的翻译,从而抑制NK细胞中IFN-γ的合成[14]。除此之外,最新的研究表明,miR-146 a通过NF-κB负调节NK细胞中IFN-γ的产生,并且这种miRNA可能对于防止NK细胞被超活化和过度产生IFN-γ 至关重要[15]。在调控 NK 细胞分泌 TNF-α方面,miR-30 c-1*作用于NK细胞CD226促进TNF-α的产生并增强NK细胞的杀伤作用[16]。
3.3 miRNA在抗感染免疫与抗肿瘤免疫中对NK细胞的调节作用
3.3.1 miRNA与小鼠巨细胞病毒
在小鼠巨细胞病毒(mouse cytomegalovirus,MCMV)感染的NK细胞模型中,miR-155在NK细胞中表达上调,该miRNA通过作用于信号转导和转录激活因子(signal transduction and activator of transcription,STAT)-4以响应NK细胞刺激因子IL-12和IL-18的信号。尽管在正常生理状态下,miR-155对于NK细胞的细胞毒功能和细胞因子的分泌是非必需的,但受到MCMV感染后,miR-155的缺乏会导致淋巴组织和非淋巴组织中NK细胞功能受损和记忆NK细胞数量的减少,说明在MCMV病理条件下,miR-155对NK细胞的功能发挥重要的调控作用[17]。
3.3.2 miRNA与肝脏疾病
Cheng等[18]的研究表明对于感染慢性丙型肝炎病毒(hepatitis C virus,HCV)的患者,miR-155是抑制HCV感染的信号蛋白的miRNA,在HCV感染的NK细胞中被下调;T细胞免疫球蛋白及黏蛋白域蛋白(T cell immunoglobulin domain and mucin domain,TIM)-3是负性调节剂,在感染慢性HCV的患者NK细胞中上调。其中调节机制是miR-155通过触发STAT-5磷酸化来阻断TIM-3信号,增强NK细胞分泌IFN-γ的能力,即miR-155通过下调TIM-3的表达来调节NK细胞的功能,因此在患者体内低表达的miR-155增强了TIM-3信号,从而减少了IFN-γ分泌,导致NK细胞的细胞毒功能降低。
在慢性乙型肝炎(chronic hepatitis B,CHB)感染患者和肝癌(hepatocellular carcinoma,HCC)患者中,NK细胞功能被显著抑制,但导致这种功能抑制的机制仍不清楚。有关研究显示,与来自正常供体的NK细胞相比,CHB和HCC患者的NK细胞中,miR-146a表达量上调并通过靶向STAT-1下调IFN-γ的分泌,抑制NK细胞的细胞毒性[19]。Ge等[20]的最新研究发现在CHB患者的NK细胞中,miR-155表达下调并通过靶向SOCS-1而降低IFN-γ的产生,NK细胞杀伤活性的下降可能导致CHB感染期间的免疫功能障碍。
相反的,有一些miRNA可对NK细胞的功能产生积极的影响。例如,miR-34a的过度表达可上调HCC患者NK细胞中自然杀伤细胞2族成员(natural killer group 2 member D,NKG2D)和perforin的表达,促进NK细胞的发育并增加NK细胞对靶细胞的杀伤活性[21]。除此之外,miR-182也可通过调节NKG2D的表达而增强NK细胞对HCC的细胞毒性[22]。
3.3.3 miRNA调控乳腺癌
Breunig等[23]研究发现,miR-519a-3p的高表达可干扰乳腺癌细胞的凋亡信号,使肿瘤细胞凋亡减少。同时,miR-519a-3p可下调乳腺癌细胞中能被NKG2D识别的UL16结合蛋白2(UL16 blinding protein 2,ULBP2)和主要组织相溶性复合体Ι类分子相关蛋白A(major histocompatibility complex class Ι chain-related protein A,MICA)的表达,从而削弱乳腺癌细胞对NK细胞杀伤作用的敏感性,提示高表达的miR-519a-3p水平可能与乳腺癌的不良生存率相关。
3.3.4 miRNA调控登革热感染
针对于登革热病毒(dengue virus,DENV)感染目前尚无确切有效的病原治疗,且DENV感染的免疫发病机制尚不完全清楚,所以DENV仍然是一个主要的公共健康威胁。但相关研究推测GrzB可能在登革热病毒的感染过程中发挥关键作用。miR-378是NK细胞细胞毒功能的负性调控因子[24],Liu 等[25]发现,在 DENV 感染患者 NK 细胞中miR-378下调,当对DENV感染小鼠加入miR-378 agomir使得miR-378过表达后发现GrzB表达被抑制并促进DENV复制。该结果提示miR-378在调节GrzB表达中的重要作用,以及GrzB在体内控制DENV复制对人体的保护作用,为寻找DENV感染的免疫发病机制提供了新的切入点。
4 展望
作为一种非编码小分子,miRNA调节体内许多生理和病理过程,并在调节NK细胞的发育、成熟、活化及细胞毒作用等多个环节中都扮演着重要角色。同时,在病理条件下,miRNA对NK细胞的功能也有一定的影响。对miRNA调控NK细胞功能的深入研究,将有助于从分子细胞水平上理解某些感染、慢性炎症、肿瘤等疾病的病理机制。同时,一些发挥重要调控作用的关键miRNAs有望成为疾病快速诊断、治疗和预后评估的重要生物标志物,或基因治疗药物的靶标。在未来的研究中,通过开发能够调节NK细胞的发育或功能的关键miRNA抑制剂或模拟物而针对性地调控NK细胞的功能可为相关疾病的预防和治疗提供新思路。