广东佛山地区人群CYP2C19基因多态性及氯吡格雷药效反应的影响因素分析
林静 杨洁飞 梁权辉 李炜煊
氯吡格雷是最常用的噻吩吡啶类抗血小板药物,但由于部分患者对抗血小板药物的反应存在差异性,经氯吡格雷抗血小板治疗后仍未能有效抑制血小板功能,造成血栓事件反复发生[1]。目前尚未明确氯吡格雷抵抗的机制,但多认为基因多态性为其发生主要原因。CYP2C19是肝脏生物转化第一相反应最重要的酶,CYP2C19基因多态性将影响药物代谢,亦是药物遗传学研究的最早对象,在药物代谢过程中有着较为重要的作用[2]。佛山地区处于亚热带沿海地区,本地人口组成相对单一,但由于近年来工业化进程加快,外来人口剧增,导致遗传群体遗传结构发生变化。基因多态性的情况在不同地区的表现并非一致,基因型频率的出现频率也不完全相同,因此,针对本地区人群CYP2C19基因多态性的调查显得尤为重要。基于此,本研究对佛山市第一人民医院375例冠心病患者展开研究,旨在探讨佛山地区人群CYP2C19基因多态性以及氯吡格雷药效反应的影响因素分析,具体信息如下。
1 资料与方法
1.1 一般资料
将2016年8月至2018年2月在佛山市第一人民医院治疗的冠心病患者375例纳入研究,均自愿参与本研究并签署知情同意书。375名患者中男255例,女120例;年龄31~83岁,平均年龄(65.89±6.73)岁。纳入标准:①经冠脉造影证实为冠心病患者;②无血缘关系的佛山常住人口;③连续服用氯吡格雷75 mg/d 5天以上者。排除标准:①患有肺源性心脏病、继发性心肌梗死等其他心脏器质性病变患者;②肝肾脾和造血功能异常者。③血小板计数<125×109g/L或>350×109g/L者[3]。
1.2 设备和仪器
ABI 9700 PCR扩增仪购自美国Applied Biosystems公司;Baio e-Hyb全自动杂交仪购自上海百傲科技有限公司;FACSCalibur流式细胞仪购自美国Becton Dickinson公司。
1.3 方法
1.3.1 CYP2C19基因检测
EDTA抗凝管采集受试者外周静脉血2 mL,操作流程:①提取外周血细胞基因组DNA。②CYP2C19基因特异引物对1和引物对2进行PCR扩增。③将带生物素标记的扩增产物与固定在醛基基片上的CYP2C19基因型检测探针进行特异性杂交,并通过酶促显色反应,使特异性杂交信号显现出颜色。④通过软件分析生物芯片识读仪读出的图像,判断待测样本基因型。CYP2C19基因检测芯片试剂盒由上海百傲科技有限公司提供,采用的方法是DNA微阵列芯片法。*2 G681A和*3 G636A为人基因组CYP2C19主要基因检测位点,等位基因主要是*1,*2,*3型。其中*1型无碱基突变,酶活性正常,*2,*3型发生碱基突变(681G>A,636G>A),无酶活性。3种等位基因形成6种基因型,分为突变纯合型(*2/*2、*2/*3、*3/*3)、突变杂合型(*1/*2、*1/*3)和野生型(*1/*1)。不同基因型人群间具有不同的氯吡格雷药物代谢动力学特征,其中突变纯合型为慢代谢型、突变杂合型为中间代谢型、野生型基因为快代谢型[4]。
1.3.2 血小板聚集功能检测
采集连续服药7天以上者静脉血2 mL(枸橼酸钠抗凝管),操作流程:①取全血45 μL与ADP 5 μL混匀活化5 min。②标记IgG管和PAg管,分别加入6 μL CD42b抗体。③待全血活化后,取全血5 μL到IgG管和PAg管中,混匀,室温避光静置 15~20 min;④分别加入 450 μL 含 1%多聚甲醛的PBS,混匀,闭盖置于4℃冰箱10 min后上机检测。使用抗体为美国BD-Pharmingen公司生产的单抗。血小板聚集>50%判断为氯吡格雷抵抗[5]。
1.4 评价指标
①CYP2C19基因多态性:统计冠心病患者中的CYP2C19基因型及基因表型的分布情况;②氯吡格雷反应组和氯吡格雷抵抗组基因分布差异。③基本资料:探讨氯吡格雷抵抗的危险因素,分析年龄、性别、糖尿病、高血压、高胆固醇血症、纤维蛋白原、血小板计数,CYP2C19基因表型等情况,并行Logistic多因素分析。
1.5 统计学方法
采用SPSS21.0统计学软件,计数资料以百分数和例数表示,组间比较采用χ2检验;计量资料以“±s”表示,组间比较采用t检验;采用Logistic行多因素分析;应用Hardy-weinberg遗传平衡定律检验研究对象是否具有群体代表性,均以P<0.05为差异有统计学意义。
2 结果
2.1 CYP2C19基因多态性
2.1.1 CYP2C19基因型及基因表型分布情况
氯吡格雷抵抗组及氯吡格雷反应组分别进行Hardy-weinberg平衡检验,CYP2C19等位基因分布符合遗传平衡法则,说明样本具有代表性(P>0.05)。375名冠心病患者中基因型分布情况:野生型CYP2C19*1/*1所占比例(42.13%);突变杂合型占45.60%,其中CYP2C19*1/*2、CYP2C19*1/*3分别占40.27%和5.33%;突变纯合型占12.79%,其中 CYP2C19*2/*2、CYP2C19*2/*3、CYP2C19*3/*3分别为7.47%,4.53%和0.27%,见表1。
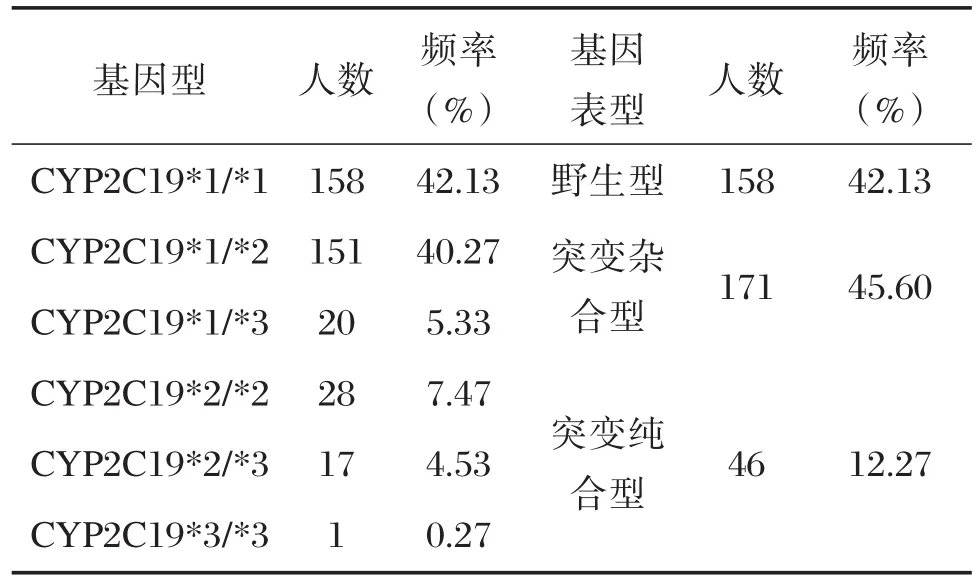
表1 佛山地区人群CYP2C19基因型及基因表型分布Table 1 Distribution of CYP2C19 genotype and gene phenotype in population of Foshan
2.1.2 广东珠三角地区人群CYP2C19基因分布频率的比较
在等位基因方面,佛山与广东其他地区CYP2C19等位基因分布统计学上无显著性差异(P>0.05),见表2。
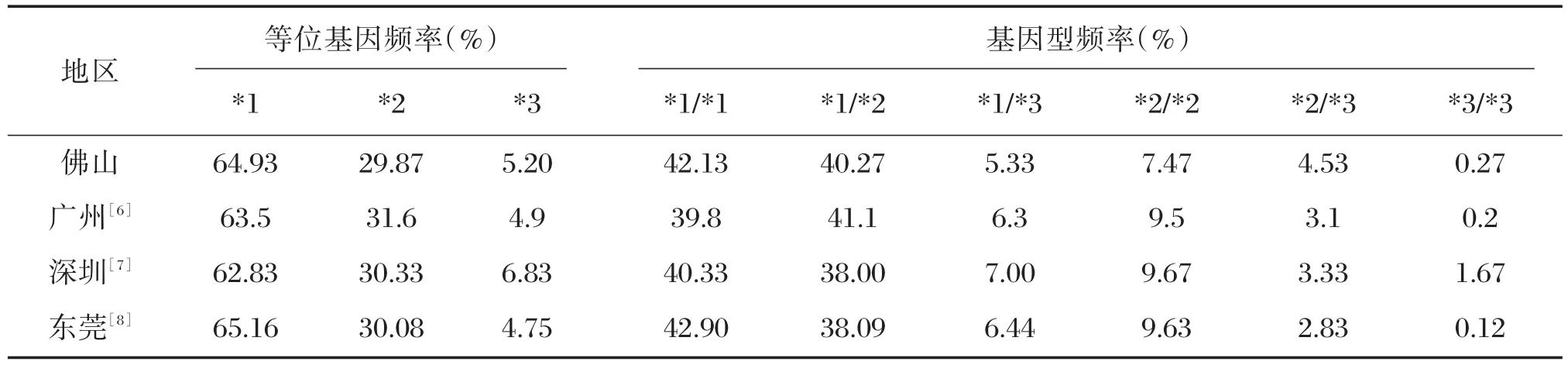
表2 佛山地区人群CYP2C19基因与广东其他地区人群的比较(%)Table 2 Comparison of CYP2C19 gene in Foshan population with other populations in Guangdong(%)
2.2 CYP2C19基因多态性与氯吡格雷的抗血小板反应
2.2.1 氯吡格雷反应组与氯吡格雷抵抗组基因表型和等位基因差异
46例突变纯合型中氯吡格雷抵抗19例,氯吡格雷反应27例;171例突变杂合型中氯吡格雷抵抗53例,氯吡格雷反应118例;158例野生型中氯吡格雷抵抗18例,氯吡格雷反应140例。氯吡格雷抵抗组和氯吡格雷反应组在基因表型和等位基因频率分布上有明显差异(P<0.05),突变纯合型在氯吡格雷抵抗组显著高于氯吡格雷抵反应组(21.11%,9.47%),等位基因(*2,*3)的基因频率在氯吡格雷抵抗组显著高于氯吡格雷抵反应组(50.56%,30.18%)。见表3。
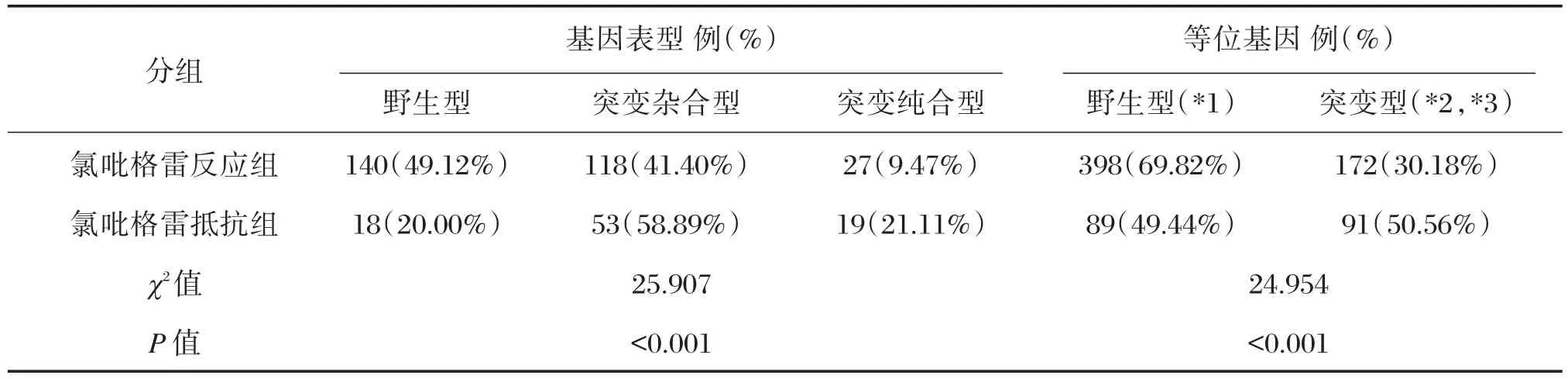
表3 氯吡格雷反应组与氯吡格雷抵抗组基因表型和等位基因差异Table 3 Gene phenotype and allelic difference between clopidogrel reaction group and clopidogrel resistance group
2.2.2 基本资料及Logistic回归分析
氯吡格雷抵抗组年龄、性别、糖尿病、高血压、高胆固醇血症、纤维蛋白原,血小板计数水平比较,差异均无统计学意义(P>0.05);氯吡格雷抵抗组CYP2C19突变纯合型和突变杂合型所占比例高于氯吡格雷反应组,差异有统计学意义(P<0.05),见表4。采用Logistic回归分析,显示突变纯合型(OR=2.557,95%CI:1.344~4.864)和突变杂合型(OR=2.027,95%CI:1.253~3.281)与氯吡格雷抵抗发生显著相关,是氯吡格雷抵抗发生的独立危险因素。
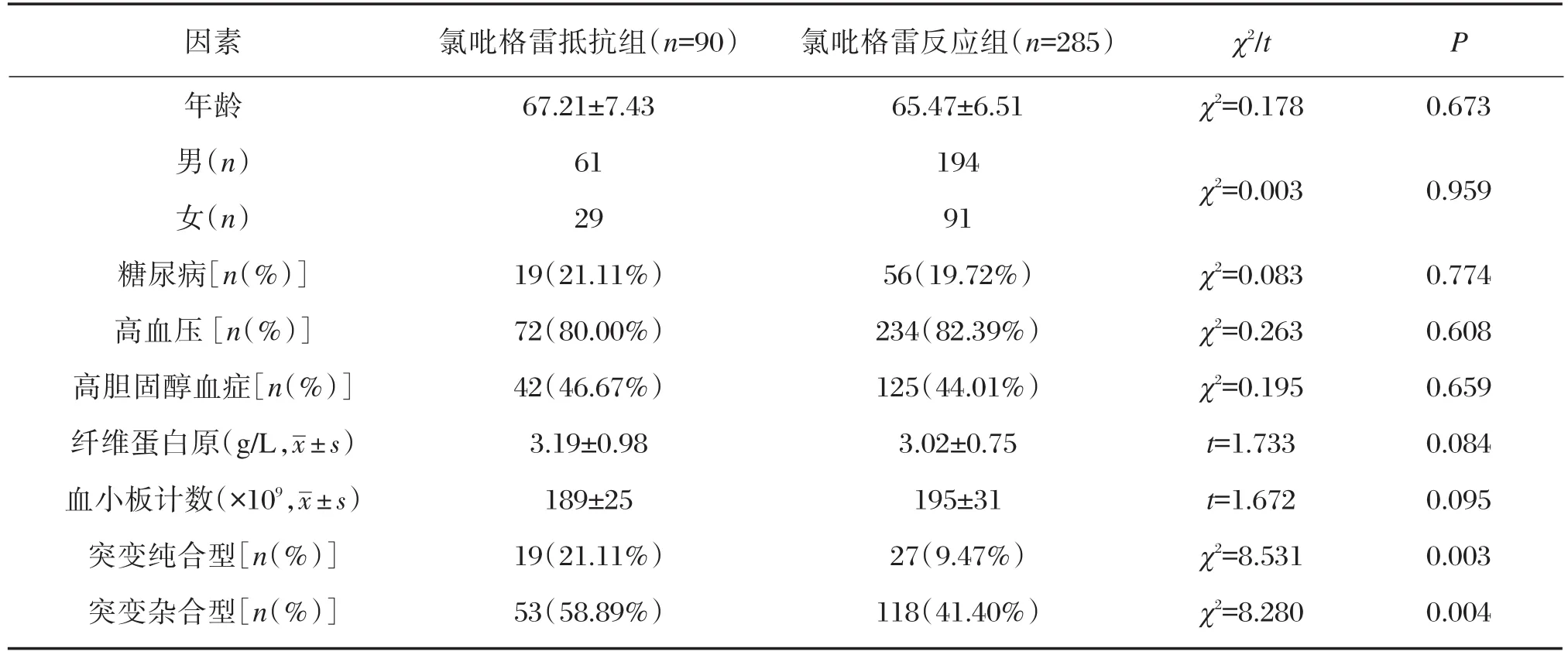
表4 氯吡格雷反应组与氯吡格雷抵抗组基本资料对比Table 4 Comparison of basic data between the clopidogrel reaction group and clopidogrel resistance group
3 讨论
细胞色素P450同工酶也称药酶,是由一系列结构和功能相关的酶组成的超家族,是体内药物代谢的主要酶系[9]。其中,CYP2C19已被多项研究证实与药物血药浓度及酶的抑制和诱导密切相关[10-11],成为近年来研究的热点。CYP2C19基因由于遗传多态性,个体间表现出不同基因型和基因表型。佛山地处亚热带沿海地区,随着外来人口剧增,导致遗传群体遗传结构发生变化。因此本文针对佛山地区常住人口375名冠心病患者进行基因多态性检测,得出CYP2C19基因表型分布情况,以突变杂合型最高(45.60%),其次为野生型(42.13%),突变纯合型最低(12.27%);基因型分布情况以CYP2C19*1/*1(42.13%)所占比例最高,CYP2C19*3/*3(0.27%)所占比例最低;等位基因分布情况,*1、*2、*3分别为64.93%,29.87%,5.2%,其中野生型*1所占比例最高。该基因分布结果与广东其它地区如广州[6],深圳[7],东莞[8]等地区的基因分布相近。广东省地处中国大陆最南部,虽然56个民族成分齐全,但汉族人口占全省总人口的97.46%,并且广州,深圳,东莞均是外来人口聚集地。佛山东接广州,已实现广佛同城,人口分布上也基本与广州同步化,因此由于佛山特殊的地域环境和人口特征,使得佛山地区人群CYP2C19基因多态性分布结果与广东其它地区人群基因分布相近。
一般情况下,临床需长时间服用的药物副作用较少,但对于药物代谢慢的人群,长期按照正常剂量服用药物就可能出现严重的毒副作用,导致肝肾损害,甚至可能引起死亡。而作为一种以血红素为辅基的细胞色素超家族蛋白酶,CYP2C19参与了氯吡格雷在内的大多数经肝代谢的药物的生物转化过程[12]。氯吡格雷是临床的一线抗血小板药物,用于冠心病的Ⅰ、Ⅱ级预防,可显著降低不良心血管事件的发生率。有研究表明,细胞色素P450系统中的CYP2C19是氯吡格雷在体内代谢的主要代谢酶,其等位基因多态性与氯吡格雷的抗血小板反应多样性密切相关[13]。因此,了解不同基因型人群的药物代谢特征显得尤为重要。本研究结果显示,氯吡格雷抵抗组和氯吡格雷反应组在基因表型和等位基因频率分布上有明显差异,突变纯合型发生发生氯吡格雷抵抗的概率远高于其它基因表型,这表明不同基因型人群间具有不同的氯吡格雷药物代谢动力学特征。突变纯合型中CYP2C19*3基因为第4外显子在第636位的突变这导致终止码提前,产生CYP2C19*3酶,具有较低的代谢功能;CYP2C19*2基因型为CYP2C19基因的第5外显子在第681位的突变,引起5`端40bp碱基缺失,并对之后的mRNA阅读框架造成改变,产生无功能蛋白CYP2C19*2[14]。因此,CYP2C19突变纯合型(*2/*2、*2/*3、*3/*3)和突变杂合型(*1/*2、*1/*3)为影响氯吡格雷药性反应的危险因素,其中突变纯合型影响作用更为显著。上述基因突变将降低氯吡格雷的抗血小板效果,影响药效反应,发生血栓等严重后果,所以,应实现基因检测指导下的个性化抗血小板治疗,比如根据患者基因检测和血小板聚集功能检测适当增加药物剂量[15];对高危患者可选用其它抗血小板药物或者联合用药;避免同时接受与氯吡格雷有共同代谢途径或影响氯吡格雷吸收的药物,以减少药物间的相互作用等。
综上所述,佛山地区人群CYP2C19基因型与广东其它地区人群分布相似,突变纯合型和突变杂合型为佛山地区人群发生氯吡格雷抵抗的危险因素,故临床治疗中应根据患者基因检测结果制定个性化的治疗方案,选择合适的抗血小板治疗药物。