miR-34启动子甲基化在胃癌发病过程中的作用研究
田敬华 杨金玲 秦杰 赵琳琳 刘敏 洪燕英
胃癌是最常见的消化系统恶性肿瘤,中国胃癌患者人数和死亡率明显高于全球水平,是国内死亡率最高的恶性肿瘤之一[1]。越来越多的研究表明,微小RNA(microRNA,miRNA)参与肿瘤细胞的分化、生长、增殖、凋亡等诸多病理调控过程,在肿瘤发生和发展中发挥重要作用[2]。miR-34是miRNA中的一类抑癌基因,包括3个同源基因:miR-34a、miR-34b和miR-34c。miR-34在多种肿瘤细胞中低表达,主要是由于其启动子区甲基化导致[3-4]。也有研究显示miR-34在胃癌组织中低表达[5],但目前尚未见关于胃癌中miR-34启动子甲基化状态,以及甲基化对miR-34表达的影响和对胃癌患者预后影响的研究报道。本研究拟通过实时荧光定量PCR法和甲基化特异性PCR法检测胃癌组织中成熟miR-34表达和miR-34基因启动子的甲基化状态,分析miR-34基因启动子甲基化状态与miR-34基因表达之间的关系,探讨miR-34基因启动子甲基化状态对患者预后的影响,以期为我国胃癌的发生提供分子生物学依据,并指导胃癌患者的预后。
1 对象与方法
1.1 研究对象
收集首都医科大学附属北京中医医院2015年12月至2017年6月消化内科收治的50例胃癌患者的胃腺癌组织和对应的距肿瘤>5 cm的癌旁正常胃黏膜组织标本,其中男性26例,女性24例,年龄范围为31~75岁,平均年龄为(63.45±11.53)岁,患者术前未进行任何化放疗。标本取出后随即用液氮保存,用于后续核酸提取和检测。依照第8版《AJCC癌症分期手册》[10]进行分期:TNM(topography,lymph node,metastasis)Ⅰ期 12例、Ⅱ期9例、Ⅲ期12例、Ⅳ期17例。入选标准:①所有患者均经纤维胃镜检查并经病理学确诊;②所有患者在手术前均未接受化疗及放射治疗;③同意本研究并签署知情同意者。排除标准:①未确诊为胃癌的消化系统疾病患者;②确诊为其它肿瘤患者;③不同意参加研究者。本研究经医院医学伦理委员会审批,并经得所有患者的知情同意后开展。
1.2 主要试剂和仪器
试剂:Trizol提取试剂(Invitrogen,美国),组织DNA抽提试剂盒[天根生化科技(北京)有限公司],Qiagen EpiTect Bisulfite Kit试剂盒(Qiagen,德国),Qiagen EpiTect MSP试剂盒(Qiagen,德国),Mir-X™miRNA First Strand Synthesis Kit[宝日医生物技术(北京)有限公司],Mir-X™miRNA qRTPCR SYBR®Kit[宝日医生物技术(北京)有限公司],miR-34甲基化和非甲基化引物[生工生物工程(上海)股份有限公司],见表1。

表1 miR-34甲基化引物Table 1 miR-34 methylation primers
仪器:Applied Biosystems 7500仪器(ABI,美国),Bio-Rad凝胶成像分析仪(伯乐,美国)。
1.3 方法
1.3.1 组织DNA和RNA提取
按组织和细胞DNA抽提试剂盒说明书抽提组织DNA,并测定浓度和纯度,用Trizol试剂提取细胞总RNA。
1.3.2 miR-34表达检测
根据试剂盒说明书进行逆转录反应,逆转录程序:37℃1 h。以逆转录产物cDNA为模板进行qPCR反应,PCR反应程序:95℃ 10 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,共 40 个循环;终延伸 72℃5 min。20 μL 反应体系:SYBR Advantage Premix(2×)8 μL,RO× Dye(50×)0.5 μL,miRNA-specific Primer(10 μmol/L)0.5 μL,mRQ 3’Primer 0.5 μL,cDNA 2 μL,ddH2O 补至 20 μL,得出各组 Ct值,以 2-ΔΔCt表示 mRNA 相对表达水平,所有反应均在ABI7500实时荧光定量PCR仪上完成。
1.3.3 DNA甲基化修饰及纯化
根据Qiagen EpiTect Bisulfite Kit试剂盒说明书进行miR-34亚硫酸氢钠处理及纯化,取3 μL溶液进行浓度及纯度的检测,纯化产物置于-20℃保存。
1.3.4 甲基化检测
根据Primer Premier 5软件设计1对非甲基化引物和1对甲基化引物,见表1。甲基化特异性PCR体系共25 μL,根据 EpiTect MSP试剂盒说明进行反应,25 μL 体系:EpiTect Master Mix(2×)12.5 μL、2 对引物各 0.5 μL、无核酸酶水 8.5 μL和模板DNA 3 μL。PCR反应条件:95℃10 min;94℃ 30 s,62℃ 30 s,72℃ 30 s,共 35 个循环;终延伸72℃10 min,去离子水作为阴性对照,并以Epi-Tect PCR Control DNA Set中甲基化和未甲基化DNA分别作为阳性和阴性对照。用2%琼脂糖凝胶对产物进行电泳,凝胶成像仪观察条带并拍照保存。出现甲基化条带(单一模式)或同时扩增出甲基化及非甲基化条带(混合模式)时则为甲基化阳性,只扩增出非甲基化条带时则为非甲基化。
1.3.5 随访
每6个月随访1次,以是否复发、转移或因胃癌死亡作为随访终点。复发是指肿瘤病灶再次出现在原有发病位置,转移是指肿瘤病灶脱离其原发部位,扩散到身体其他部位,统计所有患者复发或者转移情况。
1.4 统计分析
EpiData 3.1软件录入随访资料以及实验数据,使用SPSS 19.0软件进行资料分析,miR-34 DNA甲基化状态与miR-34表达、临床病理特征的关系应用相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌患者组织miR-34表达水平
荧光定量PCR结果显示,与癌旁组织相比,胃癌组织中miR-34 mRNA表达水平明显降低,差异具有显著性意义(P<0.05),见图1。
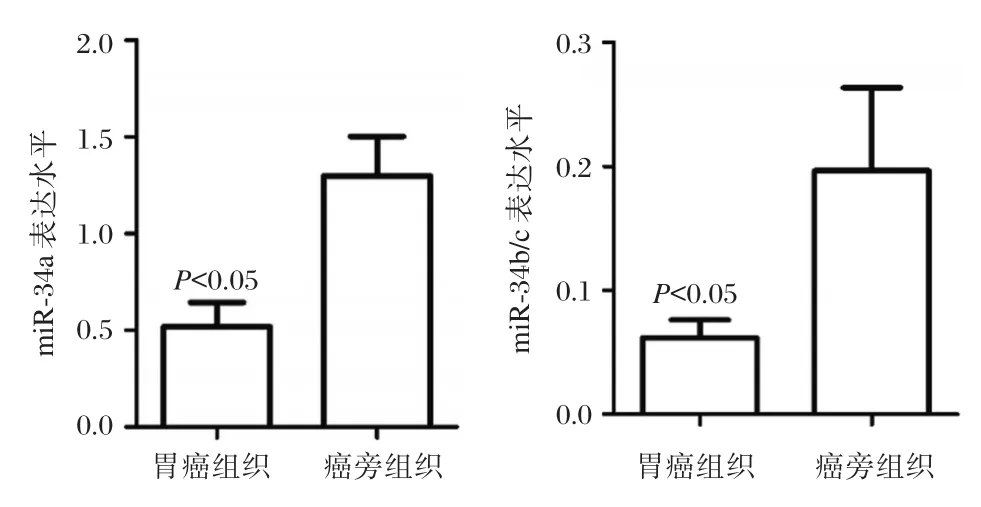
图1 miR-34表达水平Figure 1 miR-34 expression level
2.2 胃癌患者组织miR-34甲基化水平
甲基化特异性PCR实验结果显示,胃癌组织miR-34基因单一模式阳性有32例,非甲基化13例,混合模式5例;癌旁组织中单一模式阳性仅为12例,非甲基化34例,混合模式4例。电泳结果显示,miR-34a和miR-34b/c基因为单一条带,见图2。
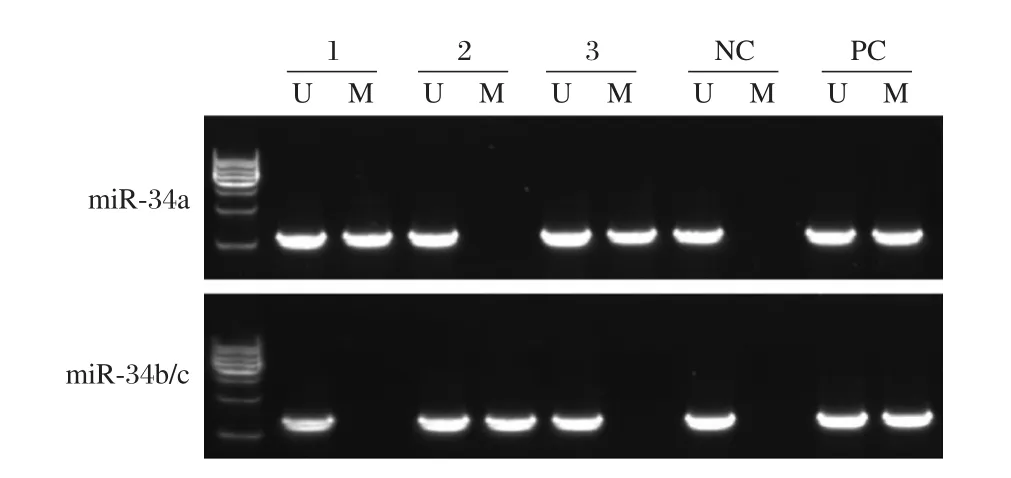
图2 miR-34甲基化电泳图Figure 2 The electrophorogram of miR-34 methylation
2.3 miR-34甲基化水平与临床病理参数的相关性
将miR-34甲基化水平与胃癌患者各临床病理参数之间的关系进行统计分析,结果发现miR-34甲基化水平与年龄、性别、肿瘤分期、肿瘤大小无明显相关性(P>0.05),与淋巴结转移呈明显相关性(P<0.05),见表2。
2.4 miR-34基因甲基化状态与成熟miR-34表达水平的关系
将50例胃癌患者标本按miR-34基因启动子的甲基化状态分为非甲基化组、甲基化单一模式组和甲基化混合模式组,非甲基化组中成熟miR-34a的表达水平明显增高,与甲基化单一模式组及混合模式组相比,差异均具有统计学意义(P<0.05),见图3。
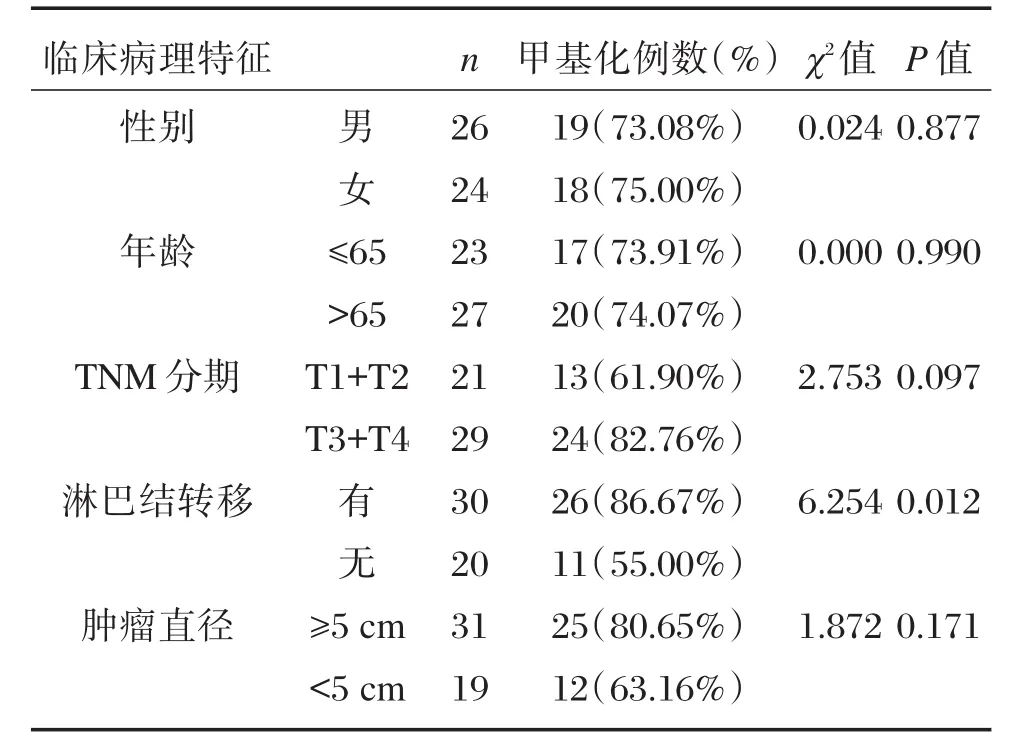
表2 miR-34甲基化水平与临床病理特征的相关性Table 2 Correlation of miR-34 methylation levels with clinicopathologic features
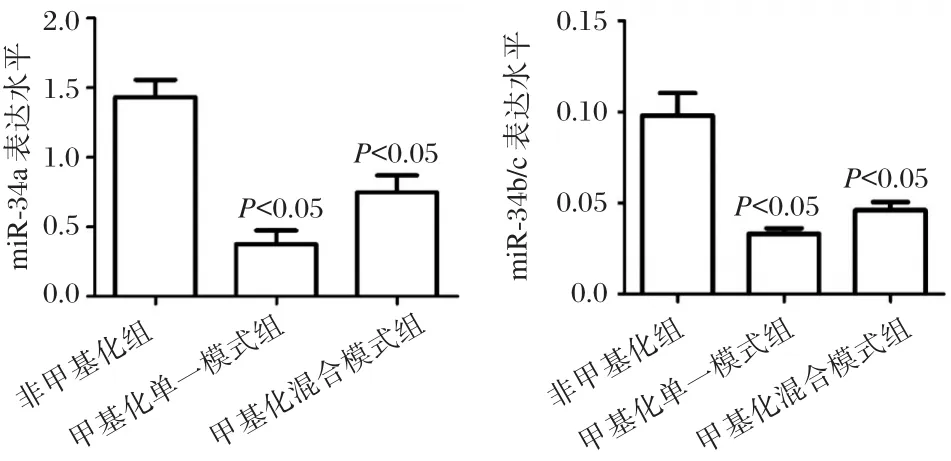
图3 miR-34基因甲基化状态与成熟miR-34表达水平的关系Figure 3 Relationship between miR-34 gene methylation and mature miR-34 expression
2.5 miR-34基因甲基化状态与胃癌患者生存的关系
50例患者中有44例术后随访2年,发现34例出现复发或转移,其中癌组织miR-34甲基化阳性30例(88.24%),而未复发或转移的10例患者中,癌组织miR-34甲基化阳性6例(60.00%),复发或转移患者癌组织miR-34甲基化率明显高于未复发组,差异具有统计学意义(χ2=4.141,P<0.05)。
3 讨论
肿瘤是一类多基因突变导致的疾病。近年来,随着肿瘤的分子生物学机制研究逐渐深入,表观遗传学修饰在肿瘤发生和发展中的作用逐渐清晰。肿瘤细胞具有很高的异质性,这种异质性主要来源于表观遗传学修饰[7]。miRNA作为一类由约22个核苷酸组成的非编码小分子RNA,其主要生理作用是通过与靶基因mRNA的3’端非编码区结合,调控靶基因mRNA活性,从而实现对靶基因的表达调控[8]。
在诸多研究中发现miR-34具有抑制肿瘤细胞生长和诱导细胞调亡等多种活性,与肿瘤抑制功能及致癌途径直接相关[9]。miR-34具有多个靶点,可同时在多个细胞信号通路上工作,从而产生协同作用。miR-34可通过靶向Wnt通路(Wingless与Int1结合,称为Wnt基因)和上皮-间质转换(epithelial-mesenchymal transistion,EMT)通路相关基因,如 WNT1、WNT3、LRP6、AXIN2、β-catenin、LEF1的UTRs,从而抑制Wnt通路和EMT通路[10-11]。研究表明,miR-34在多种肿瘤中,如肺癌、大肠癌、胰腺癌、乳腺癌、卵巢癌、尿路上皮癌和肾癌中都会有不同程度的表达下降[12]。本研究结果显示,与癌旁组织相比,胃癌组织中miR-34 mRNA表达水平明显降低,具有显著性差异,与其它癌种中的结果一致[12]。可能是降低表达的miR-34引起靶基因发生不同程度的表达变化,抑制细胞的凋亡,引起肿瘤的发生。
miR-34家族启动子均位于CpG岛,表达均由DNA甲基化调控。以前研究发现miR-34a启动子区在前列腺癌、膀胱癌、非小细胞肺癌等多种肿瘤细胞中呈现高甲基化状态,从而下调成熟的miR-34的表达[13-14]。我们发现在胃癌患者的胃癌组织中,miR-34启动子甲基化的比率较癌旁组织明显增高,进一步分析表明miR-34基因启动子区域的甲基化水平与成熟miR-34表达水平成负相关,提示miR-34基因启动子区域甲基化可能导致miR-34表达下调,这可能是胃癌的发病因素之一,也可能是胃癌发生之后才引起该变化。有研究表明,在某些胃癌细胞中,由于CpG岛的高度甲基化,从而产生表观遗传学的影响,使miR-34b和miR-34c表达沉默[15]。miR-34a在 MKN74和 AGS 胃癌细胞中则大量表达,在KatoIII、NUGC-3和SNU-16细胞中表达量较低。我们的研究显示在人胃癌组织中,miR-34a,b,c均呈现表达下调,并和启动子区域的甲基化水平相关。
进一步统计分析miR-34甲基化水平与胃癌患者各临床病理特征之间的关系,发现miR-34甲基化水平与淋巴结转移呈明显相关性(P<0.05),这提示miR-34甲基化水平可能参与肿瘤的发生和发展。同时,miR-34基因的启动子甲基化水平与患者的预后密切相关。我们发现miR-34的启动子甲基化患者在手术后有很大比例的复发和转移,与其它肿瘤组织中miR-34基因高甲基化导致肿瘤患者预后差的结果类似[16]。miR-34与p53抑癌通路相关,p53可能是miR-34表达和miR-34启动子甲基化的决定因素。有研究表明[17],p53/miR-34a轴可抑制L1CAM的表达,而L1CAM可减少卵巢和子宫内膜癌的预后和转移。因此,功能性p53的恢复可作为一种基因治疗方法,然而miR-34a由于分子量小,可能比p53更具优势成为肿瘤治疗的靶点,并可作为预后良好的有价值的预测指标。但本研究的样本量相对较小,结果可能具有一定的局限性,miR-34对胃癌患者的治疗和预后的相关性还需要多中心大样本研究加以补充和完善。